2. 山东中医药大学, 山东 济南 266071 ;
3. 山东省中医药大学附属医院, 山东 济南 250012
2. Shandong University of Traditional Chinese Medicine, Jinan 266071, Chian ;
3. Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250012, China
党参Codonopsis Radix为桔梗科植物党参Cdoonopisis pilosula (Farnch.) Nannf,素花党参Codonopsis pilousla Nannf. var.modesta (Nannf.) L. T. Shen或川党参Codonopsis tangshen Oliv. 的干燥根,其主要功效为补中益气、健脾益肺,主治脾肺虚弱、气短心悸、内热消渴[1-2]等症。党参多糖(CPP)为党参的主要成分之一,临床药理实验表明,CPP具有清除自由基、调节机体免疫力、抗衰老和造血的功能,临床上广泛用于调血脂、降血糖、抗衰老等[3-6]。目前国内和国外对CPP的研究集中在多糖提取工艺的优化[7-10],对多糖进一步的分离纯化以及活性研究还需要更深入的探索。本实验主要结合多糖得率和多糖的量,以多糖的提取率为指标,对CPP的提取工艺进行优化,得到提取效率较高的工艺,然后通过对多糖相对分子质量(M)测定方法的研究,得到粗多糖的单糖组成和M分布情况,为CPP的进一步分级研究奠定基础。
1 仪器与材料CP225D电子天平,德国sartorius公司;FZ102微型植物粉碎机,天津市泰斯特仪器有限公司;1260高效液相色谱仪,美国Agilent公司;2695型高效液相色谱仪,美国Waters公司,示差折光检测器,GPC色谱工作站;Mill-Q超纯水制备系统,德国Merck公司;TU-1901双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司。
党参,购自济南漱玉平民大药房,经山东中医药大学田景振教授鉴定为桔梗科植物党参Cdoonopisis pilosula (Farnch.) Nannf的干燥根;D-氨基半乳糖(批号1015126,质量分数≥98%)、D-核糖(批号140668,质量分数≥98%)对照品,德国Dr. Ehrenstorfer公司;D-甘露糖(批号140651- 201402,质量分数≥98%)、L-鼠李糖(批号111683- 201401,质量分数≥98%)、D-葡萄糖醛酸(批号140648-201402,质量分数≥98%)、D-半乳糖醛酸(批号111646-201201,质量分数≥98%)、D-葡萄糖(批号110833-201205,质量分数≥98%)、D-半乳糖(批号100226-201204,质量分数≥98%)、D-阿拉伯糖(批号111506-200001,质量分数≥98%)、D-木糖(批号111508-200404,质量分数≥98%)、系列M右旋糖酐对照品,D-2(批号140639-201203,M 5 250)、D-4(批号140641-201203,M 13 050)、D-5(批号140640-201203,M 36 800)、D-7(批号140644- 201203,M 135 350),购自中国食品药品检定研究院;其他试剂均为国产分析纯。
2 方法与结果 2.1 供试材料的处理根据预试验结果,取党参药材,在60 ℃真空干燥至恒定质量后粉碎,过65目筛,得党参药材干粉。取党参药材干粉500 g,置圆底烧瓶中,加入3倍体积的石油醚(30~60 ℃,脱脂液),加热回流5 h,倾去提取液,再次加入3倍体积的石油醚(30~60 ℃),回流提取5 h,重复操作3次,至样品提取液澄清为止。弃去提取液,取滤渣,置通风橱中挥干溶剂,置于60 ℃电热恒温干燥箱中烘干,得除去油脂的党参粉末。将脱脂后的党参粉末置圆底烧瓶中,加入3倍体积的95%乙醇溶液,回流提取6 h,弃去提取液,循环重复3次,取滤渣,置于60 ℃电热恒温干燥箱干燥,得除去低聚糖的党参粉末。
2.2 党参多糖定量测定参考文献方法[11-12],以葡聚糖(M 10 000)为对照品,采用苯酚-浓硫酸比色法测定多糖的量。
多糖提取率=粗多糖的质量/党参生药的质量
2.3 单因素试验取党参药材干燥至恒定质量后,粉碎过筛,经石油醚,95%乙醇提取,去除脂溶性成分和低聚糖,挥干溶剂后,采用水提醇沉法提取CPP。固定其他条件不变,分别考察料液比、提取温度、提取时间、提取次数对多糖提取率的影响。
2.3.1 料液比对CPP提取率的影响固定提取温度85 ℃、提取时间为1 h,提取次数1次,改变料液比(1∶5、1∶8、1∶10、1∶12、1∶15、1∶20)提取CPP,进行料液比单因素试验。结果CPP提取率分别为(8.7±1.0)%、(13.9±1.5)%、(18.5±1.7)%、(17.9±2.3)%、(16.4±1.8)%、(15.5±1.2)%(n=3)。料液比从1∶5增加到1∶10时,多糖得率呈明显上升趋势,从1∶10增加到1∶20时,多糖得率虽然有所降低,但变化趋势较为平稳,因此选取料液比为1∶8、1∶10、1∶12对CPP提取作正交试验,以确定最佳料液比。
2.3.2 提取温度对CPP提取率的影响固定料液比1∶10、提取时间1 h,提取次数1次,改变提取温度(55、65、75、85、95 ℃)提取CPP,进行提取温度单因素试验。结果CPP的提取率分别为(8.7±1.0)%、(10.3±0.9)%、(14.7±1.3)%、(17.6±1.9)%、(16.1±1.2)%(n=3)。提取温度从55 ℃增加到85 ℃时,多糖得率呈上升趋势,从85 ℃增加到95 ℃时,多糖得率有所降低,因此选取75、85、95 ℃对CPP提取作正交试验,以确定最佳提取温度。
2.3.3 提取时间对CPP提取率的影响固定提取温度85 ℃、料液比1∶10,改变提取时间(0.5、1、1.5、2、3、4 h)提取CPP,进行提取时间单因素试验。结果发现CPP提取率分别为(13.5±1.2)%、(18.4±0.9)%、(19.3±1.6)%、(18.8±1.8)%、(16.1±1.3)%、(14.3±1.1)%(n=3)。随着提取时间的延长,多糖得率呈上升趋势,但提取时间超过2 h,多糖得率有所降低,因此选取1、1.5、2 h对CPP提取作正交试验,以确定最佳提取时间。
2.3.4 提取次数对CPP提取率的影响固定提取温度85 ℃、提取时间为1 h,料液比1∶10,改变提取次数(1、2、3、4、5)提取CPP,进行提取次数单因素试验。结果CPP提取率分别为(13.5±1.2)%、(18.4±1.3)%、(19.3±0.9)%、(18.8±1.0)%、(16.1±1.2)%(n=3)。随着提取次数的增多,多糖得率呈上升趋势,但提取2次后,再增加提取次数,多糖提取率变化不大,因此选取1、2、3次对CPP提取作正交试验,以确定最佳提取次数。
2.4 正交试验设计与分析根据单因素及预试验结果选定水提时影响CPP提取率的4个主要因素提取次数(A)、提取时间(B)、料液比(C)和提取温度(D)作为考察因素,以CPP的提取率为考察指标,选用L9(34) 正交表进行试验,各组上清液分别浓缩至100 mL,加乙醇至80%沉淀,冰箱静置过夜,离心。醇沉物分别用无水乙醇、丙酮、乙醚各洗1次,40 ℃真空干燥至恒定质量,测定CPP的提取率[13-14]。试验设计及结果见表 1。方差分析见表 2。
|
|
表 1 正交试验设计及结果 Table 1 Design and results of orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
由表 1、2可知,各因素对多糖提取率的影响大小依次为D>A>C>B,最优组合为A2B2C3D2,即确定CPP的最佳提取工艺为将党参药材干燥至恒质量,粉碎后,在提取温度为85 ℃,料液比为1∶12,提取时间为1.5 h的情况下提取2次。在最佳条件下进行3次平行实验,多糖提取率分别为22.47%、22.18%、23.02%,平均提取率为22.57%。
2.5 CPP的纯化取党参水提液,浓缩至100 mL,加乙醇至80%沉淀,冰箱静置过夜,离心,取醇沉物于40 ℃真空干燥至无乙醇,加入10倍量蒸馏水,搅拌溶解,向多糖溶液中加入Sevage试剂(氯仿-正丁醇4∶1),至终体积分数为20%,超声15 min,在4 500 r/min下,离心15 min。收集上清液,再次加入Sevage试剂,重复上述步骤,直至无变性蛋白沉降为止,得到澄清的多糖溶液。
取CPP溶液,于以DE-52纤维素为填充剂的玻璃柱上,先用0.5 mol/L NaCl溶液脱液,再使用1 mol/L NaCl洗脱多糖样品,收集洗脱液,用苯酚-浓硫酸法检测洗脱液中多糖的量,直至无多糖检出为止,浓缩洗脱液。将浓缩后的CPP洗脱液灌入透析袋中,再用封口夹密封透析袋另一端口,24 h自来水循环透析,以除去多糖中的色素和洗脱后残留NaCl及其他的小分子物质。将透析后的多糖旋蒸浓缩,将浓缩后的多糖溶液装入5 mL西林瓶中,多糖液面不可超过西林瓶高的1/4,防止真空冷冻干燥过程中多糖的逸出,放入−8 ℃冰箱中预冷冻16 h;再放入真空冷冻干燥机24 h,得到CPP的干燥样品[15-17]。
2.6 HPLC测定CPP水解产物的单糖组成 2.6.1 色谱条件色谱柱为Agilent Zorbox SB-C18(150 mm×4.6 mm,5 μm);流动相为磷酸盐缓冲溶液(pH 8.2)-乙腈(83∶17);体积流量1.0 mL/min;检测波长为245 nm;柱温35 ℃。
2.6.2 混合单糖对照品溶液的配制精密称取一定量的10种单糖对照品,加超纯水溶解并定容,得到混合对照品溶液(D-甘露糖0.340 mg/mL、L-鼠李糖0.411 mg/mL、D-葡萄糖醛酸0.298 mg/mL、D-半乳糖醛酸0.231 mg/mL、D-葡萄糖0.451 mg/mL、D-半乳糖0.198 mg/mL、D-木糖0.315 mg/mL、D-氨基半乳糖0.219 mg/mL、D-核糖0.342 mg/mL、D-阿拉伯糖0.257 mg/mL)。
2.6.3 多糖的水解样品的制备[18]准确称取多糖0.5 g,置于带塞的试管内,加入10 mL 1 mol/L的H2SO4于沸水浴中水解8 h,用高纯水代替1 mol/L的H2SO4,于沸水浴中2 h作为空白对照。水解结束后,将水解液和空白对照于10 000 r/min离心10 min。取水解液4.5 mL用2 mol/L的NaOH中和至pH值为7,并定容至10 mL,10 000 r/min,离心10 min,取上清液待衍生化。
2.6.4 柱前衍生化处理[19]取多糖水解样品溶液和混合对照品溶液各50 μL,分别与50 μL 0.5 moL/L的PMP甲醇溶液及50 μL 0.3 mol/L的NaOH溶液涡旋混合30 s,在70 ℃条件下反应30 min,冷却至室温,加入50 μL 0.3 mol/L的HCl进行中和并加入100 μL高纯水稀释混匀,加入900 μL氯仿涡旋混匀30 s静置5 min,吸取下层液弃去。从“加入900 μL氯仿”起重复操作3次,即得衍生化样品。
2.6.5 样品的测定取衍生化后的样品溶液和对照品溶液各10 μL,进样,测定。
2.6.6 CPP水解产物的单糖组成测定结果结果显示CPP主要由葡萄糖醛酸、氨基半乳糖、木糖和少量甘露糖组成。单糖对照品溶液色谱图见图 1-A,多糖水解产物的HPLC图见图 1-B。
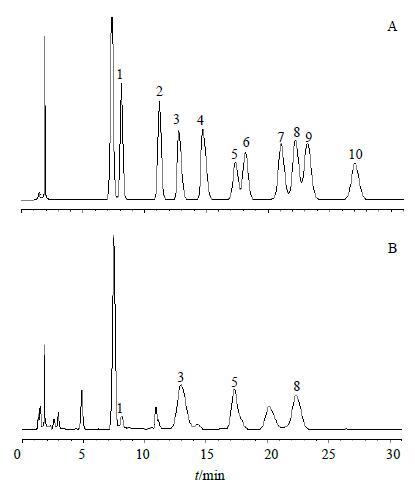
|
图 1 混合单糖对照品 (A) 和CPP水解产物 (B) HPLC图 Fig.1 HPLCof mixed monosaccharide reference substances (A) and monosaccharide composition of CPP (B) |
2.7 高效凝胶色谱(HPGPC)法测定CPP平均M 2.7.1 色谱条件
色谱柱为Shodex OHPak SB-803 HQ(300 mm×8.0 mm,10 μm),流动相为0.71%硫酸钠溶液(内含0.02%叠氮钠),柱温35 ℃,示差折光检测器(检测器温度35 ℃),体积流量0.5 mL/min,进样量20 μL。
2.7.2 对照品溶液的制备取右旋糖酐D2、D4、D5、D7对照品适量,精密称定,加流动相分别制成1.5 mg/mL的溶液,即得。
2.7.3 供试品溶液的制备取CPP适量,加流动相制成约含10 mg/mL的溶液,振摇,室温放置过夜,作为供试品溶液。
2.7.4 标准曲线的制备取上述右旋糖酐系列对照品溶液分别进样,记录洗脱峰的保留时间,由GPC专用软件[5]绘制标准曲线,以对照品M的对数值为纵坐标(Y),以相应色谱峰的保留时间为横坐标(X)进行线性回归,得回归方程Y=−0.328 9 X+8.868 5,R2=0.999 5。
2.7.5 样品测定根据GPC专用软件绘制的标准曲线及供试品的保留时间,采用GPC专用软件计算样品各组分的重均相对分子质量(Mw)及其M分布。HPGPC结果见图 2。
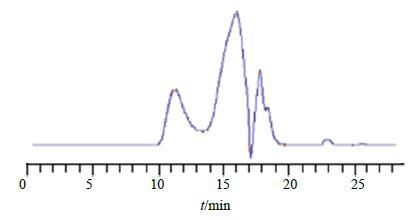
|
图 2 CPP的HPGPC图 Fig.2 HPGPC of GPC |
2.7.6 CPP的平均M测定结果
取多糖样品,平行测定6份,取其平均值。其结果显示Mw为21 498,RSD为2.12%,数均相对分子质量(MN)为11 730,RSD为1.98%。
3 讨论本研究在单因素试验的基础上采用正交设计对CPP的提取方法进行优化,并采用柱前衍生HPLC法和HPGPC法对CPP水解后的单糖组成和M进行研究。结果表明,CPP的最佳提取工艺为党参药材经干燥、粉碎,然后经过石油醚脱脂,95%乙醇脱去低聚糖,挥干溶剂,在提取温度为85 ℃,料液比为1∶12,提取时间为1.5 h的情况下提取2次,CPP的提取率达到22.57%。将上述CPP经过脱蛋白、脱色、透析和冷冻干燥处理得到精制多糖,采用HPLC法对CPP单糖组成进行分析,结果显示CPP主要由葡萄糖醛酸、氨基半乳糖、木糖和少量甘露糖组成;以不同M的右旋糖酐为对照品,经GPC软件处理,测定CPP的Mw为21 498,共得到4个组分。研究表明[20-21],CPP具有清除自由基、调节机体免疫等功能,是一种具有极大开发利用价值有效部位。本实验对CPP的提取方法、单糖组成和M分布进行了研究,对CPP的提取提供理论依据,并为CPP的分级和活性研究提供了物质基础。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 张雪梅. 党参多糖的研究概况[J]. 辽宁中医药大学学报 , 2015, 17 (12) :227–229. |
| [3] | Li Z T, Zhu L B, Zhang H, et al. Protective effect of a polysaccharide from stem of Codonopsis pilosula against renal ischemia/reperfusion injury in rats[J]. Carbohydr Polym , 2012, 90 (10) :1739–1743. |
| [4] | Liu C, Chen J, Li E T, et al. The comparison of antioxidative and hepatoprotective activities of Codonopsis pilosula polysaccharide (CP) and sulfated CP[J]. Int Immunopharmacol , 2015, 24 (3) :299–305. |
| [5] | Yang C X, Gou Y Q, Chen J Y, et al. Structural characterization and antitumor activity of a pectic polysaccharide from Codonopsis pilosula[J]. Carbohydr Polym , 2013, 98 (2) :420–429. |
| [6] | 伍春, 侯茜, 胡锋. 素花党参对D-半乳糖致衰老小鼠皮肤抗氧化能力的影响[J]. 中药药理与临床 , 2014, 30 (2) :92–97. |
| [7] | Zou Y F, Chen X F, Yang W Y, et al. Response surface methodology for optimization of the ultrasonic extraction of polysaccharides from Codonopsis pilosula Nannf. var. modesta L. T. Shen[J]. Carbohydr Polym , 2011, 84 (12) :503–508. |
| [8] | Sun Y X, Liu J C. Structural characterization of a water-soluble polysaccharide from the Roots of Codonopsis pilosula and its immunity activity[J]. Int J Biol Macromol , 2008, 43 (5) :279–282. |
| [9] | Zhang Y J, Zhang L X, Yang J F. Structure analysis of water-soluble polysaccharide CPPS3 isolated from Codonopsis pilosula[J]. Fitoterapia , 2010, 81 (1) :157–161. |
| [10] | 范济民, 蒋小丽, 赵志换, 等. 山西党参多糖提取工艺的优化[J]. 化学与生物工程 , 2012, 15 (9) :47–50. |
| [11] | 胡居吾, 范青生, 肖小年. 粗多糖测定方法的研究[J]. 江西食品工业 , 2005, 20 (1) :16–18. |
| [12] | 鲁晓岩. 硫酸-苯酚法测定北冬虫夏草多糖含量[J]. 食品工业科技 , 2002, 23 (4) :69–71. |
| [13] | Liu H M, Wang F Y, Liu Y L. Hot-compressed water extraction of polysaccharides from soy hulls[J]. Food Chem , 2016, 202 (1) :104–109. |
| [14] | Hu J, Jia X J, Fang X B. Ultrasonic extraction, antioxidant and anticancer activities of novel polysaccharides from Chuanxiong rhizome[J]. Int J Biol Macromol , 2016, 85 (1) :277–284. |
| [15] | 王卫国, 赵永亮. 一种在多糖分离纯化过程中新的脱蛋白方法[J]. 中草药 , 2003, 34 (10) :891–895. |
| [16] | 任丽靖, 张静, 刘志存, 等. 党参多糖的分离纯化及其结构研究[J]. 中草药 , 2008, 39 (7) :987–989. |
| [17] | 李艳, 鲁建江, 孙萍, 等. 新疆党参多糖的提取及含量测定[J]. 新疆中医药 , 2001, 19 (3) :9–10. |
| [18] | Zhang Y J, Zhang L X, Yang J F. Structure analysis of water-soluble polysaccharide CPPS3 isolated from Codonopsis pilosula[J]. Fitoterapia , 2010, 81 (6) :157–161. |
| [19] | Sun Y X, Liu J C. Structural characterization of a water-soluble polysaccharide from the roots of Codonopsis pilosula and its immunity activity[J]. Int J Biol Macromol , 2008, 43 (2) :279–282. |
| [20] | Du N N, Wei T B, Zheng D F, et al. Extraction, purification and elicitor activities of polysaccharides from Chrysanthemum indicum[J]. Int J Biol Macromol , 2016, 86 (1) :347–354. |
| [21] | 郭晓农, 戚欢阳, 王兵. 党参多糖对衰老模型小鼠的抗衰老作用[J]. 中国老年学杂志 , 2013, 33 (11) :5372–5375. |
 2016, Vol. 47
2016, Vol. 47


