2. 吉林省轻工业设计研究院, 吉林 长春 130012
2. Jilin Province Light Industry Design and Research Institute, Changchun 130012, China
葡萄多酚是葡萄中所有酚类物质的总称,具有较强的抗氧化、抗自由基损伤、抗辐射及保护心血管等生物学活性[1-4]。由于葡萄多酚在酿酒葡萄皮、籽中量丰富,因此,开展酿酒葡萄皮、籽综合利用,不仅可以获得良好的经济效益,而且环保,具有较好的社会效益[5-6]。但葡萄多酚对碱、光、热、金属离子、氧化剂等十分敏感,易于被氧化和破坏,大大限制了其使用范围[7-8]。微胶囊化可以将葡萄多酚进行微胶囊包埋,将其封闭在囊膜内与外界环境隔离,提高其在环境中的稳定性,避免包埋物在口腔中迅速溶化,使葡萄多酚在消化道中缓慢释放,发挥营养作用,因此葡萄多酚微胶囊有巨大的应用潜力[9-11]。
壳聚糖是由甲壳素经脱乙酰化制备的天然高分子直链碱性多糖,具有独特的物理化学特性。由于壳聚糖分子链上有大量的伯胺基,海藻酸钠的分子链上有大量的羧基,在静电力作用下,可以通过正、负电荷吸引形成聚电解质膜。因其良好的生物相容性、可降解的特性、极小的毒性,经济,可用来包埋一些水溶性芯材,特别适于包埋生物活性成分[12-13]。
海藻酸钠是从海藻中提取的多糖类,具有独特的凝胶性能,并且具有增稠、稳定、乳化、分散和成膜的能力,而且与大多数防腐剂、增稠剂和乳化剂具有良好的相容性,因而被广泛地用于食品、医药等行业[14-17]。海藻酸是难溶性弱酸,沉淀pH值为3.6以下,溶解pH值为5.8,具有很强的抗消化酶能力。根据难溶性弱酸型肠溶包衣材料理论,沉淀pH值越低,越易在小肠上段溶解,药物的吸收就越快。海藻酸及其钙盐完全符合肠溶微胶囊材料的要求,故可用来微胶囊化酸敏感性成分,使其具有抗酸和肠溶特性[7]。
多孔淀粉是生淀粉酶在低于淀粉糊化温度下作用于生淀粉颗粒而形成的表面呈现蜂窝状的多孔变性淀粉,具有良好的吸水、吸油性能[18-19],在微胶囊化应用中,多孔淀粉可作为芯材载体,吸附目的物质,再用适宜的壁材包埋,实现双层包埋[20-21]。玉米淀粉具有较大的比表面积,结构紧密,不易酶解,制成的多孔淀粉具有更好的缓释性。
本实验以玉米多孔淀粉作为芯材载体,吸附葡萄多酚,用海藻酸钠、壳聚糖做壁材,氯化钙做固化液,用复凝聚法完成微胶囊化过程,通过单因素及正交试验,对微胶囊的形态、载药量、包埋率等指标进行分析,并对微胶囊结构表征,以期建立制备葡萄多酚缓释微胶囊合理的工艺条件,为提高葡萄多酚的稳定性提供了可行的途径,同时为其更广泛的应用提供科学的理论基础。
1 仪器与材料Lyolab3000冷冻干燥机,丹麦Heto公司;UV5100B紫外可见分光光度计,上海元析仪器有限公司;GL-21LM高速冷冻离心机,湖南星科科学仪器有限公司;KQ-50TDB型高频数控超声波清洗器,昆山市超声仪器有限公司;注射器(针头内径0.5 mm);85-2型恒温磁力搅拌器,郑州长城科工贸有限公司;粒径分析仪,新乡高服筛分机械有限公司;JSM-5600LV扫描电子显微镜(SEM),日本电子株式会社;傅里叶变换红外光谱(FTIR)仪,美国尼高力公司。
葡萄多酚为酿酒葡萄皮、籽提取的混合多酚,多酚质量分数≥80%,本实验室制备[22-23];玉米多孔淀粉,吸水率≥105%,吸油率≥95%,本实验室制备[18-19];海藻酸钠,黏度:1.05~1.15 Pa·s,天津市光复精细化工研究所;壳聚糖,脱乙酰度:80.0~95.0,黏度:50~800 mPa·s,国药集团化学试剂有限公司;氯化钙、冰醋酸、95%乙醇、没食子酸、抗坏血酸、硫酸亚铁、酒石酸钾钠、钨酸钠、钼酸钠、磷酸、硫酸锂、无水碳酸钠均为国产分析纯。
2 方法与结果 2.1 微胶囊粒径大小及芯材用量的测定方法干燥后的微胶囊用粒径分析仪的标准分样筛进行筛分,称量残留在各个分样筛上微囊的质量,并计算其占微囊总质量的百分比,以百分数表示粒径分布(Sm)=m1/M,式中Sm为粒径分布(%),m1为某一粒径范围的葡萄多酚微胶囊的质量(g),M为葡萄多酚微胶囊的总质量(g)。
采用Folin-Ciocalteu法测定葡萄多酚量[23],以没食子酸为对照品绘制标准曲线,得回归方程Y=0.117 5 X+0.008 8,R2=0.999 9,式中X为没食子酸对照品的质量浓度(mg/L),Y为吸光度(A),计算葡萄多酚溶液质量浓度和洗涤液中葡萄多酚的量。葡萄多酚微胶囊的载药量和包埋率按公式计算。
载药量=(P1V1-P2V2)/M
包埋率=(P1V1-P2V2)/P1V1
P1为所要包埋的葡萄多酚溶液质量浓度(mg/mL),V1为用于包埋的葡萄多酚溶液体积(mL),P2为滤液及洗涤液中葡萄多酚的质量浓度(mg/mL),V2为滤液及洗涤液体积(mL),M为干燥后胶囊质量(g)
2.2 微胶囊制备方式的选择 2.2.1 一步法正向操作取一定量的葡萄多酚溶液与海藻酸钠溶液混合,置于烧杯中,磁力搅拌,常温下控制转数400 r/min;取一定体积壳聚糖溶液和氯化钙溶液混合,调pH值,将混合液用针头匀速滴入葡萄多酚溶液与海藻酸钠溶液的混合液中。滴完后缓慢搅拌,静置20 min,滤过分离,收集滤液,将分离出的胶囊粒水洗,收集洗涤液,测定滤液与洗涤液的总体积,并取1 mL测定A值,计算葡萄多酚的量。再经真空干燥得微胶囊制品。
2.2.2 一步法反向操作取一定体积的壳聚糖溶液和氯化钙溶液混合,调pH值,置于烧杯中,磁力搅拌,常温下控制转数400 r/min;将一定量的葡萄多酚溶液与海藻酸钠溶液混合,将混合液用针头匀速滴入壳聚糖溶液与氯化钙溶液的混合液中,滴完后缓慢搅拌,静置20 min,滤过分离,收集滤液,将分离出的胶囊粒水洗,收集洗涤液,测定滤液与洗涤液的总体积,并取1 mL测定A值,计算葡萄多酚的量。再经真空干燥得微胶囊制品。
2.2.3 玉米多孔淀粉的添加称取一定量的玉米多孔淀粉,加入一定体积的葡萄多酚溶液中,在室温下振荡吸附10 min,然后加入海藻酸钠溶液,混合搅拌,再按上述正、反向操作进行包埋。
2.2.4 微胶囊制备方式的选择结果通过试验比较可以看出,正向操作过程中,微囊粒容易粘连,海藻酸钠-壳聚糖为壁材制备的微胶囊干燥后凹陷成片状,而以玉米多孔淀粉为芯材载体、海藻酸钠-壳聚糖为壁材制备的微胶囊与单纯的海藻酸钠-壳聚糖微胶囊葡萄多酚包埋率相当,但其外形饱满、粒径较小。综合以上结果选用玉米多孔淀粉为芯材载体,海藻酸钠-壳聚糖作为壁材按照反向操作包埋葡萄多酚。性状表征及包埋率测定结果见表 1。
|
|
表 1 不同制备方式所得的微胶囊 Table 1 Microcapsules obtained by different preparations |
2.3 调节pH值试剂的选择
在相同制备条件下,将壳聚糖溶液与氯化钙溶液混合后,分别选用碱性溶液NaOH、Na2CO3、NaHCO3调节pH值至3~4,观察滴加过程中混合液的变化及形成的微胶囊形态并测定葡萄多酚的包埋率。结果见表 2。
|
|
表 2 不同碱性溶液对微胶囊化的影响 Table 2 Effects of different alkaline solutions on microencapsulation |
壳聚糖不溶于水和碱溶液,可溶于大多数低质量浓度无机酸或有机酸(如盐酸、醋酸)生成盐,故常将它溶于稀醋酸中使用。海藻酸盐制成的微胶囊,芯材释放对pH值有依赖性。海藻酸是难溶性弱酸,沉淀pH值为3.6以下,溶解pH值为5.8。因此进行微胶囊化过程中要对混合液的pH值进行调试,而壁材中的Ca2+对碱性溶液具有较强的选择性,易产生沉淀,从而影响Ca2+浓度,影响胶囊化强度。通过表 2成囊的描述,可知各种碱性溶液对包埋率影响不大,用NaHCO3调节后所形成的湿囊强度稍好,因此选择用弱碱NaHCO3调节pH值。
2.4 单因素考察微胶囊成囊因素的影响 2.4.1 海藻酸钠质量浓度对微胶囊成囊的影响海藻酸钠溶液黏稠度较高,高质量浓度海藻酸钠溶液不能顺利滴下成滴。配制不同质量浓度的海藻酸钠溶液,各取30 mL,各加入多孔淀粉1 g,10 mL芯材溶液。取0.01 g/mL壳聚糖溶液和0.05 g/mL氯化钙溶液各50 mL混合,制备葡萄多酚微胶囊,考察海藻酸钠质量浓度对微胶囊的影响。不同质量浓度海藻酸钠对成囊的影响分别为0.01 g/mL:形成的胶粒几乎没有强度,直接去除;0.02 g/mL:成囊较慢,可连续滴下,易叠加,形状多样;0.03 g/mL:成囊快,形状大小均匀一致;0.035 g/mL:成囊快,溶液黏稠,不易滴下,有拖尾现象。因此选择海藻酸钠溶液质量浓度0.03 g/mL,成囊效果最佳。
2.4.2 壳聚糖质量浓度对微胶囊成囊的影响在质量浓度0.03 g/mL海藻酸钠溶液30 mL、多孔淀粉1 g、10 mL芯材溶液、0.05 g/mL氯化钙溶液50 mL、pH值3条件下,考察不同质量浓度(0.005、0.010、0.015、0.020 g/mL)壳聚糖溶液50 mL对包埋效果的影响,结果包埋率分别为(65.83±0.61)%、(78.19±0.81)%、(76.31±0.77)%、(75.57±0.71)%,可见,前期随着壳聚糖质量浓度的增加,形成微胶囊的机会增加,包埋率也随之增加;但当壳聚糖质量浓度超过0.010 g/mL时,壁材量过高,壁材之间碰撞的机会增加,而壁材芯材之间碰撞的机会减少,故包埋率降低[24]。故选择壳聚糖质量浓度0.010 g/mL,包埋率最高。
2.4.3 氯化钙质量浓度对微胶囊成囊的影响5 mL芯材溶液、1 g多孔淀粉与0.03 g/mL的海藻酸钠20 mL混合后,滴入0.01 g/mL壳聚糖溶液50 mL与不同质量浓度氯化钙溶液50 mL的混合溶液中,制备微胶囊,考察氯化钙质量浓度对成囊状态的影响。不同质量浓度氯化钙下的成囊状态分别为0.02 g/mL:不成囊;0.03 g/mL:刚滴下时界面张力较强成片状,搅拌后包裹;0.04 g/mL:刚滴下时有较弱表面张力,部分呈片状;0.05 g/mL:滴下时基本呈圆球,包裹成囊较快;0.06 g/mL:滴下时基本呈圆球,包裹成囊较快。0.05和0.06 g/mL时微胶囊成囊状态较好,但区别不大,因此选择氯化钙质量浓度为0.05 g/mL。
2.4.4 葡萄多酚质量浓度对微胶囊成囊的影响取不同质量浓度的葡萄多酚溶液10 mL,与1 g多孔淀粉混合,加入0.03 g/mL海藻酸钠溶液30 mL中混合,用注射器滴入0.01 g/mL壳聚糖溶液50 mL与0.05 g/mL氯化钙溶液50 mL的混合液中,测微胶囊的包埋率和载药量,确定葡萄多酚溶液质量浓度。从表 3可知,随着葡萄多酚溶液质量浓度的提高,载药量随之增加,包埋率在质量浓度为25.4 g/L时达到最高,在质量浓度为30.0 g/L时包埋率却有所降低,因此在以后的实验中选用质量浓度25 g/L的葡萄多酚溶液。
|
|
表 3 葡萄多酚质量浓度对微胶囊包埋率和载药量的影响 (x±s,n = 3) Table 3 Effect of grape polyphenols concentration on entrapment efficiency and drug loading of microcapsules (x±s,n = 3) |
2.5 正交试验设计考察微胶囊成囊的影响因素
通过分析,选用25 mg/mL葡萄多酚溶液、0.03 g/mL海藻酸钠溶液、0.05 g/mL氯化钙溶液50 mL、0.010 g/mL壳聚糖溶液50 mL,以pH值(A)、海藻酸钠溶液体积(B)、玉米多孔淀粉质量(C)、葡萄多酚溶液体积(D)4因素分别确定3个水平进行正交试验,以微胶囊载药量、包埋率、成囊状态为评价指标说明各因素对葡萄多酚包埋效果的影响。各因素水平及试验设计与结果见表 4。
|
|
表 4 正交试验设计及结果 Table 4 Design and results of orthogonal test |
由表 4正交试验结果可知,各因素影响微胶囊载药量的顺序为葡萄多酚溶液体积>pH值>玉米多孔淀粉用量>海藻酸钠溶液体积。最佳工艺条件为A2B1C2D3,即pH 3.5、海藻酸钠体积20 mL、玉米多孔淀粉用量1.0 g、葡多酚溶液体积15 mL。此时载药量最大达174 mg/g,但包埋率较小仅69.7%,且微胶囊颗粒偏小,部分粘连,即4组的实验结果,不予采纳。
由表 4可见,正交试验结果表明各因素影响微胶囊包埋率的顺序为葡萄多酚溶液体积>玉米多孔淀粉用量>海藻酸钠溶液体积>pH值。最佳工艺条件为A2B2C3D2,即pH 3.5、海藻酸钠体积30 mL、玉米多孔淀粉用量1.5 g、葡萄多酚溶液体积10 mL。以包埋率为考察指标,表 5方差分析结果表明,因素葡萄多酚溶液体积(D)对包埋率有显著影响,因素玉米多孔淀粉用量(C)、海藻酸钠溶液体积(B)、pH值(A)影响不显著。按此工艺条件进行验证实验,重复3次,测得葡萄多酚微胶囊包埋率分别为84.3%、83.6%、81.8%,平均包埋率为83.2%;载药量分别为155、149、141 mg/g,平均载药量为148 mg/g。说明该工艺比较稳定,重复性好,且微胶囊颗粒分散、粒径小、较饱满。
|
|
表 5 方差分析 (包埋率) Table 5 Analysis of variance (embedding rate) |
根据正交试验设计的组合制备微胶囊,干燥后观察各微胶囊表观形态,如表 4所述,对表观差的直接去除,再考虑载药量与包埋率,可看出2、3组的微胶囊形态比较好,且载药量及包埋率较高,选用2组和验证组做进一步的体外释放实验。
2.6 微胶囊形状及粒径分布最佳工艺条件下制备的微胶囊经干燥后观察大部分微囊为球形。用粒径分析仪的标准分样筛进行筛分,测微囊的囊径大小与分布,结果粒径1 180~1 000 μm占1.3%;1 000~850 μm占11.5%;850~710 μm占42.5%;710~600 μm占34.5%;600~500 μm占9.4%,500~425 μm占0.8%,符合高斯分布。
2.7 FTIR分析FTIR法是通过比较芯材包埋前后在IR区吸收的特征差异,来表征包埋物是否形成。若形成包埋物,芯、壁材分子间的非共价键作用,如疏水作用、范德华力和氢键,其键能会减弱,相应基团的吸收强度会变小。由此来表征芯、壁材分子是否产生了包埋作用。分别取适量的葡萄多酚、壁材(多孔淀粉、海藻酸钠和壳聚糖)、多孔淀粉与海藻酸钠和壳聚糖形成的壁壳、微胶囊样品,用KBr压片,扫描波数400~4 000 cm−1,进行IR扫描和分析[25]。
由图 1可知,芯材葡萄多酚在3 450 cm−1处存在O-H的伸缩振动峰,其特征骨架振动主要集中在625~1 650 cm−1区域。多孔淀粉与海藻酸钠和壳聚糖形成的壁壳是复合凝聚物,其FTIR特征吸收峰幅度明显变小,例如海藻酸钠在3 600~3 000 cm−1是O-H的伸缩振动峰,1 610 cm−1是-COO-不对称伸缩振动峰,1 421 cm−1是-COO-对称伸缩振动峰;壳聚糖在3 415 cm−1是O-H的伸缩振动峰,1 570 cm−1是氨基特征吸收峰;多孔淀粉在3 000~3 500 cm−1出现长而宽的O-H的伸缩振动峰,在930~1 150 cm−1出现的非对称C-O-C伸缩振动峰、C-O伸缩振动和骨架振动峰等,这些说明壳聚糖的-NH3+和海藻酸钠的-COO−通过静电作用发生了反应,同时也包埋了多孔淀粉。微胶囊样品的FTIR图谱变化较大,葡萄多酚特征吸收峰强度明显减弱,且微胶囊的FTIR图谱与壁壳图谱相似,这表明葡萄多酚进入了微胶囊内腔,证明了包埋物的生成。
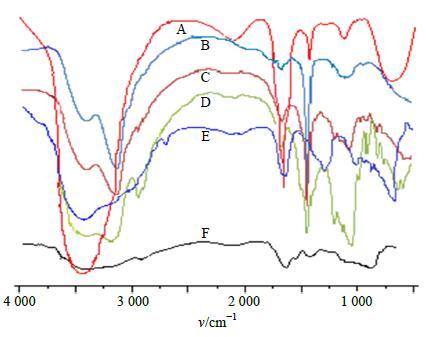
|
图 1 芯材 (葡萄多酚,A)、壁材 [壳聚糖 (B)、海藻酸钠 (C) 和多孔淀粉 (D)]、微胶囊 (E) 和多孔淀粉与海藻酸钠、壳聚糖形成的壁壳 (F) 的FTIR图 Fig.1 FTIR spectrum of core material (grape polyphenols,A),wall materials [chitosan (B),alginate sodium (C),and porous cornstarch (D)],microcapsules (E),and wall shell formed by porous starch with sodium alginate and chitosan (F) |
2.8 SEM扫描表征分析
SEM扫描是一种定性的方法,用于观察芯材、壁材、微胶囊的形态变化。芯材分子进入壁材分子空腔中,其结晶性会降低;同时壁材分子因包埋了芯材分子其自身结构的特定位置、空间结构等发生了变化,因此,可通过SEM扫描初步判定是否形成了包埋物。将多孔淀粉与海藻酸钠和壳聚糖形成的壁壳、微胶囊样品适量,用SEM观测其形态学特征。由SEM照片(图 2)可以看出,单纯壁材形成的壁壳与加入芯材葡萄多酚后形成的微胶囊表观特性相差较大。可明显看出多孔淀粉与海藻酸钠和壳聚糖形成的壁壳外观较粗糙,推测是微胶囊表面具有较多孔隙,而添加葡萄多酚后形成的微胶囊表面较光滑,即微胶囊表面发生变化,推测是由葡萄多酚引起的变化,即葡萄多酚被包埋。

|
图 2 添加芯材葡萄多酚前后的SEM图 Fig.2 SEM images before and after adding core material grape polyphenols |
2.9 体外释放实验 2.9.1 模拟胃液环境中的释放
准确称取1.00 g葡萄多酚微胶囊,置于100 mL具塞锥形瓶中,而后加入40 mL胃液模拟液(含0.09 mol/L NaCl的0.01 mol/L HCl溶液,pH值2.0)。将该锥形瓶放入恒温振荡器(37 ℃、60 r/min)中,分别在指定时间点取样1 mL,检测总酚的量,计算累积释放率,并补充等量模拟液[10]。
模拟胃液中的累积释放率=模拟胃液中释放的总酚量/ (加入的微胶囊质量×载药量)
2.9.2 模拟肠液环境中的释放取上述胃液模拟液中处理一定时间的微胶囊,分离后水洗,置于100 mL具塞锥形瓶中,加入40 mL肠液模拟液(含76.5 mmol/L NaCl的29 mmol/L磷酸缓冲液,pH值7.4),37 ℃、60 r/min,在指定时间取样1 mL,检测总酚的量,计算累积释放率,并补充等量模拟液[10]。
模拟肠液中的累积释放率=模拟肠液中释放的总酚量/ (加入的微胶囊质量×载药量)+模拟胃液中的释放率
2.9.3 体外缓释实验结果由表 6可见,在模拟胃液环境中停留2.5 h,2组和验证组制备的微胶囊中酚类物质的释放率分别为(20.65±0.50)%和(16.81±0.75)%,说明在pH 2的条件下,微胶囊表面海藻酸钠与壳聚糖的复合膜受到破坏程度较轻,内溶物释放缓慢。但在酸性溶液中停留时间越长,对被包埋物的扩散限制作用越小,进而导致微胶囊在模拟肠液环境中(pH 7.4)的控释能力降低,如表 7和表 8。
|
|
表 6 葡萄多酚微胶囊在模拟胃液中释放情况 (x±s,n = 3) Table 6 Time course of sustained release of grape polyphenols microcapsules in mimic gastric environment (x±s,n = 3) |
|
|
表 7 胃液处理1.5 h葡萄多酚微胶囊在模拟肠液中释放情况 (x±s,n = 3) Table 7 Time course of sustained release of grape polyphenols microcapsules in mimic intestinal environment after gastric juice processing for 1.5 h (x±s,n = 3) |
|
|
表 8 胃液处理2.5 h葡萄多酚微胶囊在模拟肠液中释放情况 (x±s,n = 3) Table 8 Time course of sustained release of grape polyphenols microcapsules in mimic intestinal environment after gastric juice processing for 2.5 h (x±s,n = 3) |
在模拟胃液环境中处理1.5 h,在模拟肠液环境中处理1.5 h,2组和验证组微胶囊中酚类物质的释放率分别为(38.76±0.52)%和(36.64±0.97)%,4.5 h释放率分别达(63.45±1.38)%和(73.83± 1.11)%;而在模拟胃液环境中处理2.5 h,在模拟肠液环境中2.5 h,2组和验证组微胶囊中酚类物质的释放率分别为(48.01±1.06)%和(51.49±1.64 )%,4.5 h释放率分别达(68.66±1.26)%和(77.87±1.38)%。由此说明制备的玉米多孔淀粉-海藻酸钠-壳聚糖微胶囊具有靶向性,可以用来作为肠中多溶胃中少溶的缓释载体;而且相同条件下,在模拟胃液环境中2组微胶囊的释放率较高,但在模拟肠液中释放率2组低于验证组,证明验证组缓释效果较好。
3 讨论海藻酸钠具有高的相对分子质量(MW)和高分子刚性,因而即使在较低质量浓度下也具有较高的表观黏度,如0.01 g/mL的海藻酸钠水溶液,20 ℃时黏度已达0.3~0.5 Pa·s,而且易形成透明且有很强韧性的薄膜[7]。海藻酸钠质量浓度越大,胶囊化成型效果越好。海藻酸钠质量浓度过高,则溶液黏度增大,滴加时阻力越大;但海藻酸钠质量浓度过低时,滴加时球粒难以控制,综合考虑选择海藻酸钠的质量浓度为0.03 g/mL。
低MW壳聚糖分子具有较低的空间位阻,极易扩散到海藻酸钙凝胶网络中进行成膜反应,生成的膜厚,抗膨胀能力较强,因此较低MW壳聚糖,有利于增加微胶囊膜厚度,提高微胶囊膜强度[15]。壳聚糖的质量浓度越大,形成的微胶囊膜越厚,机械强度也越高,且0.01 g/mL时成囊已较好,再考虑成本选0.01 g/mL的壳聚糖溶液,用体积分数为8%的醋酸溶液溶解配制。
氯化钙质量浓度越大成型效果越好,形成的海藻酸钙层越致密。原因可能是随着氯化钙溶液质量浓度的上升,溶液中可与海藻酸钠结合的Ca2+量增加,故而形成了更致密的凝胶结构和更大的直径。但质量浓度过大会降低包埋率和载药量[26],不利于微胶囊的干燥,色泽较深,并且当增加到0.05 g/mL时,形状及包埋度几乎达到稳定,继续增加质量浓度,影响效果不明显且颜色发暗,口感有涩味,因此选氯化钙质量浓度为0.05 g/mL。
由实验结果可以看出随葡萄多酚质量浓度的增大载药量逐渐增大,包埋率变化较小,故正交试验步骤中选用葡萄多酚质量浓度约为25.0 mg/mL。
正交实验包埋过程中,溶液中的葡萄多酚先到达多孔淀粉颗粒周围,然后通过吸附力进入淀粉颗粒内部的孔洞中,与海藻酸钠溶液搅拌混合均匀分散,滴入壳聚糖氯化钙混合溶液成囊,包埋过程受壳聚糖、氯化钙混合溶液pH值影响较小。
以包埋率为考察指标,方差分析进一步表明影响微胶囊包埋率的因素中,葡多酚溶液体积为显著性因素,玉米多孔淀粉用量、海藻酸钠溶液体积、pH值对微胶囊包埋率有一定影响。
综上所述,本实验采用玉米多孔淀粉和复凝聚法双层包埋葡多酚,确定制备葡萄多酚微胶囊的工艺条件为质量浓度0.03 g/mL海藻酸钠溶液30 mL,0.01 g/mL壳聚糖溶液50 mL,0.05 g/mL氯化钙溶液50 mL,pH值3.5,玉米多孔淀粉用量1.5 g,25 mg/mL葡萄多酚溶液10 mL时,葡萄多酚平均包埋率达83.2%,平均载药量为148 mg/g。用玉米多孔淀粉吸附葡萄多酚再用复凝聚法包埋,避免了单纯海藻酸钠-壳聚糖包埋葡萄多酚液体干燥后骨架容易凹陷的缺点,完善了胶囊形态,提高了包埋率,加强了缓释效果。
| [1] | 李双石, 李晓燕, 苑函, 等. 葡萄酒渣提取多酚化合物研究进展[J]. 酿酒科技 , 2012, 33 (12) :17–22. |
| [2] | Chiva-Blanch G, Urpi-Sarda M, Liorach R, et al. Differential effects of polyphenols and alcohol of red wine on the expression of adhesion molecules and inflammatory cytokines related to atherosclerosis: a randomized clinical trial[J]. Am J Clin Nutr , 2012, 95 (2) :326–334. |
| [3] | Weng C J, Yen G C. Chemopreventive effects of dietary phytochemicals against cancer invasion and metastasis: phenolic acids, monophenol, polyphenol, and their derivatives[J]. Cancer Treat Rev , 2012, 38 (1) :76–87. |
| [4] | 吕昕泽, 吴秀祯, 张卫. 葡萄多酚对心肌保护作用研究进展[J]. 药物评价研究 , 2012, 35 (1) :16–52. |
| [5] | 令博, 王捷, 吴洪斌, 等. 葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学 , 2011, 32 (18) :24–29. |
| [6] | 邱庆峰, 李良. 葡萄多酚在食品和饲料中的应用[J]. 饲料博览 , 2013, 26 (6) :44–47. |
| [7] | 吴克刚, 柴向华. 食品微胶囊技术[M]. 北京: 中国轻工业出版社, 2006 . |
| [8] | 王鑫, 王振宇, 徐宁, 等. 蓝靛果花色苷中粒度微胶囊的制备[J]. 食品工业科技 , 2011, 32 (7) :335–338. |
| [9] | 祝团结, 何松, 段慧琴. 微胶囊脱氢乙酸钠在面包生产中的应用[J]. 现代食品科技 , 2011, 27 (6) :687–690. |
| [10] | Yang J, Chen J, Pan D, et al. pH-sensitive interpenetrating network hydrogels based on chitosan derivatives and alginate for oral drug delivery[J]. Carbohydr Polym , 2013, 92 (1) :719–725. |
| [11] | Zhang Y L, Wei W, Lv P P, et al. Preparation and evaluation of alginate-chitosan microspheres for oral delivery of insulin[J]. Eur J Pharm Biopharm , 2011, 77 (1) :11–19. |
| [12] | Tamilvanan S, Karmegam S. In vitro evaluation of chitosan coated-and uncoated-calcium alginate beads containing methyl salicylate-lactose physical mixture[J]. Pharm Dev Technol , 2012, 17 (4) :494–501. |
| [13] | 刘喜纲, 刘沛, 陈大为, 等. 优选大黄总蒽醌结肠定位壳聚糖微球的制备工艺[J]. 中草药 , 2015, 46 (1) :38–42. |
| [14] | 潘永毅, 刘强, 蔡保塔, 等. 密闭性中药海绵敷料的制备研究[J]. 中草药 , 2014, 45 (4) :485–489. |
| [15] | 何荣军, 杨爽, 孙培龙. 海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J]. 食品与机械 , 2010, 26 (2) :166–170. |
| [16] | 马益华, 陈彦, 刘聪燕, 等. 微乳化-凝胶法制备微球固定化蜗牛酶并生物转化淫羊藿苷研究[J]. 中草药 , 2015, 46 (22) :3326–3332. |
| [17] | 于兆慧, 刘其媛, 崔莉, 等. 微球固定化蜗牛酶转化人参皂苷Rb1制备人参稀有皂苷Compound K研究[J]. 中草药 , 2014, 45 (21) :3092–3097. |
| [18] | Dura A, Blaszczak W, Rosell C M. Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J]. Carbohydr Polym , 2014, 101 (30) :837–845. |
| [19] | 周琼, 王浩东, 张博, 等. 响应面法优化微孔淀粉制备工艺[J]. 食品科学 , 2010, 31 (22) :216–220. |
| [20] | Xing Y, Xu Q, Ma Y, et al. Effect of porous starch concentrations on the microbiological characteristics of microencapsulated Lactobacillus acidophilus[J]. Food Funct , 2014, 5 (5) :972–983. |
| [21] | 马嫄, 段显萍, 刘芸, 等. 双层包埋制备嗜酸乳杆菌微胶囊及其应用[J]. 食品科学 , 2013, 34 (4) :99–103. |
| [22] | 卢晓霆, 王田田. 响应面法优化双水相提取葡萄皮多酚工艺[J]. 食品科技 , 2013, 38 (10) :217–223. |
| [23] | 卢晓霆, 王田田, 王军. 响应面法优化葡萄籽多酚提取工艺[J]. 食品工业科技 , 2013, 34 (24) :279–284. |
| [24] | 李超. 绿茶茶多酚的微胶囊化及其释放性能研究[J]. 食品工业 , 2014, 35 (11) :59–63. |
| [25] | 韩路路, 毕良武, 赵振东. 微胶囊的应用与表征方法研究进展[J]. 化工新型材料 , 2013, 41 (9) :178–180. |
| [26] | 孟庆廷, 陈万东. 壳聚糖-海藻酸钠叶绿素亚铁微胶囊的制备及缓释性能研究[J]. 食品科学 , 2010, 31 (20) :137–140. |
 2016, Vol. 47
2016, Vol. 47

