2. 天津中医药大学, 天津 300193 ;
3. 天津药物研究院 新药评价中心, 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China ;
3. Tianjin Center for New Drug Evaluation and Research, State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
中药临床功效的表达方式是中药研究的核心内容,而中药的药效物质基础及作用机制研究是揭示中药的作用原理和临床功效表达方式的重要路径,是中药临证配伍、遣药组方、指导临床实践和有效进行质量控制的基础和前提条件。随着中药现代研究的不断深入,中药的药效物质基础及作用机制逐渐被阐释。近年来,关于中药药效物质基础及作用机制的研究模式和方法,国内很多学者提出很多新的理论假说,诸如“霰弹理论”假说、“证治药动学”假说、“药效团药性”假说、“显效形式”新概念及“叠加作用”新假说等。特别是近些年来中药药性理论研究,为阐释中药的作用机制和配伍规律提供了新的视角和研究思路[1]。中药的药效物质基础及作用机制研究不但需要借助现代分析及化学生物学的研究方法,更重要的是必须依据中医理论认识中医药疗效的物质基础与药性和效应关系[2-7],达到既“源于中医药理论”又要“回归中医药理论”的目的,还要理解中药效应是确定中药质量标志物(Q-Marker)的基础。
本文从元胡止痛滴丸的药效物质基础出发,开展基于中药Q-Marker的元胡止痛滴丸的“性-效-物”三元关系和作用机制研究,建立中药药效物质基础与作用机制的研究策略和研究模式。本文所有药效物质基础研究的主要结果均来自本实验室的研究结果。以期通过味觉仿生模型并结合味觉、嗅觉受体分子对接筛选以及G蛋白偶联受体结合实验,从味(嗅)觉和功能属性表达,整体动物模型,离体器官、细胞等不同层次以及网络药理学、代谢组学及药动学等多个角度开展元胡止痛滴丸的药味(性)物质基础研究,以便系统阐释元胡止痛滴丸的药效作用及作用机制,并为“性-效-物”三元论中药药效物质基础与作用机制研究提供科学依据,进一步根据研究结果发现并确定中药质量标志物。
1 “性-效-物”三元论中药药效物质基础及作用机制研究的必要性 1.1 现有二元研究模式存在的问题以往研究基于“成分-药效”的生物模型方法的二元研究模式存在诸多问题,其忽视了中药“药性”的基本属性,对中药功能价值表征不完整。并且,不能很好地从中药的基本属性、理论的基本概念、术语出发,与中医辨证论治、治则、治法、配伍规律、药性理论等中医药理论的核心内容相关联,研究结果势必脱离理论内核,无法完整阐释中药的理论、临床特点和真实价值,甚则走向“唯成分论”“天然药”“化学药”研究的歧路。因此,继承和发展中医药理论需要遵循中医药理论体系基本架构和理论脉络,选择正确的研究路径和模型方法,循序渐进地阐释中医药理论内涵和中药治疗疾病的本质规律。
1.2 “药性”与“药效”均是中药的基本属性和有效性的核心内容传统中药药性理论认为:中药药性“法于四时”及“入腹知性”,即从中药性味的本体(物质基础)和其效用(生物效应)2个层面概括了性味的基本内涵,同时又说明二者是一个事物不可分割的互相对应的2个方面。药味的生物效应表达又可推演为药物作用的趋势(升降浮沉)、药物作用的靶点(归经)以及药效(功效)等不同的表达模式。由此出发,才能以普遍联系的视角,全面阐释中药五味理论的完整性。功能相同的药物由于性味不同而表现在作用趋势、作用位置(途径、通路)和作用功效的差异,并作为临证治法、遣药组方的重要依据。
“性”即中药的性味,是药物的特有属性,反映了中药的本质特征,是药性理论的重要组成部分。其与归经、升降浮沉、十八反和十九畏等共同构成药性理论基本内容。而性味配伍则是遣药制方的关键环节,是阐明中药作用机制的重要基础理论。“效”即中药的功能效用,在中医药理论中以“功能主治”的形式描述,反映中药具有的生物活性和防治疾病的作用。如木香“辛、苦,温,归脾、肾、大肠、三焦、胆经;行气止痛、健脾消食;用于胸脘胀痛、泻痢后重、食积不消、不思饮食。”
“药性”与“药效”(功效)均是中医药理论的核心概念,是从不同侧面、不同角度对中药的生物效应表达的客观描述。“药味(性)”和“药效”体现中药的“物质基础”作用人体疾病主体的不同层面、不同方式的生物效应表达形式,二者呈现复杂的离合关系。“性-效-物”的表征、相关性规律研究是阐释中药作用原理以及配伍规律、指导临床实践的重要依据和研究路径。
1.3 “药性”与“功效”是中药临证立法、遣药组方的重要依据药性理论是临证立法、配伍组方的重要依据。“五脏苦欲补泻用药论”被缪希雍誉为“用药第一义”,是临证立法的基本法则;“热者寒之,寒者热之”等寒热理论贯穿于中医的理法方药全过程,临床辨治中常依据寒热理论确立治疗大法,成为指导组方的重要准则;而“七情和合”(单行、相须、相使、相畏、相恶、相反、相杀)更是“药对”“方根”的关系及制方用药的基本原则。因此,根据药物的气、味进行配伍组合,是方剂组方的基本依据之一。
综上,“性-效-物”三元论基于中医药的生命观、系统论和普遍联系的理论特点,从中药的基本属性、理论的基本概念、术语出发,完整阐释中药治疗疾病的物质基础和作用机制。对于继承和发扬中医药宝贵经验、完整还原和阐释中医药理论、凸显中医药理论体系特点和指导临床实践均具有重要的意义。
2 “性-效-物”三元论中药药效物质基础及作用机制研究的可行性“性-效-物”三元论从整体视角,着眼于中药物质基础及其生物效应表达的“性、效、物”3个核心要素及其关联规律。其中,性(味)-效之间存在复杂的离合关系及其“物”的可拆分性是“性-效-物”三元论研究的基本依据,而现代化学生物学表征方法和界定依据是研究的难点。
2.1 “性-效”之间复杂的离合关系和关联规律及其物质基础的可拆分性是研究的前提和必要条件药性(味)与药效之间存在“性效等同”“性效有别”和“性效互参”等联系和规律。而药性(味)本身存在“一药二性”“一药多味”等情况。药性(味)的生物效应是其物质基础的多维客观表达,即所谓“入腹知性”。药性(味)与药效均有其物质基础,均是中药“物质-效用”对应关系的表现形式。采用中药化学成分提取分离方法,有目的地拆分获取不同部位、不同组群及不同成分,并进行“性(味)”“效”表征和界定,探索“性”“效”及其物质基础之间复杂的离合关系和关联规律。
2.2 味(嗅)觉仿生模型及生物效应表征方法 2.2.1 拆分方法基于化学分离、色谱纯化等方法拆分和获得药材、总提物、不同部位、单体成分等不同样品,用于性效筛选及确定研究方案;基于多种联用技术及波谱分析,辨识及确证化学物质组。中药性味具有多元性特征,五味概念中包含真实滋味和功效2种内涵,且同一味中药可同时兼有2种以上的性味,这是由中药的复杂化学物质群所决定的。五味及其物质基础的研究和表征必须基于其可拆分性的前提下来实现。采用系统化学分离等技术方法,获取不同的物质群,应用仿生技术手段对五味物质基础界定和表征,进一步采用HPLC-MS、系统化学分离、波谱结构确证等技术方法,确定五味的物质基础构成。
2.2.2 基于味(嗅)觉仿生模型的“真实五味”表征方法五味最初的定义源于人们对中药滋味、气味的实际感受,故有“非口不能味也”。以电子舌、电子鼻等为代表的味觉、嗅觉仿生手段对食品的味觉、嗅觉进行客观、量化的划分和表征,在食品行业得到广泛地应用,借此技术手段对中药五味识别和表征是可行的。嗅觉受体是一种膜蛋白,其三维结构尚未被解析,需要借助计算机进行模拟,并与中药小分子辛味成分进行对接,可进一步从分子水平表征和阐释辛味的物质基础及其表达原理。苦味的产生是由于味觉物质作用于味觉感受器(味蕾)上,目前已发现苦味的味觉相关受体为TAS2Rs家族[8],是一类7次跨膜的G蛋白偶联受体(GPCR)[9],且研究发现苦味受体能与多数苦味中药的化学成分结合,中药苦味物质激活依赖于T2R受体基因,可认为苦味中药的味觉表达与T2R受体有一定联系。利用味觉、嗅觉受体与中药中的化学成分进行分子对接,进一步界定“真实五味”的物质基础。
2.2.3 基于生物效应模型的“功效五味”表征方法(1) 基于寒热病因学的药性相关动物模型:“温、热、寒、凉”四气是药性理论的核心内容,而“热者寒之、寒者热之”又是中医治法的的重要原则,《神农本草经》中即指出“药有寒热温凉四气(性)”。“疗寒以热药,疗热以寒药”则指出了以病证寒热作为用药依据的基本治疗原则,据此,建立血瘀证及寒凝、热毒亚型动物模型;以此动物模型为载体进行活血化瘀中药功效的代谢组学研究,并从中挖掘不同药性的特征生物标记物,阐释活血化瘀中药的性效关系。寒热温凉反映在机体的能量代谢上,肝脏Na+,K+-ATP酶和Ca2+-ATP酶的活性与能量代谢有关;解偶联蛋白(uncoupling proteins,UCPs)是线粒体内膜上参与能量代谢的重要转运蛋白,UCPs能够将线粒体内膜外侧的H+运回基质,形成质子漏,使ATP合成所依赖的线粒体内膜上的电化学梯度发生改变,影响膜电位,氧化磷酸化解偶联,合成ATP减少,使产能转化为产热;三羧酸循环(TCA)是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类脂类氨基酸代谢联系的枢纽,它先于呼吸链,在线粒体能量代谢中具有极其重要的作用;琥珀酸脱氢酶(SDH)是线粒体内三羧酸循环中的酶,其活性增高表明三羧酸循环的加快,同时也标志着细胞内ATP生成增强,均可作为寒热药性的表征研究方法。
(2) 功能受体:受体是功能单位,又具有定位的特点,某种受体的分布可以跨器官、跨系统,这些与中医脏腑概念的特征极为相似,中药归经极有可能是与其作用于某种或某几种受体有关。如槟榔味苦、辛,归胃、大肠经,具有降气消积行水的作用,味苦能泄,槟榔中槟榔碱为胆碱能受体激动剂,可增加胃肠平滑肌张力、增加肠蠕动,使消化液分泌旺盛、增加食欲,这与中医药理论中的槟榔归胃、大肠经是一致的。“辛先入肺”,辛味药大多具有宣发、解表作用,而大量的肾上腺素能受体分布于肺泡内,与发汗、平喘功能关系密切,辛味中药麻黄含有麻黄碱,为苯乙胺类生物碱,是肾上腺素受体激动剂,为麻黄辛味归肺经的受体依据。
(3) 系统生物学方法:系统生物学的哲学思维和理论框架与中医药理论体系特点惊人的相似,尤其是代谢组学是诠释中药药性理论的可行手段和方法。中药药性的具体作用必定与其成分密切相关,中药成分虽然复杂,但进入体内的化学成分是有限的。体内来源的药物化学成分更能代表该药的整体药效。代谢组学就是研究机体在外界作用下体内来源的药物化学成分(生物代谢标志物、分子集合),并利用这种集合分析外界作用对机体整体功能的影响,在药性的“经点”位置分析代谢谱的改变,从代谢物组成分和量的经时变化发现中药性味与疗效相关的生物标志物,其所揭示的生物化学变化很容易与传统手段的测定结果联系,更容易评价中药药物作用和发现药物作用的生物化学物质基础和作用机制,确定药性作用过程、机制、靶点以及生物标志物,从而诠释中药性味实质及其与功效的内在联系。因而,代谢组学方法对于研究中药的整体调节机制及其多成分、多靶点作用等方面具有重大意义。
(4) 药动学方法:传统药性理论中“药性走守”“气味薄厚”“升降浮沉”“归经”“引经报使”“相须”等基本概念中均包含药物成分的药动学及体内过程(ADME/T)的科学内涵。因此,药动学研究是揭示不同药性的药物传输特点、作用趋势、组织靶向及其不同药味之间的交互作用及其动力学规律的可行方法。
3 基于Q-Marker的中药药效物质基础和作用机制的“性-效-物”三元研究模式的构建针对当前研究的问题和研究的关键,提出了基于“药物-五味-物质-效应-功用”五位一体、紧密关联并相互佐证的中药五味化学及生物学基础研究思路和技术路线(图 1),以此建立五味的客观表征及其生物效应系统表达的研究模式,同时建立相关的方法,从受体靶点、组织器官、整体动物等多个层次的生物效应表达研究并加以关联,阐释中药药效物质基础及作用机制,并指导临床实践。同时,根据系统的研究结果,发现与中药药效、药性表达以及组方配伍密切相关的化学物质,确定Q-Marker,用于质量控制。

|
图 1 “性-效-物”三元研究模式、思路和路径 Fig.1 Overallideas,model,and approaches of triarchic theory of “property-effect-component” |
4 “性-效-物”三元论中药药效物质基础及作用机制研究实践
基于总体研究思路,以元胡止痛滴丸为研究范例,建立如图 2所示的“性-效-物”三元论中药药效物质基础及作用机制研究方案。元胡止痛滴丸由延胡索和白芷2味药组成,方中延胡索为君药,具活血、理气、止痛之功,辅以白芷为臣,可散风寒,宣湿痹,行气血以除头痛、身痛。二药汇方,具有理气、活血、止痛的作用,用于气滞血瘀的胃痛、胁痛、头痛及月经痛等。其药效物质基础和作用机制研究尚不清楚,本文以该药为范例,建立“性-效-物”三元论中药药效物质基础及作用机制研究模式,并进行示范性研究。

|
图 2 “性-效-物”三元论元胡止痛滴丸药效物质基础及作用机制研究方案 Fig.2 Research approaches of effective components and mechanism research of YZDP based on triarchic theory of “property-effect-component” |
4.1 药效物质基础研究的主要结果 4.1.1 化学物质组的表征和辨识基础研究
采用HPLC-MS/MS方法,对元胡止痛滴丸以及延胡索和白芷药材所含生物碱和香豆素类成分进行表征和辨识,从元胡止痛滴丸中共得到51个化合物,其中28个生物碱类成分和23个香豆素类成分(表 1)。延胡索包括原小檗碱类、原阿片碱类、阿朴啡类等生物碱,其中延胡索乙素、延胡索甲素、去氢延胡索甲素等原小檗碱类生物碱为该药物中主要的生物活性成分。白芷主要的化学成分为香豆素类,主要为线性呋喃香豆素如欧前胡素、异欧前胡素等,此外还含有线性二氢香豆素、角型香豆素、角型二氢香豆素、简单香豆素等。总离子流图见图 3。
|
|
表 1 元胡止痛滴丸中鉴定的51个化合物 Table 1 Identification of 51 compounds in YZDP |

|
图 3 元胡止痛滴丸总离子流图谱 Fig.3 Total ion chromatograms of YZDP in positive and negative ESI modes |
4.1.2 化学成分的分离和结构确证
采用化学分离的方法,以延胡索和白芷药材为原料,对元胡止痛滴丸主要化学成分进行分离制备,分离得到28个化学成分,通过波谱学方法,确定了21个化学成分结构,分别为延胡索乙素(dl-tetrahydropalmatine,1)、黄藤素(palmatine,2)、原阿片碱(protopine,3)、小檗碱(berberine,4)、去氢延胡索甲素(dehydrocorydaline,5)、延胡索甲素(d-corydaline,6)、D-四氢药根碱(D-tetrahydrojatrorrhizine,7)、四氢小檗碱(tetrahydroberberine,8)、α-别隐品碱(α-allocryptopine,9)、欧前胡素(imperatorin,10)、8-甲氧基异欧前胡素(8-methoxy-isoimperatorin,11)、异欧前胡素(isoimperatorin,12)、佛手柑内酯(bergapten,13)、氧化前胡素(oxypeucedanin,14)、花椒毒酚(xanthotoxol,15)、白当归脑(byakangelicol,16)、花椒毒素(xanthotoxin,17)、白当归素(byakangelicin,18)、伞形花内酯(umbelliferone,19)、异补骨脂素(isopsoralen,20)、东莨菪素(scopoletin,21)。
4.1.3 入血成分及其代谢产物的辨识采用血清药物化学的方法,运用UPLC-Q/TOF-MS结合代谢组学的方法,快速地分析和鉴定了口服给予元胡止痛方后大鼠血浆和脑组织中的吸收原型成分及其代谢产物[10],采用偏最小二乘判别分析模型获得得分图、载荷图和离子变量线图(图 4)。
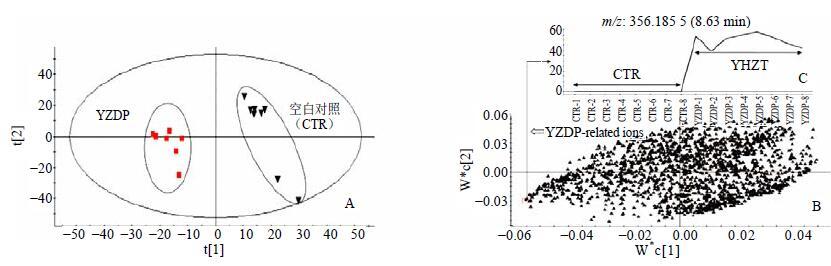
|
图 4 偏最小二乘判别分析得分图 (A)、载荷图 (B) 和离子变量线图 (C) Fig.4 Score plots (A),loading plots (B),and ion variable plots (C) of PLS-DA |
口服给予元胡止痛滴丸后大鼠血浆中鉴定出40个与元胡止痛滴丸相关的外源性化学成分,包括26个原型成分和14个代谢产物。其中15个原型成分同样在给药组大鼠脑组织中被检测到,表明它们能够穿过血脑屏障渗透进入脑组织。在血浆尤其是脑组织中检测到的原型成分和代谢产物,可能是真正的活性成分并与元胡止痛方的药理活性直接相关。这些将为元胡止痛方的药理学和分子水平作用机制的进一步研究提供有用信息。
通过上述研究基本阐明了元胡止痛滴丸的化学物质组、入血成分及其代谢产物。
4.2 “性(味)”物质基础的界定 4.2.1 基于仿生模型“真实性(味)”物质基础的界定中药酸、甘、苦、辛、咸五味具有真实滋味(气味)属性,电子鼻(electronic nose,EN)也称人工嗅觉系统,是能够感知和识别气味的电子系统,包括样品处理器、气体传感器阵列及信号处理系统。它将仿生学、传感技术、信号处理、模式识别和计算机科学等多种学科融于一体,既能检测特定的气体,又能评价混合气体或挥发性化学成分。电子舌(electronic tongue,ET)是模拟人体味觉感受机制来设计的人工味觉系统,广泛应用于食品、药品等领域。它使用类似于生物系统的材料作为传感器的敏感膜,当味觉物质在薄膜上吸收,数据便通过敏感膜上电位的变化而获得,然后由计算机对数据进行模式识别,得到反映样品味觉特征的结果。
延胡索味苦、辛,白芷味辛,通过化学分离技术将药材拆分为不同的物质组群,以药材、物质组群及单体成分作为待测样品,运用电子鼻、电子舌仿生模拟技术对拆分的不同物质组群测定筛选,确定延胡索和白芷的辛、苦物质组群。见图 5。
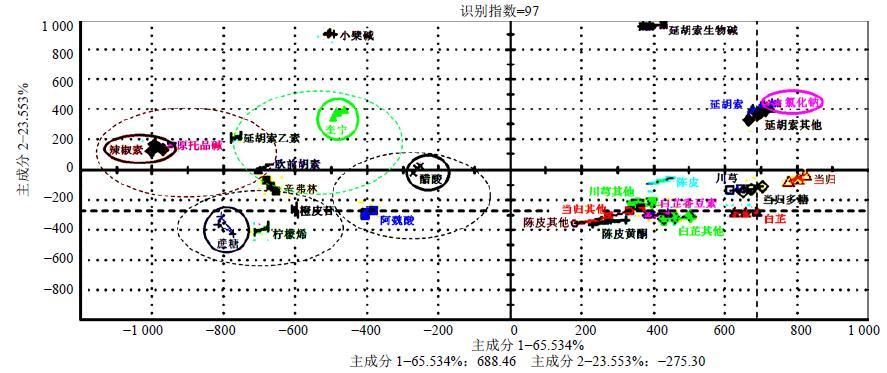
|
图 5 基于电子舌仿生技术元胡止痛滴丸性味辨识研究 Fig.5 Property and flavor identification of YZDP based on ET bionic techniques |
4.2.2 基于味觉、嗅觉受体分子对接的“性(味)”物质基础虚拟筛选和确定
基于药物分子-味(嗅)觉受体结合理论,运用计算机虚拟筛选方法进行“性(味)”物质基础筛选。以延胡索和白芷代表性化合物为小分子配体库,进行hTAS2R10苦味受体对接筛选,其结果与阳性配体奎宁的对接结果比较发现,原小檗碱型的代表性化合物延胡索乙素与构建的苦味受体hTAS2R10的亲和力较强,而原托品碱类成分对接结果较差,故推测原小檗碱型化合物可能为延胡索药材中的苦味成分。对接结果见图 6。
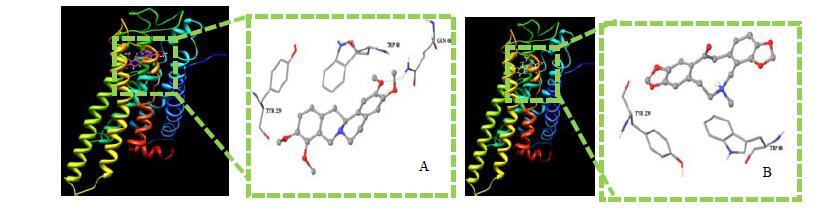
|
图 6 hTAS2R10与延胡索乙素 (A) 和原阿片碱 (B) 结合模式图 Fig.6 Docking results of hTAS2R10 with tetrahydropalmatine(A) and protopine (B) |
以延胡索和白芷代表性化合物为小分子配体库,进行OR7D4辛味受体对接筛选,其结果与阳性配体辣椒素对接打分比较发现,延胡索乙素、原阿片碱、欧前胡素与OR7D4的对接得分均高于辣椒素,初步推测其可能为辛味物质基础。对接结果见图 7。
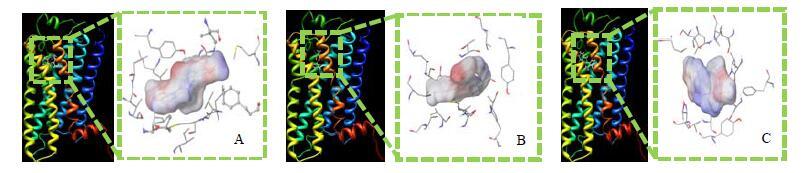
|
图 7 OR7D4与欧前胡素 (A)、延胡索乙素 (B) 和原阿片碱 (C) 结合模式图 Fig.7 Docking results of OR7D4 with imperatorin (A),tetrahydropalmatine(B),and protopine (C) |
4.2.3 基于G蛋白偶联受体“功效五味”的物质基础筛选和确定
中药的五味具有功效的内涵,如辛“能散、能行”,甘“能补、能缓、能和”,酸“能收、能涩”,苦“能泄、能燥、能坚”,咸“能下、能软”。并与四气、升降浮沉、归经等药性理论存在复杂的内在联系。
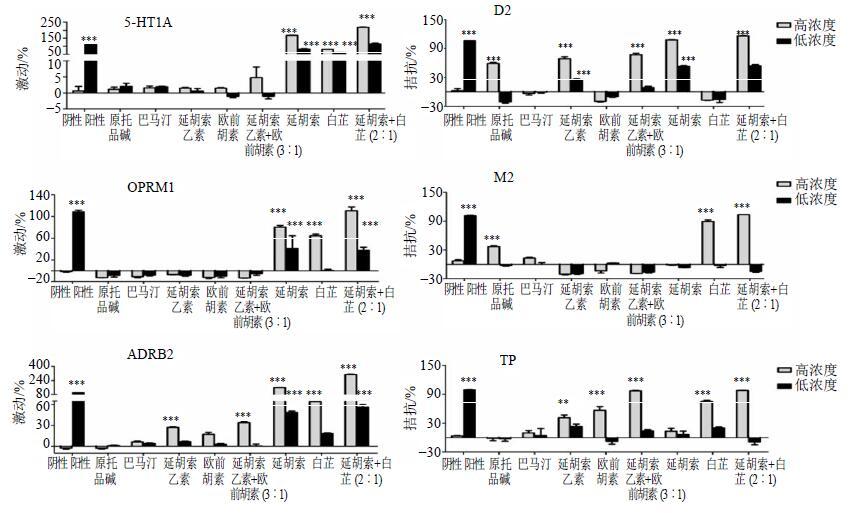
G蛋白偶联受体是一大类膜蛋白受体的统称。这类受体参与了很多细胞信号转导过程。在这些过程中,G蛋白偶联受体能结合细胞周围环境中的化学物质并激活细胞内的一系列信号通路,最终引起细胞状态的改变。与G蛋白偶联受体相关的疾病为数众多,并且约40%的现代药物都以G蛋白偶联受体作为靶点。应用胞内钙离子浓度变化荧光技术,对延胡索、白芷药材及其主要成分进行G蛋白偶联受体结合实验,结果见图 8。
|
图 8 延胡索、白芷药材及其主要成分对6个GPCRs受体的激动和拮抗作用 Fig.8 Activation and antagonism of Corydalis Rhizoma,Angelicae Radix,and representative six compounds on GPCRs |
结果表明,延胡索、白芷药材均可作用于多个相关功能受体,且二者配伍后效果优于单一给药;原小檗碱类延胡索乙素和原阿片碱类原阿片碱可作用于与辛、苦味相关的功能受体,故可能为辛、苦味物质基础;香豆素类欧前胡素可拮抗血栓素受体,体现了辛味活血化瘀的功效,其可能为辛味成分。延胡索和白芷配伍后可以通过激活5-HT1A、OPRM1、ADRB2受体,抑制D2、M2和TP受体来调节一系列的下游生物信号转导效应,从而发挥多种生物活性,产生增效作用。延胡索乙素和欧前胡素配伍后可以通过激活ADRB2受体,抑制D2和TP受体来调节下游生物信号通路,从而发挥多种生物活性,产生增效作用。
4.3 镇痛作用及作用机制研究 4.3.1 缩宫素诱发大鼠痛经模型的镇痛作用采用ip缩宫素诱发大鼠痛经模型,研究元胡止痛滴丸对痛经模型大鼠的镇痛作用及机制。结果显示,与模型组比较,元胡止痛滴丸能够显著减少痛经模型大鼠扭体次数,并呈剂量相关性,扭体次数抑制率最高可达63.8%,元胡止痛滴丸高、中剂量组能够延长扭体反应潜伏期,延长率最高可达39.3%;并可显著升高β-内啡肽(β-EP)、前列腺素E2(PGE2)的量,显著降低去甲肾上腺素(NA)、5-羟色胺(5-HT)、前列腺素F2α(PGF2α)的量以及PGF2α/PGE2值,表明元胡止痛滴丸对痛经模型大鼠具有显著的镇痛作用。
4.3.2 硝酸甘油诱发大鼠偏头痛模型的镇痛作用采用sc硝酸甘油诱发大鼠偏头痛模型,研究元胡止痛滴丸对偏头痛模型大鼠的镇痛作用及机制。结果表明,元胡止痛滴丸在0.8~1.6 g/kg剂量下对实验性偏头痛模型大鼠具有显著的镇痛作用,对外周血中单胺类及β-EP有显著影响,其作用具有多靶点的特点。
4.3.3 对大鼠离体子宫收缩的影响采用大鼠离体子宫收缩模型,通过加入不同的激动剂和拮抗剂来观察元胡止痛滴丸对子宫收缩活动的影响,进一步探寻其作用机制。元胡止痛滴丸可降低正常未孕大鼠子宫收缩频率和活动力,对缩宫素引起的子宫收缩可显著降低收缩频率和活动力,降低平均振幅;对乙酰胆碱(Ach)和PGF2α引起的收缩可降低频率和活动力;可协同苯海拉明、吲哚美辛对子宫活动产生抑制作用,可进一步降低子宫收缩的频率和活动力;对酚妥拉明、维拉帕米的协同作用较弱。表明元胡止痛滴丸治疗痛经可能的作用靶点在缩宫素受体、M受体、H1受体及前列腺素的合成环节。
4.3.4 对大鼠原代子宫平滑肌细胞钙内流的影响与对照组比较元胡止痛滴丸及元胡止痛片含药血清可显著抑制细胞外钙内流,从而抑制子宫平滑肌的收缩活动,但与维拉帕米无协同作用。
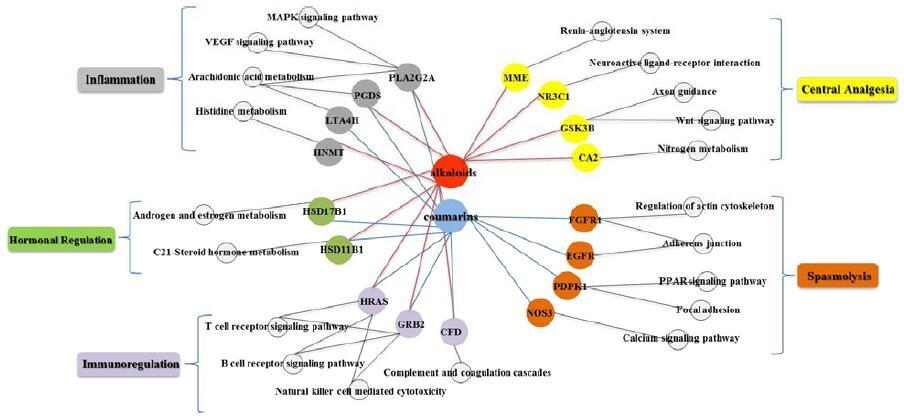
4.4 网络药理学研究基于元胡止痛滴丸血清药物化学研究结果,并结合相关文献报道,选定延胡索中10个生物碱类入血原型成分、白芷中12个香豆素类入血原型成分和6个代谢物。采用PharmMapper数据库、UNIPRO数据库、MAS 3.0数据库、KEGG数据库和Cytoscape 2.6软件[11],利用反向对接技术对元胡止痛滴丸28个入血成分的作用靶点、通路进行虚拟预测。结果表明,此28个化合物都能作用于与痛经相关的52个靶点及31条通路,其主要是通过激素调节、中枢镇痛、平滑肌解痉、抗炎和免疫相关通路起到相应的治疗效果,体现了元胡止痛滴丸治疗痛经的多成分、多靶点作用机制。见图 9。
|
图 9 元胡止痛滴丸治疗痛经的“化合物-靶点-通路-功效”网络图 Fig.9 “Compound-Target-Pathway-Efficacy” network of YZDP in treatment of dysmenorrhea |
4.5 代谢组学研究
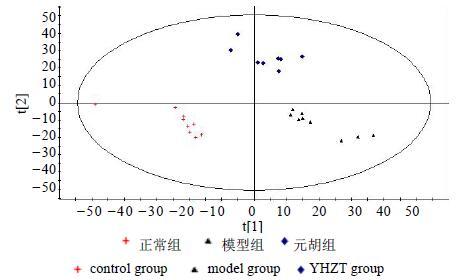
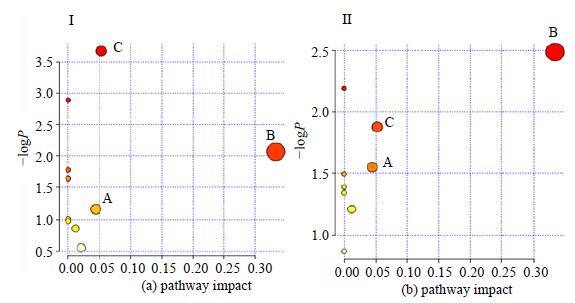
采用UPLC-Q-TOF-MS法建立了大鼠原发性痛经模型的代谢轮廓分析。复制ip缩宫素诱发大鼠痛经模型,分离血清进行PGF2α的生化检测,血浆做UPLC-Q-TOF-MS的无靶向代谢组学分析。通过多元统计分析,从痛经模型大鼠血浆中筛选出苏氨酸、缬氨酸、磷酰胆碱、植物鞘氨醇、LPC18:3、LPC18:0等19个与大鼠痛经模型有关的生物标记物(图 10)。在这些标志物中,13个物质在给予元胡止痛滴丸后向正常组回调,9个生物标记物与模型组比较有显著性差异。代谢通路分析表明,这些标记物主要存在于3条代谢通路中,分别为甘油磷脂代谢、氨基酸类代谢和鞘脂类代谢。结果表明,元胡止痛滴丸可能通过干预甘油磷脂代谢、氨基酸类代谢和鞘脂类代谢信号通路从而有效的缓解痛经(图 11)。
|
图 10 PLS-DA得分图 Fig.10 Score plots of PLS-DA |
|
图 11 大鼠原发性痛经模型标志物相关代谢通路分析 (I) 和元胡止痛滴丸治疗大鼠原发性痛经模型标志物的相关代谢通路分析 (Ⅱ) Fig.11 Pathway analysis with MetPA: metabolic pathway related with biomarkers of primary dysmenorrhea in rats (I) and analysis on metabolic pathway related with biomarkers of primary dysmenorrhea in rats treated with YZDP (Ⅱ) |
4.6 药动学研究 4.6.1 元胡止痛滴丸药动学研究
采用HPLC-MS/ MS法进行健康Beagle犬单剂量、双周期、双交叉口服元胡止痛滴丸与元胡止痛片的临床前体内过程比较研究[10]。首先建立了元胡止痛滴丸中延胡索乙素和欧前胡素同时定量测定的方法,并分别测定2种剂型中延胡索乙素和欧前胡素药动学参数达峰浓度(Cmax)、达峰时间(tmax)、药时曲线下面积(AUC0~t)、AUC0~∞、表观分布容积(Vd)、半衰期(t1/2)、平均滞留时间(MRT0~t)、MRT0~∞和血浆清除率(CL)。实验结果表明:(1) 延胡索乙素定量下限可达0.05 ng/mL,欧前胡素定量下限可达5 pg/mL,所建立的方法可以满足犬血浆动力学研究;(2) 延胡索乙素在元胡止痛滴丸中tmax较元胡止痛片更快,吸收更迅速。但MRT0~12 h较元胡止痛片短。2种制剂中延胡索乙素在体内暴露情况(AUC0~30 h与Cmax)无显著性差别;(3) 欧前胡素在元胡止痛滴丸中tmax较元胡止痛片中更加迅速,Cmax远大于元胡止痛片,体内暴露量AUC0~12 h远大于元胡止痛片。元胡止痛滴丸吸收速度和体内暴露情况均大于元胡止痛片。
4.6.2 延胡索-白芷配伍药动学研究研究表明,与延胡索提取物单独给药相比,组方配伍后生物碱类成分延胡索甲素、延胡索乙素及原阿片碱在大鼠体内的吸收增加,Cmax和AUC0~∞均显著升高;与白芷提取物单独给药相比,组方配伍后香豆素类成分欧前胡素、异欧前胡素的Cmax有所降低,但吸收延缓、滞留时间延长。因此,延胡索与白芷配伍存在明显的体内动力学相互作用,有利于阐释元胡止痛方的组方配伍合理性。见图 12。
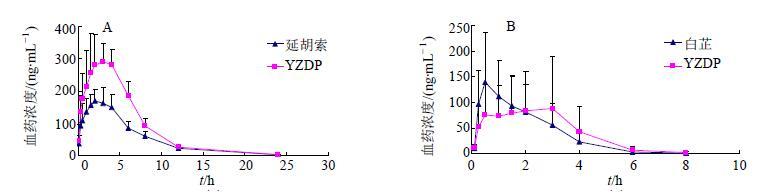
|
图 12 延胡索乙素 (A) 和欧前胡素 (B) 平均血药浓度-时间曲线 Fig.12 Average plasma concentration-time curves of tetrahydropalmatine(A) and imperatorin (B) |
与单独给药相比,元胡止痛方能显著升高生物碱类成分延胡索甲素、延胡索乙素和原阿片碱在脑组织中的Cmax,增加其脑组织分布量,同时延长香豆素类成分欧前胡素和异欧前胡素在脑组织中的MRT0~t。相关文献报道延胡索甲素、延胡索乙素、原阿片碱、欧前胡素及异欧前胡素均不是P-糖蛋白(P-gp)的底物,结合前期血浆药动学研究结果分析,抑制体内代谢酶活性而对药物吸收过程的影响可能是引起延胡索与白芷配伍后各效应成分脑组织分布改变的主要因素。见图 13。
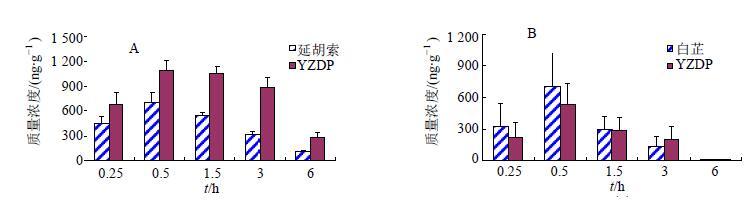
|
图 13 延胡索乙素 (A) 和欧前胡素 (B) 脑组织浓度比较 Fig.13 Brain tissue concentration of tetrahydropalmatine(A) and imperatorin (B) |
5 元胡止痛滴丸的Q-Marker的确定
根据中药Q-Marker的定义,其研究更应关注以下4个重要环节:(1) 药物制备过程中药性与药效物质基础的传递和变化;(2) 反映复方整体功效的效应物质;(3) 入血成分及代谢产物的原型溯源;(4) 配伍中各成分的交互作用。
本文通过系统的研究表明,元胡止痛滴丸中的55个化学成分,口服后26个原型成分和14个代谢产物可在血浆中检测到,其中15个原型成分可通过血脑屏障进入脑组织。通过整体动物、离体器官、细胞及分子水平的药效学研究以及嗅觉、味觉仿生模型和分子对接实验、G蛋白偶联受体的药性研究表明,延胡索甲素、延胡索乙素、原阿片碱、欧前胡素及异欧前胡素可能作为元胡止痛滴丸的主要药效和药性物质基础。进一步通过代谢组学和网络药理学研究,揭示了元胡止痛滴丸的多靶点作用机制。最后,通过多组分药动学研究,延胡索中的延胡索甲素、延胡索乙素及原阿片碱与白芷中的欧前胡素、异欧前胡素配伍存在明显的体内动力学相互作用,为元胡止痛方的组方配伍合理性提供重要依据。综合所有研究,确定元胡止痛滴丸的Q-Marker为延胡索甲素、延胡索乙素、原阿片碱、欧前胡素和异欧前胡素。
6 讨论与结语中医药学是历史悠久、经验丰富、理论体系最为完整的传统医药学,中药的作用方式具有明显的特点和优势。对于中药药效物质基础及作用机制的阐释应基于中医对生命运动规律的认识观,从基本概念、理论内涵和科学体系的不同层面抽丝剥茧、循序渐进,厘清和辨识中医药理论的核心内涵和本质规律,并应用现代科学的手段和实验方法,阐释中药理论的客观规律,真正实现“继承不泥古,传承不离宗”的目的。在此讨论中特别指出该研究的4个问题的重要性。
6.1 “药性”与“药效”均是中药的基本属性“药性”与“药效”均是中药的基本属性,是中药配伍及临床用药重要依据,二者呈现复杂的离合关系,存在“性效等同”“性效有别”和“性效互参”等联系和规律。并且二者与药物作用的趋势(升降沉浮)、药物作用的靶点(归经)以及疾病主体的“证”“病”等具有不同内涵、外延和关联规律,中药药效物质基础及作用机制研究的目的是阐释中药的作用原理,“性-效-物”三元论中药药效物质基础与作用机制研究模式的提出更有利于揭示中医药治病的本质规律。
6.2 “性-效-物”三元论中药药效物质基础与作用机制研究的模式和路径本文基于对中药作用原理和表达方式的认识,建立“性-效-物”三元论中药药效物质基础与作用机制研究模式,并应用该模式方法对元胡止痛滴丸进行系统的药效物质基础和作用机制研究,通过原型化学物质组的辨识、化学成分的获取及结构确证、血中移行成分研究,系统地阐明了元胡止痛滴丸的药效物质基础;通过味觉仿生模型并结合味觉、嗅觉受体分子对接筛选以及G-蛋白偶联受体结合试验,从味(嗅)觉和功能两方面属性表达的角度对元胡止痛滴丸的药味(性)物质基础进行筛选和确定;最后,从整体动物模型、离体器官、细胞等不同层次以及网络药理学、代谢组学及药动学等多个维度和方法系统阐释元胡止痛滴丸的药效作用及作用机制。该研究为“性-效-物”三元论中药药效物质基础与作用机制研究提供了示范。
6.3 “性-效-物”三元论研究思路和方法是确定中药Q-Marker重要手段和研究方式中药Q-Marker是存在于中药材和中药产品(饮片、中药煎剂、中药提取物、中成药制剂等)中固有的或加工制备过程中形成的、与中药的功能属性密切相关的化学物质,作为反映中药安全性和有效性的标示性物质进行质量控制[12]。长期以来,中药质量控制手段、质量评价指标及质量标准与中药的有效性关联性不强,缺少能反映中药有效性的核心质量概念的统领,在药材、饮片、中成药质量研究中存在碎片化的倾向。中药Q-Marker的提出,提出核心质量概念,以此统领中药质量研究,进一步密切中药有效性-物质基础-质量控制标志性成分的关联度。本文提出的“性-效-物”三元论研究思路和方法着眼于中药物质基础的体外-体内的传递及变化规律,并从“药性”和“药效”2个方面,通过整体动物模型、离体器官、细胞等不同层次以及网络药理学、代谢组学及药代动力学等不同层次和角度研究和阐明中药的物质-效应关联规律以及配伍原理,从中得出中药作用的效应物质,并确定Q-Marker。因此,基于本研究思路和方法得出的结论,依据更加充分。
6.4 确定Q-Marker的证据中药Q-Marker研究涉及对中药中次生代谢产物生源途径及成分特异性的分析,有助于发现该中药中特异性化学成分而作为Q-Marker[13]。本文通过系统的研究表明,元胡止痛滴丸中的51个化学成分,口服后26个原型成分和14个代谢产物可在血浆中检测到,其中15个原型成分可通过血脑屏障进入脑组织;通过整体动物、离体器官、细胞及分子水平的药效学研究以及嗅觉、味觉仿生模型和分子对接实验、G蛋白偶联受体的药性研究,证明(1)延胡索甲素、延胡索乙素、原阿片碱、欧前胡素及异欧前胡素可能作为元胡止痛滴丸的主要药效和药性物质基础;(2)通过多组分药动学研究,延胡索中的延胡索甲素、延胡索乙素及原阿片碱与白芷中的欧前胡素、异欧前胡素配伍存在明显的体内动力学相互作用,为元胡止痛方的组方配伍合理性,提供该制剂的Q-Marker的重要依据。进一步通过代谢组学和网络药理学研究,揭示了元胡止痛滴丸的多靶点作用机制;最后,综合所有研究,确定元胡止痛滴丸的Q-Marker为胡索甲素、延胡索乙素、原阿片碱、欧前胡素和异欧前胡素。
| [1] | 郭倩, 田成旺, 任涛, 等. 中药药效物质基础研究进展[J]. 世界科学技术-中医药现代化 , 2015, 17 (3) :648–654. |
| [2] | 刘昌孝, 张铁军, 何新, 等. 活血化瘀中药五味药性功效的化学及生物学基础研究的思考[J]. 中草药 , 2015, 46 (5) :615–624. |
| [3] | 张铁军, 刘昌孝. 中药五味药性理论辨识及其化学生物学实质表征路径[J]. 中草药 , 2015, 46 (1) :1–6. |
| [4] | 曹煌, 张静雅, 龚苏晓, 等. 中药酸味的药性表达及在临证配伍中的应用[J]. 中草药 , 2015, 46 (24) :3617–3622. |
| [5] | 张静雅, 曹煌, 龚苏晓, 等. 中药甘味的药性表达及在临证配伍中的应用[J]. 中草药 , 2016, 47 (4) :533–539. |
| [6] | 张静雅, 曹煌, 许浚, 等. 中药苦味药性表达及在临证配伍中的应用[J]. 中草药 , 2016, 47 (2) :187–193. |
| [7] | 孙玉平, 张铁军, 曹煌, 等. 中药辛味药性表达及在临证配伍中的应用[J]. 中草药 , 2015, 46 (6) :785–790. |
| [8] | Pronin A N, Xu H, Tang H, et al. Specific alleles of bitter receptor genes influence human sensitivity to the bitterness of aloin and saccharin[J]. Curr Biol , 2007, 17 (16) :1403–1408. |
| [9] | 杜瑞超, 王优杰, 吴飞, 等. 电子舌对中药滋味的区分辨识[J]. 中国中药杂志 , 2013, 38 (2) :154–159. |
| [10] | Zhang H B, Zhang T J, Xu J, et al. Rapid analysis and identification of absorbed components and their metabolites in rat plasma and brain tissue after oral administration of Yuan-Hu-Zhi-Tong Dropping Pill using UPLC-Q-TOF/MS based multivariate statistical analysis[J]. Chin Herb Med , 2016, 8 (2) :154–163. |
| [11] | 韩彦琪, 许浚, 张喜民, 等. 基于网络药理学的元胡止痛滴丸治疗原发性痛经的作用机制研究[J]. 药学学报 , 2016, 51 (3) :380–387. |
| [12] | 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物 (Q-Marker): 中药产品质量研究的新慨念[J]. 中草药 , 2016, 47 (9) :1443–1457. |
| [13] | 张铁军, 许浚, 韩彦琪, 等. 中药质量标志物 (Q-marker) 研究: 延胡索质量评价及质量标准研究[J]. 中草药 , 2016, 47 (9) :1458–1467. |
 2016, Vol. 47
2016, Vol. 47


