2.吉林农业大学 生物反应器与药物开发教育部工程研究中心, 吉林 长春 130118 ;
3.通化市第一中学, 吉林 通化 134001
Bioreactor and Drug Development Reseach Center, Ministry of Education, Jilin Agricultural University, Changchun 130118, China ;
3.Tonghua No.1 Senior High School, Tonghua 134001, China
金属硫蛋白(metallothionein,MT)是一类低相对分子质量(6~7 ku)、富含半胱氨酸,可与大量金属离子(如Zn2+,Cd2+和Cu2+)相结合的独特蛋白质或者活性肽,是机体内唯一一种在金属代谢中起重要调节作用的小分子蛋白[1]。1957年,富含Cd的金属蛋白首次在马肾脏细胞中被发现[2]。通过对金属硫蛋白进行提纯发现,其含有大量的半胱氨酸残基和金属,并因此将其命名为“metallothionein”[3]。研究证实,植物MT的高巯基含量使其在空气中极不稳定、分离困难,目前仅在小麦Ec蛋白[4]和拟南芥MT1、MT2和MT3[5]中分离纯化获得,MT基因的表达可增强植物在重金属胁迫过程中的抗逆作用,对组织细胞损伤修复具有显著功效[6-10]。同时研究发现,MT2可与金属结合,具有清除自由基、防辐射、加速皮肤炎症修复和延缓衰老等功效[11-12]。
近些年来,随着基因工程等生物技术的不断发展,以转基因技术为代表的植物基因工程技术,为农业的可持续发展提供了强有力的支持,已有几十种药用蛋白或多肽在植物中成功表达[13-14]。利用植物表达系统生产药用蛋白具有广泛的应用前景[15],加拿大Sembiosys公司利用红花油体系统表达人胰岛素,已达到商业化生产水平,国内也有利用植物表达系统生产水蛭素、降钙素等相关报道[16]。本研究以药用植物红花作为植物反应器生产MT,构建红花植物表达载体,获得了转基因红花植株,MT与拟南芥油体融合后定位于红花油体中。利用金属硫蛋白特殊功效与油体易于纯化的特性,提取的油体可直接用于化妆品原料的制备,既节省了药物分离纯化的成本,同时又增加了药物的治疗效果。以红花作为植物反应器生产MT蛋白,旨在进一步提高红花的利用价值及为利用其他植物生物反应器表达重组蛋白提供理论依据。
1 材料与方法 1.1 材料 1.1.1 质粒与菌株根瘤农杆菌菌株EHA105、表达载体pOP、pEASY-oleosin-MT、大肠杆菌菌株DH5α均由吉林农业大学生物反应器与药物开发教育部工程研究中心构建及保存。红花种子由吉林农业大学生物反应器与药物开发教育部工程研究中心提供,经吉林农业大学胡全德教授鉴定为红花Carthamus tinctorius L.选取个头饱满的种子。将种子用70%乙醇浸泡0.5~1.0 min,然后用0.1% HgCl2进行表面消毒约10 min,再用无菌水冲洗3~4次,将其播种在种子萌发培养基上(MS粉+30 g/L蔗糖+100 mg/L有机溶液+100 mg/L肌醇+8 g/L琼脂),25~28 ℃、黑暗条件下培养3~4 d。
1.1.2 试剂限制性内切酶、TaqDNA聚合酶、Pfu DNA聚合酶、DNA分子量标准Marker(DL-2000)、DNA小量提取试剂盒、Agarose Gel DNA Purification Kit试剂盒、Mini BEST Plasmid Purification Kit Ver.2.0试剂盒及DNA Ligation Kit Ver.2等均购自大连宝生物工程有限公司。细胞分裂素(6-BA)、生长素(NAA)、卡那霉素(Kan)、链霉素(Str)和利福平(Rif)等购自美国Sigma公司。乙酰丁香酮(AS)购自日本Wako公司。头孢曲松钠(Cef)和羧苄西林钠(Carb)购自哈尔滨制药股份有限公司。草铵膦购自Boehringer Mannheim公司。其他常规试剂均为国产或进口分析纯试剂。
1.2 方法 1.2.1 引物设计根据GenBank上的拟南芥MT2和拟南芥油体(oleosin)碱基序列,利用Primer Premier 5.0引物设计软件,分别设计oleosin-MT融合基因特异性检测引物,本实验所用的引物以及测序都是由金唯智生物科技(北京)有限公司完成。引物序列如下:M1:5’-ATGCCATGGCGGATACA-GCTAGAGGAACCCATA-3’;M2:5’-CCCAAGCT-TATTTGCAGGTGCAGGTGCAAGGGTT-3’。
1.2.2 植物表达载体pOP-oleosin-MT构建实验室保存的pEASY-oleosin-MT质粒经Nco Ⅰ和Hind Ⅲ双酶切,1.0%琼脂糖凝胶电泳后,割胶回收目的片段。利用连接酶将目的基因与酶切回收后的实验室改造后的pOP植物表达载体连接,转化大肠杆菌DH5α,利用蓝白斑筛选获得阳性菌落,阳性克隆PCR鉴定和Nco I和Hind III双酶切鉴定后获得重组pOP-oleosin-MT质粒载体(图 1)。利用冻融法将测序正确的pOP-oleosin-MT载体转化根瘤农杆菌EHA105,获得用于侵染用的工程菌种。
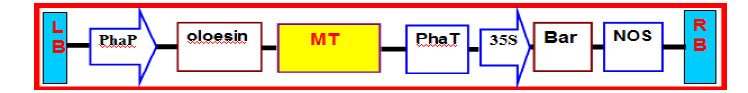
|
图 1 表达载体pOP-oleosin-MT结构示意图 Fig.1 Schematic of pOP-oleosin-MT expression vector |
1.2.3 含oleosin-MT基因的农杆菌转化红花
红花种子经过表面灭菌处理后,在种子萌发培养基中,25 ℃暗培养3 d,选用含有pOP-hEGF-hEGF的农杆菌工程菌侵染红花子叶,在芽诱导培养基上培养2周,转移到芽分化培养基上继续培养4周。长出阳性苗后将其转移到伸长生根培养基内培养。实验所用培养基如下:
(1)芽诱导培养基:MS粉+30 g/L蔗糖+1.5mg/L 6-BA+0.5 mg/L NAA+100 mg/L有机溶液+100 mg/L肌醇+8 g/L琼脂。
(2)芽分化培养基:MS粉+30 g/L蔗糖+1.5 mg/L 6-BA+0.5 mg/L NAA+100 mg/LCef+200 mg/L Carb+100 mg/L有机溶液+100 mg/L肌醇+8 g/L琼脂。
(3)伸长生根培养基:MS粉+30 g/L蔗糖+1.5 mg/L 6-BA+0.5 mg/L NAA+3.8 mg/L KNO3+100 mg/L Cef+200 mg/L Carb+100 mg/L有机溶液+100 mg/L肌醇+8 g/L琼脂。
1.2.4 PCR再生植株检测取转化苗的新鲜叶片100 mg,用新型快速植物基因组DNA提取试剂盒提取总DNA,以未转基因的新鲜叶片作为阴性对照,pOP-oleosin-MT载体质粒作为阳性对照。Y1和M2分别为上下游引物扩增得到oleosin-MT融合基因片段。20 μL PCR反应体系如下:2×Power Taq PCR Master Mix 10 μL,M1和M2各1 μL,红花基因组1 mL,ddH2O 7 μL。PCR反应的程序同前。PCR扩增产物经10 g/L核酸琼脂糖凝胶电泳后,在DNRBio Imaging Systems(购自以色列DNR成像系统有限公司)紫外灯下进行分析。
1.2.5 RT-PCR再生植株检测称取50~100 mg T1代红花种子,用钳子去除种皮,采用Trizol试剂盒提取RNA后反转录成cDNA,以未转基因的新鲜叶片作为阴性对照,pOP-oleosin-MT载体质粒作为阳性对照。M1和M2分别为上下游引物扩增得到oleosin-MT融合基因片段。20 μL PCR反应体系如下:2×Power Taq PCR Master Mix 10 μL,M1和M2各1 μL,红花cDNA 1 μL,ddH2O 7 μL。PCR反应的程序同前。PCR扩增产物经10 g/L核酸琼脂糖凝胶电泳后,在DNRBio Imaging Systems紫外灯下进行分析。
1.2.6 转基因红花的Southern blotting分析取PCR检测呈阳性的转基因红花叶片,用CTAB法取其总DNA,用限制性内切酶Nco I和Hind III双酶切总DNA,经8 g/L琼脂糖凝胶电泳分离后,用碱变性方法处理凝胶[17],利用毛细管法将酶切片段由凝胶转移到固相硝酸纤维素膜上,用地高辛标记的MT基因片段作为探针,按照地高辛检测试剂盒说明书进行Southern blotting分析。
2 结果与分析 2.1 植物表达载体pOP-oleosin-MT构建将oleosin-MT和pOP质粒分别用Nco Ⅰ及Hind Ⅲ进行双酶切,然后用PCR纯化回收试剂盒分别回收目的片段和大载体,进行连接,转化大肠杆菌感受态细胞DH5α,37 ℃过夜培养。采用菌液体PCR筛选阳性质粒,命名为pOP-oleosin-MT。然后对pOP-oleosin-MT进行菌落PCR鉴定(图 2)和酶切鉴定(图 3),验证正确后送上海生物工程有限公司测序。采用冻融法将测序正确的植物双元表达载体pOP-oleosin-MT转化到农杆菌EHA105感受态中,农杆菌菌液进行PCR鉴定,图 4表明融合基因已成功插入到pOP载体中,成功构建了植物表达载体。

|
图 2 重组质粒pOP-oleosin-MT PCR鉴定 Fig.2 PCR identification of recombinated plasmid pOPoleosin-MT |
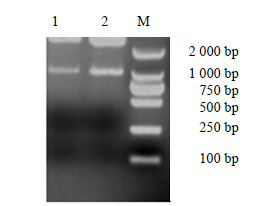
|
图 3 重组质粒pOP-oleosin-MT的酶切鉴定 Fig.3 Restrigation analysis on pOP-oleosin-MT |
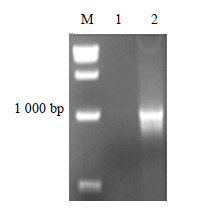
|
图 4 pOP-oleosin-MT菌液的PCR鉴定 Fig.4 PCR amplification of plasmids pOP-oleosin-MT |
2.2 转基因红花的PCR鉴定
选取筛选后得到的27株红花阳性组培苗叶片,提取基因组,进行PCR检测,部分PCR检测结果如图 5所示,植株3~8均扩增获得了大小约为1 000 bp的oleosin-MT片段,仅初步说明目的基因已经整合到红花基因组中,但还需要进一步验证。但由于红花苗生根困难,将获得的红花组培苗嫁接,仅有一株红花阳性苗嫁接成活,收到16粒红花T0代种子。由于收到的种子有限,仅播种了6粒种子,但是由于种子的成熟饱满程度不同,仅有3株T1代阳性植株成活,如图 6所示。对T1代3株红花阳性植株(分别标记为A、B、C)又进行了检测,为了确保RCR检测的准确性,设计了不同的引物进行检测,结果如图 7所示。由图 7可知,A、B、C 3株植株都有可能为阳性苗。在表观上鉴定转基因红花与野生型红花的区别,转基因红花叶片的大小明显大于野生型叶片,说明oleosin-MT对红花表型可能有影响,见图 8。
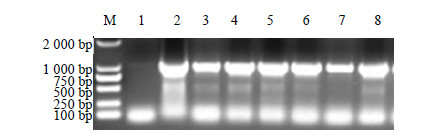
|
图 5 抗性植株的PCR检测 Fig.5 PCR analysis on kan-resistant plants |

|
图 6 转基因红花T1代植株 Fig.6 Transgenic safflower T1 |
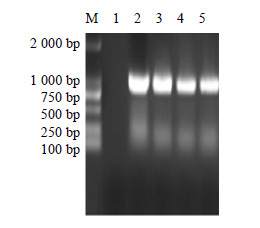
|
图 7 转基因红花T1代的PCR检测 Fig.7 PCR amplification of transgenic safflower T1 |

|
图 8 野生型 (A) 与转基因 (B) 红花表观对比 Fig.8 Apparent contrast of wild type (A) and MT transgenic (B) of safflower |
2.3 Southern blotting检测
取3株PCR检测为阳性的红花植株总DNA,用限制内切酶酶切,以地高辛标记的hEGF基因片段为探针进行Southern blotting,结果在受检的3株转基因植株中,3株均有杂交信号,其中2株为双拷贝,另一株为单拷贝,而非转基因植株没有杂交信号(图 9)。表明外源MT基因已稳定整合到红花基因组中。

|
图 9 转pOP-oleosin-MT基因红花植株的Southern blotting分析 Fig.9 Southern blotting analysis on transgenic pOP- oleosin-MT safflower |
2.4 RT-PCR检测
选取转基因红花T1代种子用Trizol试剂盒提取RNA后反转录成cDNA,以特异性引物进行PCR检测,扩增结果如图 10所示。经RT-PCR鉴定,均扩增出目的基因的特异性条带,且oleosin-MT株系的表达量较高。表明oleosin-MT基因已整合到红花基因组中并在转录水平上表达。
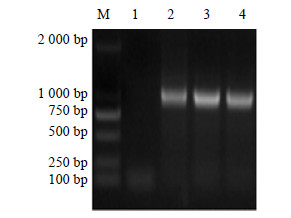
|
图 10 转基因红花T1 RT-PCR检测 Fig.10 RT-PCR amplification of transgenic safflower T1 |
3 讨论
植物MTs的研究已取得很大的发展,但是关于植物MTs分离提取的的报道相对较少[18]。从拟南芥中提取MT,并将MT基因转入到红花中的研究更是尚未见报道。本研究通过构建oleosin-MT融合基因植物表达载体,可以提高目的基因的表达水平;选用红花作为转基因材料,主要基于红花自身的诸多药效作用,同时也不会对环境产生污染。本研究构建红花植物表达载体并转化红花,在基因水平及转录水平上验证了MT基因的表达,获得了3株转oleosin-MT基因的红花植株,并对oleosin-MT目的基因在红花基因组中的整合情况进行了研究,为利用红花作为植物生物反应器生产药用重组蛋白奠定了一定的基础。
与微生物反应器相比,利用红花植物反应器生产oleosin-MT具有安全高效、成本低的特点,而且有助于大规模生产,降低MT市场价格[19]。然而,利用转基因红花大规模生产MT将是一个很漫长的过程,有许多问题有待解决,如本研究获得的转MT基因红花中外源基因整合位置情况、基因的表达水平、转基因红花后代中外源基因的表达稳定性以及表达的MT蛋白的生物学活性等。本研究通过在药用植物红花中表达MT为进一步研究MT蛋白的结构和功能提供了实验基础,下一步实验将会用抗氧化活性试实方法继续研究该蛋白的具体功能。
本研究通过构建红花植物表达载体并转化红花,在基因水平及转录水平上验证了MT基因的表达,同时比较了野生型红花与转MT基因红花外观的差异,为进一步研究MT蛋白生物学功能奠定基础,进一步提高红花的利用价值及为利用其他植物生物反应器表达重组蛋白提供理论依据。
| [1] | 李晓伟, 鲁曼. 金属硫蛋白对铅中毒儿童临床干预观察研究[J]. 中国儿童保健杂志, 2008,16 (4) :391–393. |
| [2] | Margoshes M, Vallee B. A cadmium protein of from kidney cortex[J]. J Am Chem Soc, 1957, 79 :4813–4814 . |
| [3] | Dziegiel P, Jelen M, Muszcynska B, et al. Role of metallothionein espression in non small cell lung carcinomas[J]. Rocz Akad Med Bialymst, 2004, 49 (Suppl 1) :43–45 . |
| [4] | Kameo S, Nakai K, Kurokawa N, et al. Metal comonents analysis of metallothionein 2 III in the brain sections of metallothionein-I and metallothionein-II null mice exposed to ercury vapor with HLPC/ICP/MS[J]. Anal Bioanal Chem, 2005, 381 (8) :1514–1519 . |
| [5] | Binz P A, Kagi J H R. Metallothionein: Molecular Evolution and Clsaaification, in Metallothionein-Ⅳ [M]. Klaassen CD: Basel Birkhäuser, 1999 . |
| [6] | Lane B G, Kajioka R, Kennedy T D, et al. The wheat Ec protein is a zinc-containing metallothionein[J]. Biochem Cell Biol, 1987, 65 :1001–1005 . |
| [7] | Margoshes M, Vallee B L. A cadmium protein from equine kidney cortex[J]. J Am Chem Soc, 1957, 79 :4813–4818 . |
| [8] | An Z G, Li C J, Thoma R, et al. Expression of BjMT2, a metallothionein 2 from Brassica juncea, increases copper and cadmium tolerance in Escherichia coli and Arabidopsis thaliana, but inhibits root elongation in Arabidopsis thaliana seedlings[J]. Exp Bot, 2006, 57 (14) :3575–3582 . |
| [9] | Liu J M, Gang Y, An Z G, et al. BjMT2, a metallothionein type-2 from Brassica juncea, may effectively remove excess lend from erthrocytes and kidneys of rats[J]. Environ Toxicol Pharmacol, 2007, 23 :168–173 . |
| [10] | 唐中华, 郭晓瑞, 张洋洋, 等. 拟南芥MT2过量表达提高抗旱性[J]. 植物研究, 2005 (25) :415–418. |
| [11] | 郑军恒, 李海洋, 茹刚, 等. 金属硫蛋白清除自由基功能的研究[J]. 北京大学学报: 自然科学版, 1999,35 (4) :573–576. |
| [12] | 张保林, 卢景芬, 王文清, 等. 金属硫蛋白抗自由基损伤研究[J]. 生物物理学报, 1992,8 (3) :539–544. |
| [13] | 官丽莉, 崔琪, 韩怡来, 等. 红花bZIP20转录因子基因的克隆、表达分析及植物表达载体构建[J]. 中草药, 2016,47 (8) :1369–1374. |
| [14] | 王艳芳, 张玲, 张娜, 等. 红花单功能反馈抑制敏感型CtAK1基因克隆、序列分析及表达载体构建[J]. 中草药, 2015,46 (24) :3740–3745. |
| [15] | 杨晶, 李天航, 李校堃, 等. 植物生物反应器的研究进展[J]. 生物工程学报, 2009,25 (5) :650–654. |
| [16] | 付宏岐. 利用转基因烟草和红花表达成纤维细胞生长因子21 (FGF21) 的研究 [D]. 长春: 吉林农业大学, 2010. |
| [17] | Rogers S O, Bendich A J. Extraction of DNA from milligram amounts of fresh, herbarium and mummified plant tissues[J]. Plant Mol Biol, 1985, 5 :69–76 . |
| [18] | 张博润, 蔡向荣, 怀文辉, 等. 金属硫蛋白的研究进展及应用前景[J]. 微生物学通报, 1999,26 (5) :355–357. |
 2016, Vol. 47
2016, Vol. 47


