川明参俗称明参或明沙参,为伞形科川明参属植物川明参Chuanmingshen violaceum Sheh et Shan 的干燥根,是中国特有的单种属植物,亦是四川道地药材,具有润肺化痰、和胃、生津、解毒等功效,为滋阴要药[1],主产于四川阆中、巴中、苍溪、金堂等地,近年来种植面积呈逐年增加趋势,经济效益十分显著。但由于长期以来农户自选、自繁而不加选择,导致各地川明参种源十分混杂、种性退化严重。目前对川明参的研究多侧重于有效成分[2-9]、药理作用[10-11]及其与明党参的系统演化关系[12-14]等方面,对其遗传多样性研究至今未见报道。因此,对川明参资源进行广泛调查和收集,研究其生物学特性、亲缘关系和遗传多样性已成为其资源保护与利用的首要任务,而遗传多样性研究是资源保护和有效利用的关键环节。
相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)分子标记针对基因组中的特殊序列设计引物,同时使用较高退火温度和较长的引物,不仅重复性高、稳定性好,且具有无需预知受试基因组 DNA序列、多态性和信息量丰富等特点[15],已广泛应用于多种药用植物种质资源遗传多样性的研究[16-20]。本实验以具代表性的63份川明参种质资源为材料,利用SRAP分子标记技术研究其遗传多样性,可为川明参种质资源的合理利用及新品种选育提供一定参考。
1 材料与方法 1.1 材料样品主要采自川明参主产区四川阆中、广元、巴中、金堂和青白江各乡镇(表 1)。经四川省中医药科学院舒光明研究员鉴定为川明参Chuanmingshen violaceum Sheh et Shan。
|
|
表 1 供试材料及来源 Table 1 Name and source of materials in this study |
1.2 DNA提取
DNA提取采用CTAB法[21]略加改动。同一居群取多株鲜叶混合提取DNA。
1.3 引物设计和筛选参考Li等[15]已发表的引物并由上海生工生物工程有限公司合成,所用引物序列见表 2。选取3份具有代表性的材料(3、26和59号)对156对引物组合进行筛选,从中选出37对多态性高、条带清晰、扩增稳定的引物组合对全部材料进行PCR扩增。
|
|
表 2 所用SRAP 引物名称与序列 Table 2 Names and sequences of SRAP primers used in this study |
1.4 反应体系和扩增程序
SRAP反应体系:总体积25 μL,内含10×PCR buffer 2.5 μL,MgCl2 2.0 mmol/L,dNTPs 200 μmol/L,上、下游引物各0.2 μmol/L,Taq DNA聚合酶1 U,模板DNA 40 ng,其余用ddH2O补足,1滴矿物油覆盖。SRAP扩增程序:采用复性变温法,共40个循环,即 94 ℃预变性5 min;前5个循环:94 ℃变性1 min,35 ℃退火1 min,72 ℃延伸1.5 min;后35个循环:94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min;循环结束后72 ℃延伸10 min,4 ℃保存。
1.5 扩增产物的检测PCR反应结束后向扩增产物中加入6×loading buffer,在含有0.01%溴化乙锭(EB)的2.5%琼脂糖凝胶,1×TAE的缓冲液中电泳(电压5 V/cm)。用BIO-RAD公司的凝胶成像系统对凝胶板检测并照相、分析。
1.6 数据处理每份材料电泳条带按有或无记录,采取0/1赋值,电泳条带清晰存在时赋值为“1”,否则赋值为“0”,泳道缺失记为9。用NTSYS-PC(version 2.10)软件系统计算材料间遗传相似系数(GS)。根据GS值按不加权成对群算术平均法(UPGMA,unweighted pair group method with arithmetic means cluster analysis)进行遗传相似性聚类,绘制树状聚类图。
2 结果与分析 2.1 川明参SRAP扩增结果从156对引物组合中筛选出多态性好且条带丰富的37对引物组合,对63份川明参种质进行PCR扩增,共产生374条清晰条带,其中多态性条带283条,多态性比率达到75.67%(表 3),平均每对引物组合产生7.65条多态性带。引物组合Me5+Em1、Me2+Em3扩增带最多,均为16条,Me34+Em2扩增带最少,仅为6条。扩增片段大小在 200~1 500 bp,图 1为引物组合Me38+Em2对63份供试材料的扩增结果。
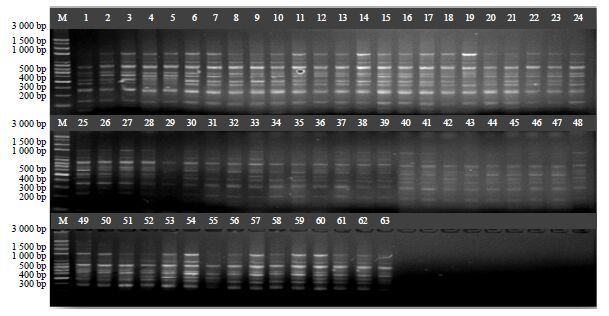
|
图 1 引物组合Me38+Em2 对63 份川明参的扩增结果 Fig.1 SRAP amplification profiles of 63 C. violaceum with primer combinations of Me38 + Em2 |
|
|
表 3 37 对引物组合的SRAP 扩增结果 Table 3 Amplified results of SRAP with 37 pairs of primers |
2.2 供试材料的遗传多样性与遗传差异
利用37对引物组合所得的374条扩增条带,计算供试材料间的GS。结果表明,来自阆中五马川明参良种繁育基地的13、14材料间GS值最大,为0.923 9,遗传差异最小;来自阆中五马川明参选种地的材料3与来自成都金堂淮口镇团结村12组的材料45间GS值最小,为0.726 7,遗传差异最大,63份材料的平均GS值为0.815 0。
2.2.1 不同产地材料的遗传差异5个产地内和产地间GS的平均值见表 4。从表 4可看出,5个产地内GS平均值的变化范围为0.807 7~0.857 4,平均值为0.830 2。巴中材料平均GS值最大,阆中材料G S平均值最小,表明阆中材料的遗传分化程度较大,遗传多样性较丰富,巴中材料亲缘关系较近,遗传变异程度较小。5个产地间GS平均值的变化范围为0.802 2~0.832 0,平均值为0.817 8。除巴中-苍溪、巴中-金堂材料间GS平均值较大外,其余各产地间GS平均值比较接近。其中,巴中-金堂材料间平均GS值最大,阆中-青白江的最小,表明阆中-青白江材料间遗传差异最大,巴中-金堂材料间遗传差异最小。综合产地内和产地间GS分析发现,各产地间GS的平均值均小于各产地内的GS平均值,说明各产地川明参产地间的遗传分化程度大于产地内的。
|
|
表 4 基于SRAP标记的川明参产地内和产地间GS的平均值 Table 4 Means of inter-different areas and intra-different areas GS of C. violaceum accessions based on SRAP marker |
2.2.2 不同资源类型和叶型材料的遗传差异
本实验共收集到63份川明参种质资源,包括54份栽培材料和9份野生或半野生材料;按照叶型又可分为41份宽叶型材料和22份细叶型材料。不同资源类型和叶型材料的遗传差异。
分析结果表明,栽培川明参材料的GS平均值为0.812 6,低于野生或半野生材料的0.834 8,而栽培和野生或半野生材料间的GS平均值介于两者之间,为0.820 8。这一结果表明,栽培材料的遗传差异较野生或半野生材料的大。宽叶和细叶材料间及其材料内GS平均值接近,表明不同叶型材料的遗传差异较小。
2.3 川明参居群的UPGMA聚类分析基于GS矩阵,利用UPGMA法进行聚类分析(图 2)。结果表明,利用SRAP标记能将63份材料完全分开。以GS值0.808 0为阈值可将所有材料分为7大类,第1类包括阆中的材料1、金堂的材料48共2份材料。第2类全部来自青白江清泉镇桔丰村6组,包括55、56及59等5份材料。第3类包括材料2、5及63等49份,其中,阆中19份、苍溪7份、巴中7份、金堂10份、青白江6份。其中来自阆中五马川明参良种繁育基地的13、14遗传分化最小,紧密地聚为一类。第4类包括苍溪九镇的26、阆中五马川明参选种地的11共2份材料。第5类由青白江的52、54及金堂的45共3份材料组成。来自阆中五马川明参选种地的4、3各成一类。
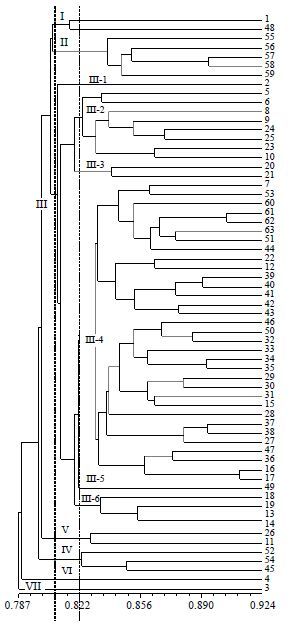
|
图 2 基于SRAP 遗传相似系数的聚类图 Fig.2 Dendrogram of C. violaceum in study based on SRAP genetic similarity |
以GS值0.082 2为阈值又可将第3类分成6个亚类。其中Ⅲ-1、Ⅲ-2、Ⅲ-3和Ⅲ-6除24、25来自广元苍溪外,其余13份材料均来自阆中;Ⅲ-4由7、12及63等33份材料组成,其中,阆中6份、苍溪5份、巴中7份、金堂9份、青白江6份;来自金堂的材料49自成一亚类。
从聚类图中还可以看出,许多来源相同的材料聚在一起。如来自青白江清泉镇桔丰村6组的5份材料、青白江人和乡三元村的4份材料、金堂赵镇云顶的5份材料均先紧密结合在一起。但从材料来源分析看,除第2、5类以外,阆中的23份材料在各类中均有分布。苍溪的8份材料、巴中的7份材料、金堂的12份材料及青白江的13份材料均在不同大类中呈分散分布。9份野生或半野生的材料分散在不同大类中,宽叶和细叶亦呈分散状态,此结果从另一角度证明了川明参的地理生态型确实存在。
3 讨论 3.1 SRAP分子标记研究川明参种质资源遗传多样性的可靠性前人对川明参遗传关系的研究仅限于对明党参与川明参种间的遗传分化和系统关系的研究亦或是对川明参属亲缘关系及其分类地位的研究[12-14],而纯粹对川明参种质资源的遗传多样性及亲缘关系的研究尚是空白。本研究采用SRAP标记对不同产地有代表性的川明参种质资源进行研究,并从37对SRAP引物组合共扩增出川明参多态性条带283条,平均每对引物7.65条,表明川明参的遗传多样性较为丰富。由此表明,本研究建立的SRAP标记体系是分析川明参种质资源多样性比较可靠的工具。本研究结果表明川明参栽培种质资源的遗传差异较野生或半野生材料的大,究其可能的原因,一是由于川明参栽培历史悠久、栽培范围较广,且在栽培过程中存在人为引进野生种质和各地之间相互引种等现象。据《苍溪县志》(1783年)《保宁府志》《巴中县志》记载,川明参已有300多年的人工栽培历史。在长期的生产实践中,药农们常常会在栽培群体中人为地引入野生种,从而在很大程度上丰富了川明参栽培群体的遗传多样性;当前川明参栽培过程中普遍存在异地引种现象,各地间的相互引种也可能是栽培川明参居群维持高水平遗传多样性的重要原因。其次,由于过度采挖,野生川明参居群面积缩小、个体数减少和生境退化造成个体间或居群间基因交流障碍,形成基因隔离,同时也增加了遗传漂变和近交机率,而小居群比大居群更易发生遗传漂变和近交,引起遗传多样性的丢失,居群内近交衰退,造成川明参野生或半野生居群遗传多样性降低。再次,川明参传粉媒介主要是蜂类,而异交和接触性传粉被认为是植物保持较高遗传多样性的原因之一[22],而野生或半野生川明参主要生长在光照较少的灌木丛中,并不利于传粉,这也可能导致其遗传多样性水平比栽培居群的低。
3.2 川明参种质资源聚类结果与地理分布的关系Wilson等[23]认为种质的地理分布与分子标记间存在相关性,在苜蓿[24]、狗牙根[25]、白三叶[26]等草坪草和牧草上的遗传分析也证实了来自相似地理环境的种质可以优先聚为一类。
从本实验的聚类分析看,SRAP标记能将所有供试材料完全区分,聚类结果能够在一定程度上反映材料的地理来源,许多相同地理来源的材料能聚在一起。如来自青白江清泉镇桔丰村的5份材料、青白江人和乡三元村的4份材料、金堂赵镇云顶的5份材料均先紧密结合在一起。对5个不同地理区域川明参群体间的遗传距离和遗传相似系数分析表明,同一地域的川明参材料间遗传距离较小,亲缘关系较近,而不同地域川明参资源群体间遗传变异相对较大,遗传多样性较高,这可能与地区间气候环境差异、物种的适应性变化及人为选择目标不同有关。这亦说明川明参在某一生态环境下,经过长期人工选择和改良后,在遗传结构上发生了能够区别于其他地域的变异。这对以后制定川明参资源遗传多样性的原位保护措施、保护范围、保护地点,以及遗传多样性的考察收集提供了重要参考,也为川明参品种改良及发掘新的优良基因提供了依据。
3.3 川明参叶型和SRAP遗传多样性的相关性川明参从叶型上可分为宽叶和细叶2种类型。本研究聚类结果表明,宽叶和细叶呈分散状态,聚类结果与叶型并无明显的相关性。Zhang等[27]的研究亦发现杨梅种质资源的分类与果实大小、果实颜色等并无明显的相关性,这亦表明从DNA角度进行的品种鉴定相比于形态学角度更具有客观性和科学性。
| [1] | 单人骅, 佘孟兰. 中国植物志(第五十五卷第三分册)[M]. 北京: 科学出版社, 1992 . |
| [2] | 陈胡兰, 苏筱琳, 邓贇, 等. 川明参药效活性部位化学成分研究[J]. 中成药, 2008,30 (9) :1334–1336. |
| [3] | 饶高雄, 王兴文, 刘启新, 等. 川明参的化学成分[J]. 云南植物研究, 1996,18 (3) :359–360. |
| [4] | 周燕, 彭树林, 吕发强, 等. 川明参根部的化学成分[J]. 天然产物研究与开发, 1998,11 (6) :15–17. |
| [5] | 王明安, 彭树林, 王明奎, 等. 川明参茎叶中的化学成分[J]. 高等学校化学学报, 2002,23 (8) :539–541. |
| [6] | 李邦经, 彭树林, 梁婕, 等. 川明参须根中的化学成分[J]. 中草药, 2004,35 (6) :616–618. |
| [7] | 邵承斌, 李宏, 吴鹤麟, 等. 川明参营养化学成分的研究[J]. 中草药, 1997,28 (10) :590–591. |
| [8] | 赵波, 李宏, 任波, 等. 川明参不同加工品化学成分指纹图谱比较研究[J]. 中成药, 2011,33 (4) :557–559. |
| [9] | 金滨滨, 陈朝霞, 陈璐, 等. 川明参地上部分与根的化学成分比较研究[J]. 中药与临床, 2013,4 (6) :7–10. |
| [10] | 张梅, 雨田, 苏筱琳, 等. 川明参镇咳祛痰药理作用研究[J]. 时珍国医国药, 2006,17 (7) :1121–1122. |
| [11] | 张梅, 苏筱琳, 雨田, 等. 川明参药理作用初步研究[J]. 中药药理与临床, 2007,23 (2) :49–50. |
| [12] | 邱英雄, 傅承新, 吴斐捷. 明党参与川明参群体遗传结构及分子鉴定的ISSR分析[J]. 中国中药杂志, 2003,28 (7) :598–603. |
| [13] | 陶晓瑜, 桂先群, 傅承新, 等. 明党参和川明参种间遗传分化和系统关系的分子标记和ITS序列分析[J]. 浙江大学学报: 农业与生命科学版, 2008,34 (5) :473–481. |
| [14] | 宋春凤, 吴宝成, 周伟, 等. 基于psbA-trnH序列变异分析川明参属亲缘关系及分类地位[J]. 植物资源与环境学报, 2014,23 (2) :19–26. |
| [15] | Li G, Quiros C F. Sequence-related amplified polymorphism(SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J]. Theor Appl Genet, 2001, 103 (2/3) :455–461 . |
| [16] | 艾强, 周涛, 江维克, 等. 川续断种质资源遗传多样性的SRAP分析[J]. 中草药, 2013,44 (15) :2155–2159. |
| [17] | 马秀杰, 王冠明, 韩烈保. 不同产地麦冬遗传多样性的SRAP分析[J]. 草业科学, 2012,29 (11) :1686–1691. |
| [18] | 刘志飞, 高洁, 滕中华. 不同种源黑龙骨遗传关系的SRAP分析[J]. 农业生物技术学报, 2014,22 (7) :862–869. |
| [19] | 包英华, 潘超美, 白音, 等. 铁皮石斛种质资源遗传多样性的SRAP分析[J]. 北京中医药大学学报, 2014,37 (5) :349–353. |
| [20] | 柴锟, 刘红昌, 李金玲, 等. 基于SRAP分子标记的天麻遗传多样性研究[J]. 中草药, 2014,45 (20) :2974–2981. |
| [21] | Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucl Acids Res, 1980, 8 :4321–4325 . |
| [22] | Cruse-Sanders J M, Hamrick J L. Genetic diversity in harnested and protected populations of wild American ginseng, Panax quinquefolius L. (Araliaceae)[J]. Am J Bot, 2004, 91 :540–548 . |
| [23] | Wilson B L, Kitzmilier J, Rolle W, et al. Isozyme variation and its envirionmental correlates in Elymus glaucus from the Californial Floristic Province[J]. Cana J Bot, 2001, 79 :139–153 . |
| [24] | 何庆元, 吴苹, 张晓红, 等. 不同秋眠性苜蓿SRAP体系优化及遗传多样性分析[J]. 草业学报, 2011,20 (2) :201–209. |
| [25] | 凌瑶, 张新全, 齐晓芳, 等. 西南五省区及非洲野生狗牙根种质基于SRAP标记遗传多样性分析[J]. 草业学报, 2010,19 (2) :196–203. |
| [26] | 张婧源, 彭燕, 罗燕, 等. 不同产地白三叶种质遗传多样性的SRAP分析[J]. 草业学报, 2010,19 (5) :130–138. |
| [27] | Zhang S M, Gao Z S, Xu C J, et al. Genetic diversity of Chinese Bayberry (Myrica rubra Sieb. et Zucc.) accessions revealed by amplified fragment length polymorphism[J]. Hore Sci, 2009, 44 (2) :487–491 . |
 2016, Vol. 47
2016, Vol. 47


