脑胶质瘤是颅内常见的发生于神经外胚层的恶性肿瘤,来源于星形胶质细胞或少突胶质细胞,占颅内肿瘤的35.26%~60.9%[1-2]。但是由于血脑屏障(blood brain barrier,BBB)的存在,普通的化疗方式很难使药物进入肿瘤组织从而起到杀伤肿瘤细胞的作用。目前跨BBB的脑靶向策略中,转运体介导转运具有高度识别性,允许药物或载药系统跨细胞膜转运,是递药入脑的主要方法之一[3-4]。BBB上存在着大量的转运通道蛋白[5],其中葡萄糖转运蛋白(glucose transporter-1,GLUT1)是BBB中最高效的转运体[6],在BBB上的密度大约是除红细胞膜外其他组织的10倍[7]。利用GLUT1转运体的介导作用,将载体与葡萄糖(glucose,GLU)分子偶联,可实现载体跨BBB转运。
脂质体是磷脂、胆固醇等分散在水中形成的类球状、包封一部分水相的的封闭囊泡。脂质体具有很高的亲脂性,可通过如被动转运、与脑血管内皮细胞膜发生膜融合转运至脑实质[8-9],因此脂质体本身是一种良好的治疗中枢神经系统疾病药物载体。将GLU与脂质材料偶联,用于制备GLU修饰脂质体,可进一步促进脂质体跨越BBB,显著增加药物入脑量[10-11]。胆固醇作为脂质体组成膜材之一,常与靶向功能基团偶联[11],且多采用化学法合成[12]。李海姣等[13]将葡萄糖羟基(GLU-OH)与胆固醇通过化学法共价偶联,然后与磷脂以一定比例混合制备葡萄糖修饰脂质体,体内靶向性研究表明:经GLU修饰的脂质体具有较好的BBB透过性。
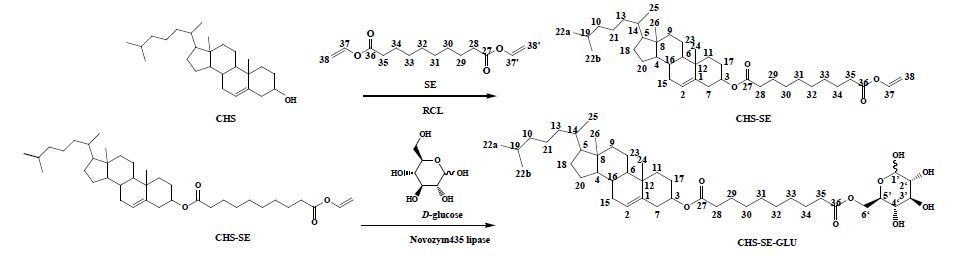
GLU上存在5个化学环境相似的-OH,进一步的构效关系研究显示:当载体与GLU C6位-OH(C6-OH)偶联时,GLUT1对其亲和能力最强[14]。由于化学合成法很难区分GLU上众多化学性质相近的-OH,为得到某单一反应位点的产物,需预先对非反应位点的-OH采取复杂的保护和去保护措施[15]。脂肪酶是一种具有催化功能的蛋白质,与化学合成法相比,具有高效、高区域选择性、低毒等优点,被称之为绿色催化剂,尤其对糖分子的区域选择性酯化具有独特的优势。前期研究发现,脂肪酶Novozym 435在非水相中可专一催化GLU上C6- OH酯化反应。据此,本研究拟设计一种含葡萄糖基的脑靶向脂质材料,具体思路如下:利用前期合成的胆固醇-癸二酸单烯酯(CHS-SE)[16]为起始原料,在Novozym 435催化下,选择性与GLU上C6-OH酯化偶联,即得到脑靶向脂质材料胆固醇-癸二酸-葡萄糖酯[(5-cholesten-3β-yl) (D-glucopy- ranose-6) sebacate,CHS-SE-GLU](图 1)。将CHS- SE-GLU作为靶向头与磷脂、胆固醇、紫杉醇(PTX)等材料制备出脑靶向载紫杉醇脂质体(GLU-PTX- LP),并对GLU-PTX-LP制备工艺、处方进行优化。
|
图 1 酶催化合成脑靶向脂质材料CHS-SE-GLU Fig.1 Lipase-catalyzed synthesis of CHS-SE-GLU |
1 仪器与材料
Thermo TSQ Quantum ACESS三重四极杆液质联用仪,赛默飞世尔科技有限公司;Bruker 500M核磁共振波谱仪,瑞士布鲁克公司;Alliance 2695高效液相色谱仪、2996 PDA二极管矩阵检测器,美国沃特世公司;B15型高压均质机,加拿大AVESTIN公司;ZetasizerNano ZS90粒度测定仪,英国马尔文仪器有限公司;Scientz-ⅡD超声波细胞粉碎机,宁波新芝生物科技股份有限公司;BS110s型电子分析天平,德国Sartorius公司;RE-5299型旋转蒸发仪,上海亚荣生化仪器厂;TGL-16MC冷冻离心机,长沙湘锐离心机有限公司。
胆固醇(cholesterol,CHS),质量分数>98.5%,生产批号A90719,日本精化株式会社;氢化大豆磷脂(hydrogenated soya phosphatide,HSPC,1-棕榈酰基-2-硬脂酰基卵磷脂质量分数>98%,生产批号B40932)、蛋黄磷脂(egg yolk lecithin,EPC,磷脂酰胆碱质量分数>98%,生产批号AL14015),日本丘比株式会社;二硬脂酰磷脂酰甘油钠(distearoyl phosphatidylglycerole sodium salt,DSPG-Na),注射级,上海艾维特有限公司;紫杉醇(paclitaxel,PTX),质量分数>99%,大连美仑生物技术有限公司;鱼精蛋白,来源于鲑鱼,Sigma-Aldrich Corporation;Novozym 435固定化脂肪酶,诺维信生物技术有限公司;Candida rugosa Lipase(RCL),Sigma-Aldrich Corporation;D-葡萄糖(D-glucose,GLU)、癸二酸、乙酸乙烯酯,乙酸汞、乙酸铜、乙酸钠、浓硫酸,阿拉丁试剂有限公司;微孔滤膜,天津津腾实验设备有限公司;色谱甲醇,赛默飞世尔科技(中国)有限公司;柱色谱硅胶,青岛海洋化工有限公司;石油醚、醋酸乙酯、异辛烷、丙酮、氯仿、乙醇,广州化学试剂厂;水为自制超纯水。
2 方法与结果 2.1 脑靶向脂质材料CHS-SE-GLU合成 2.1.1 癸二酸二乙烯酯(divinyl sebacicacid,SE)的制备及结构表征SE的制备参照王利娟等[17]开发的方法,并稍作修改。称取72.8 g癸二酸、150 mL乙酸乙烯酯、2.1 g乙酸汞及微量乙酸铜,加入到250 mL三口颈烧瓶中。将盛有上述物质的三口颈烧瓶在50 ℃的恒温水浴中加热并搅拌,10 min后滴加0.25 mL浓硫酸,反应8 h。反应完毕后,加入约2 g乙酸钠充分震荡以中和硫酸。水泵减压蒸馏除去过量醋酸乙烯酯后,将剩余蓝色液体经硅胶柱色谱,用石油醚-醋酸乙酯(9∶1)等度洗脱,分离得到纯品(质量分数95%以上)。纯品经MS、NMR波谱技术进行结构鉴定为目标产物。波谱数据如下:ESI-MS m/z 277.22 [M+Na]+;1H-NMR (500 MHz,CDCl3) δ: 7.28 (H-37,37′,m,2H),4.87 (H-38,dd,J = 14.0,1.2 Hz,2H),4.55 (H-38′,dd,J = 6.3,1.2 Hz,2H),2.37 (H-35,28,t,J = 7.5 Hz,4H),1.65 (H-34,29,m,4H),1.33 (H-30~33,m,8H);13C-NMR (125 MHz,CDCl3) δ: 171.2 (C-27,36),141.6 (C-37,37′),97.8 (C-38,38′),34.3 (C-28,35),29.4 (C-30,33),29.3 (C-31,32),24.9 (C-29,34)。
2.1.2 酶促合成胆固醇-癸二酸单烯酯[(5- cholesten-3β-yl) vinyl sebacicacid,CHS-SE]及结构表征[16]取具塞锥形瓶,称取1.3 g SE、1 g CHS,加入脱水异辛烷适量溶解,置于恒温震荡器于45 ℃振摇30 min后,加入RCL 200 mg,反应24 h。反应结束后,滤过除去RCL,续滤液真空旋干得黏稠液体,然后用适量甲醇超声溶解,0 ℃下静置24 h析晶,低温下真空抽滤,得白色粉未,收率约95%。产物结构经MS、NMR鉴定为目标产物,具体数据如下:ESI-MS m/z 619.51 [M+Na]+;1H-NMR (500 MHz,CDCl3) δ: 7.28 (H-37,m,1H),5.37 (H-2,d,J = 4.5 Hz,1H),4.87 (H-38a,dd,J = 14.0,1.5 Hz,1H),4.61 (H-3,m,1H),4.56 (H-38b,dd,J = 6.3,1.5 Hz,1H),2.38 (H-7,t,J = 7.5 Hz,2H),2.31 (H-28,d,J = 7.3 Hz,2H),2.26 (H-35,t,J = 7.5 Hz,2H),1.99 (H-15,m,2H),1.78~1.04 (m,36H),1.02 (H-24,s,3H),0.91 (H-25,d,J = 6.5 Hz,3H),0.86 (H-22a,22b,dd,J = 2.3,6.6 Hz,6H),0.67 (H-26,s,3H);13C-NMR (125 MHz,CDCl3) δ: 173.4 (C-27),171.0 (C-36),141.4 (C-1),139.9 (C-37),122.75 (C-2),97.6 (C-38),73.9 (C-3),56.8 (C-4),56.3 (C-5),50.2 (C-6),42.5 (C-8),39.9 (C-9),39.7 (C-10),38.3 (C-7),37.2 (C-11),36.8 (C-12),36.3 (C-13),35.9 (C-14),34.8 (C-28),34.1 (C-35),32.0 (C-15),32.0 (C-16),29.2 (C-31),29.2 (C-32,C-30),29.1 (C-33),28.4 (C-18),28.2 (C-19),28.0 (C-17),25.2 (C-29),24.7 (C-34),24.4 (C-20),24.0 (C-21),23.0 (C-22a),22.7 (C-22b),21.2 (C-23),19.5 (C-24),18.9 (C-25),12.0 (C-26)。
2.1.3 酶促合成CHS-SE-GLU及结构表征取具塞锥形瓶,称取1 g GLU、6.6 g CHS-SE,加入脱水丙酮适量溶解,置于恒温震荡器于45 ℃振摇30 min后,加入Novozym 435适量,反应12 h。反应结束后,滤过除去Novozym 435,续滤液真空旋干得产物粗品。粗品经硅胶柱色谱纯化后得白色粉未,收率约92%。产物结构经MS、NMR鉴定为目标产物,具体数据如下:ESI-MS m/z 755.59 [M+Na]+;1H-NMR (500 MHz,C5D5N) δ: 5.90 (H-1′,d,J = 3.5 Hz,1H),5.42 (H-2,m,1H),5.09 (H-6′a,dd,J = 1.6,11.2 Hz,1H),4.91 (H-5′,m,1H),4.87 (H-3,dd,J = 2.8,5.6 Hz,1H),4.84 (H-6′b,m,1H),4.76 (H-2′,t,J = 9.1 Hz,1H),4.23 (H-3′,dd,J = 3.6,9.5 Hz,1H),4.14 (H-4′,dd,J = 5.9,12.4 Hz,1H),2.54 (H-7,m,2H),2.40 (H-28,t,J = 7.5 Hz,2H),2.33 (H-35,m,2H),2.05~1.06 (m,38H),1.03 (H-24,s,3H),0.99 (H-25,d,J = 6.5 Hz,3H),0.91 (H-22a,22b,dd,J = 1.2,6.6 Hz,6H),0.68 (H-26,s,3H);13C-NMR (125 MHz,C5D5N) δ: 174.1 (C-36),173.4 (C-27),140.4 (C-1),123.2 (C-2),94.6 (C-1′),75.7 (C-2′),74.8 (C-3′),74.2 (C-3),72.7 (C-4′),71.3 (C-5′),65.6 (C-6′),57.2 (C-4),56.8 (C-5),50.6 (C-6),42.9 (C-8),40.3 (C-9),40.1 (C-10),39.0 (C-7),37.6 (C-11),37.2 (C-12),36.9 (C-13),36.4 (C-14),35.2 (C-28),34.8 (C-35),32.6 (C-15),32.4 (C-16),29.7 (C-31,32),29.7 (C-30),29.7 (C-33),28.9 (C-18),28.6 (C-19),28.6 (C-17),25.8 (C-29),25.6 (C-34),24.9 (C-20),24.6 (C-21),23.4 (C-22a),23.1 (C-22b),21.7 (C-23),19.8 (C-24),19.4 (C-25),12.4 (C-26)。
2.2 薄膜分散法制备GLU-PTX-LP[18]按处方量称取HSPC、CHS、CHS-SE-GLU、DSPG-Na等膜材及PTX溶于适量无水氯仿中,真空旋转蒸发除去有机溶剂,制得均匀脂膜,置真空干燥器内干燥过夜。加入一定体积的水溶液,于一定温度下水化,水化一定时间后,探头超声5 min(超声时间2 s,间隔时间2 s,功率为300 W),高压均质(60、180 MPa,各3次),即得GLU-PTX-LP。 按上述工艺,处方中不加入PTX,其余同上,制备得空白脂质体。
2.3 GLU-PTX-LP包封率测定 2.3.1 色谱条件色谱柱为XBridge Peptide BEH C18柱(填料孔径13 nm,250 mm×4.6 mm,5 μm);流动相为甲醇-水(70∶30);进样量10 μL,检测波长228 nm;PTX保留时间8.56 min;体积流量0.8 mL/min;柱温35 ℃;理论塔板数大于3 000。
2.3.2 PTX对照品溶液的制备精密称定PTX对照品1 mg,置于10 mL量瓶中,用乙醇定容,PTX对照品溶液质量浓度为100.0 mg/L。
2.3.3 供试品溶液的制备取GLU-PTX-LP 1 mL置于10 mL量瓶中,用乙醇溶解定容至刻度即得。
2.3.4 空白对照溶液的制备取空白脂质体1 mL置于10 mL量瓶中,乙醇溶解并定容至刻度即得。
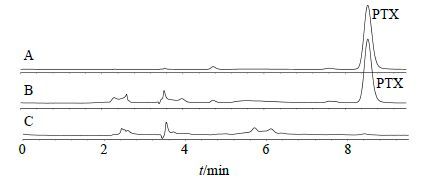
2.3.5 方法专属性取对照品溶液、供试品溶液及空白对照溶液按上述条件进液相分析,结果在“2.3.1”项色谱条件下,PTX和辅料分离度良好,峰形稳定,辅料及溶剂对PTX的测定无干扰,见图 2。
|
图 2 PTX对照品 (A)、GLU-PTX-LP样品 (B) 和空白对照 (C) 溶液的HPLC图 Fig.2 HPLC of PTX reference substance (A), GLU-PTX- LP sample (B), and blank (C) solution |
2.3.6 线性关系考察
精密称取PTX适量,用甲醇溶解配制成1 mg/mL的对照品储备液。精密移取一定量的储备液,配制成0.4、1、5、10、20、30、40、50、75、100 mg/L系列溶液,进样量为10 μL,按“2.3.1”项色谱条件进行测定,记录峰面积。以质量浓度(C)为横坐标,峰面积积分值(A)为纵坐标,得回归方程为A=23 868 C+1 257.4,r2=0.999 9(n=3),结果表明,PTX在0.4~100.0 mg/L,峰面积与质量浓度呈良好的线性关系。
2.3.7 精密度试验取PTX对照品溶液,连续进样6次,按“2.3.1”项色谱条件测定PTX峰面积,RSD为1.05%,表明此方法精密度良好。
2.3.8 稳定性试验取供试品溶液,分别于0、2、4、6、8、12、24 h分别进样,按“2.3.1”项色谱条件测定PTX峰面积,RSD为2.29%,表明PTX溶液在24 h内保持稳定。
2.3.9 重复性试验精密量取同一份样品6份,每份1 mL,按“2.3.3”项下方法制备6份GLU-PTX-LP供试品溶液,按“2.3.1”项色谱条件测定PTX峰面积,按“2.3.6”项下回归方程换算成样品中PTX的量:44.95、45.28、44.70、44.72、44.62、44.30 mg/L,其RSD为0.67%,表明此方法重复性良好。
2.3.10 加样回收率试验分别精密移取PTX对照品溶液(100 mg/L)0.25、0.50、0.75 mL加入到0.5 mL空白脂质体溶液中,用乙醇破乳定容至10 mL,得到质量浓度为2.5、5.0、7.5 μg/mL样品溶液,分别进样10 μL,测定PTX峰面积,代入回归方程得到实际测定质量浓度,计算回收率及RSD。结果3个质量浓度样品的平均回收率分别为99.20%、98.60%、98.67%,RSD为0.29%、0.28%、0.43%(n=5),结果表明在此条件下回收率介于98.0%~102.0%,RSD<2%,回收率符合要求。
2.3.11 包封率的测定[19]采用鱼精蛋白沉淀法。取GLU-PTX-LP溶液0.1 mL于锥形离心管中,用超纯水稀释至1.1 mL,混匀,1 000 r/min离心10 min。吸取上清液1 mL,加入鱼精蛋白1 mg,混匀,10 000 r/min离心15 min移去上清液,脂质体沉淀用超纯水清洗2次,最后所得脂质体沉淀用乙醇溶解定容至1 mL,制得样品S2,进液相分析,记为C2;另取GLU-PTX-LP溶液0.1 mL,乙醇破乳定容至1 mL,制得样品S1,进液相分析,记为C1,包封率按公式(包封率=C1/C2)计算。
2.4 GLU-PTX-LP处方及工艺条件优化 2.4.1 统计分析采用SPSS 22.0统计软件对数据进行单因素方差分析,组间均数比较采用F检验,P<0.05时差异具有统计学意义。
2.4.2 磷脂种类对GLU-PTX-LP的影响磷脂是构成脂质体膜材的主要成分。采用不同种类磷脂制备脂质体,其包封率、粒度、Zeta电位及稳定性也有所不同。固定其他条件,分别以EPC、HSPC为膜材制备GLU-PTX-LP,考察其对包封率的影响。结果输入SPSS 22.0软件分析,发现磷脂种类对包封率、Zeta电位无显著性影响,对粒径的影响显著(P<0.05)。结果如表 1所示,HSPC制得的脂质体包封率较EPC高,但粒度大于EPC,两者Zeta电位相似。HSPC为氢化磷脂,氧化稳定性要远优于EPC。综合考虑,选择HSPC作为膜材。
|
|
表 1 磷脂种类对GLU-PTX-LP的影响 (x±s, n = 3) Table 1 Effect of different phospholipids on GLU-PTX-LP (x±s, n = 3) |
2.4.3 药脂比对GLU-PTX-LP的影响
脂质体双分子层对药物的容量有饱和性,过高的药脂比导致脂质体外游离药物增多,降低包封率,而且改变药物在体内的分布行为,影响药物的疗效;而过低的药脂比导致药物浓度过低,同时降低磷脂的利用率。固定其他条件,考察不同PTX与HSPC比例(质量比)对GLU-PTX-LP的影响。结果输入SPSS 22.0软件分析,显示质量比对GLU-PTX-LP包封率、粒径、Zeta电位均有显著影响(P<0.05)。结果如表 2所示,随着PTX与HSPC比例逐渐增大,包封率呈先增后降的趋势,说明脂质体容量饱和前,增加的PTX都包入脂质体中,包封率增大;当达到饱和后,过量的PTX会游离于脂质体外,包封率反而降低。当PTX与HSPC比例为0.1∶1,包封率最高。
|
|
表 2 药脂比对GLU-PTX-LP的影响 (x±s, n = 3) Table 2 Effect of different drug-lipid ratios on GLU-PTX- LP (x±s, n = 3) |
2.4.4 磷脂与胆固醇比例对GLU-PTX-LP的影响
CHS作为稳定剂,加入到脂质体中能增加脂质体双分子膜的流动性,减少膜渗透性,起到稳定脂质体的作用[20]。但过量的CHS会占用脂质体双分子层空间,导致对药物容量下降。固定其他条件,考察不同CHS与HSPC比例(质量比)对GLU-PTX-LP的影响。结果输入SPSS 22.0软件分析,显示磷脂与胆固醇比例对GLU-PTX-LP包封率、粒径、Zeta电位均有显著影响(P<0.05)。结果见表 3,随着CHS与HSPC比值增大时,包封率先增大后减小,当其比值为0.5∶1时,包封率最高,因此确定HSPC与CHS比值为0.5∶1。
|
|
表 3 磷脂与胆固醇比例对GLU-PTX-LP的影响 (x±s, n = 3) Table 3 磷脂与胆固醇比例对GLU-PTX-LP的影响 (x±s, n = 3) |
2.4.5 DSPG-Na用量对GLU-PTX-LP的影响
当脂质体膜表面带电荷时,Zeta电位越大表示所带电荷越多,可使由双电层引起的静电斥力增大,凝聚时要克服的能量越大,越不易产生凝聚,从而增加脂质体的稳定性,其包封率也越高[21]。固定其他条件,考察DSPG-Na投入量占磷脂不同质量百分比对GLU-PTX-LP的影响。结果输入SPSS 22.0软件分析,显示DSPG- Na用量对GLU-PTX-LP包封率无显著性影响,对粒径、Zeta电位均有显著性影响(P<0.05)。结果见表 4,DSPG-Na的加入可显著增加脂质体表面电位值,当DSPG-Na用量占磷脂质量为2.5%和5%时,包封率和粒径较好,Zeta电位绝对值都超过30 mV,考虑到DSPG-Na昂贵的价格,最终确定用量为2.5%。
|
|
表 4 DSPG-Na用量对GLU-PTX-LP的影响 (x±s, n = 3) Table 4 Effect of different DSPG-Na contents on GLU- PTX-LP (x±s, n = 3) |
2.4.6 水化时间对GLU-PTX-LP的影响
一定的水化时间有助于磷脂与胆固醇水中闭合成脂质体囊泡,但过长的水化时间会引起药物和脂质体的氧化,导致包封率下降。固定其他条件,考察不同水化时间对GLU-PTX-LP的影响。结果输入SPSS 22.0软件分析,显示水化时间对GLU-PTX-LP包封率、粒径、Zeta电位均有显著影响(P<0.05)。结果见表 5,表 1 h水化时间包封率最高,0.5 h水化时间包封率虽略低于1 h,但粒度与Zeta电位优于1 h,综合考虑,最终确定水化时间为0.5 h。
|
|
表 5 水化时间对GLU-PTX-LP的影响 (x±s, n = 3) Table 5 Effect of different hydration times on GLU-PTX- LP (x±s, n = 3) |
2.4.7 水化温度对GLU-PTX-LP的影响
文献报道氢化磷脂的相转变温度大都在40 ℃左右,制备脂质体时往往需要50 ℃以上的水化温度[22],有助于增加脂膜的流动性,让药物进入脂质双分子层,但过高的温度亦会引起脂膜的不稳定,而且也会使磷脂氧化加速,导致包封率下降。固定其他条件,考察不同水化温度对GLU-PTX-LP的影响。结果输入SPSS 22.0软件分析,显示水化温度对GLU-PTX-LP包封率、粒径、Zeta电位均有显著影响(P<0.05)。结果见表 6,水化温度为60 ℃时,制得脂质体包封率最高,但粒径相对于40、50 ℃水化温度时增大约1倍;40 ℃时包封率虽略高于50 ℃,但Zeta电位绝对值相对于50 ℃却降低了约10 mV,说明50 ℃制备的脂质体更稳定,综合考虑,确定水化温度为50 ℃。
|
|
表 6 水化温度对GLU-PTX-LP的影响 (x±s, n = 3) Table 6 Effect of different hydration temperatures on GLU- PTX-LP (x±s, n = 3) |
通过单因素考察,筛选出各因素最优值,即:采用HSPC作为膜材,HSPC与PTX比例为0.1∶1,CHS与HSPC比例为0.5∶1,DSPG-Na用量为2.5%,水化时间0.5 h,水化温度50 ℃。采用上述工艺处方制备3批样品,测定包封率、粒径和Zeta电位,结果见表 7。3次验证实验的结果基本一致,说明所确定的优化工艺合理可行,稳定可靠,重现性良好。
|
|
表 7 验证实验结果 (x±s, n = 3) Table 7 Results of verification test (x±s, n = 3) |
3 讨论
本实验设计了一种含葡萄糖基胆固醇衍生物脂质材料CHS-SE-GLU。该分子由3部分组成:胆固醇基、葡萄糖基以及用于连接2部分的长链碳桥。其亲油性胆固醇基可牢固镶嵌于磷脂双分子层,亲水性葡萄糖基则借助SE长链碳桥伸展于脂质体外层,用于被GLUT1识别并捕获,介导脂质体跨BBB转运至脑内病变部位。GLUT1对葡萄糖类似物的识别效率主要取决以下几个因素:GLU上-OH取代位置、GLU在脂质体表面的密度、GLU与脂质体之间的空间距离等[10-11],其中载体与GLU上-OH偶联位置起关键作用。Mueckler等[23]研究发现,GLU上C6-OH连接疏水基团时,与GLUT1有较强的亲和力。为使CHS-SE与GLU连接点只位于C6-OH,本实验考察了多种脂肪酶在不同溶媒中酯化的结果,实验结果显示Novozym 435催化效果最好。Novozym 435是一种来源于Candida Antarctica B的固定化脂肪酶,文献报道可高选择性专一催化GLU C6-OH的酯化[24]。为验证CHS-SE与GLU在Novozym 435催化下酯化的位点,本实验对比了13C-NMR谱图上GLU与CHS-SE-GLU糖部分碳信号的位移变化,发现CHS-SE-GLU糖基部分C-6'信号向低场位移约δ 2,而C-5′信号向高场位移约δ 3,其他碳信号位移基本没有变化。通常,糖部分OH被乙酰化会使其烷甲基碳(α-C)信号向低场位移(δ 2~4),它的邻位碳(β-C)信号向高场位移(δ −2~−6),这种改变称为苷化位移。利用这个规律,判定酯化反应只发生在GLU C-6位上,与文献报道的结果一致[24]。
脂质体的靶向疗效与粒径、包封率密切相关。文献报道[25],当脂质体粒径在100 nm时,其被单核吞噬细胞系统(mononuclear phagocyte system,MPS)截留的量最少,血循环时间最长,在肿瘤组织中被截留的量最多。另有研究显示[1],人体其他部位实体瘤的新生血管内皮间隙在0.1~2.0 μm,而脑胶质瘤的间隙孔径仅为100 nm左右,因此有必要控制GLU-PTX-LP的粒径在100 nm,以提高其在脑肿瘤部分的蓄积。包封率是评价脂质体制剂的制备工艺和质量评价的重要指标,也是较普通制剂发挥高效、低毒特点并提高药物治疗指数、降低药物不良反应并减小药物剂量的关键[26]。本实验通过考察制备方法、膜材组成对GLU-PTX-LP包封率及粒径的影响,优选出最佳制备工艺及处方,在此条件下制备了3批GLU-PTX-LP,结果显示包封率均超过90%,符合《中国药典》规定的脂质体质量要求;粒径100 nm左右,可减少被MPS摄取并能透过脑胶质瘤的间隙发挥靶向治疗作用;Zeta电位为(−25.80±0.85)mV(电位绝对值>15 mV),表明该纳米制剂具有较好的稳定性[27]。
Qin等[10]报道用化学法合成一种葡萄糖-胆固醇衍生物,制备靶向于BBB上葡萄糖转运体的新型脂质体。结果显示,体外BBB模型上评价葡萄糖修饰的脂质体跨过BBB的能力,随着葡萄糖-胆固醇衍生物加入量的增多,脂质体的跨BBB能力增强。但文献报道制备葡萄糖-胆固醇衍生物方法较繁琐,所用试剂亦有一定毒性,不利于产业化应用。相比之下,本实验所设计的脑靶向脂质材料CHS- SE-GLU,结构与之类似,但因采用生物酶做催化剂,使合成步骤较之大大简化,且反应条件温和,副产物少,纯化方法简便,所用试剂毒性小,目标产物总收率能达80%以上,应用前景良好。在后继工作中,将通过体外分子生物学和体内组织分布研究进一步评价GLU-PTX-LP脑靶向性。
| [1] | 李剑峰, 蒋晨. 脑胶质瘤靶向药物递送系统[J]. 国际药学研究杂志, 2013,40 (5) :573–583. |
| [2] | 陈素红, 张丽丹, 金泽武, 等. 扶正消瘤方对脑胶质瘤原位移植模型大鼠的作用及机制研究[J]. 中草药, 2015,46 (13) :1944–1949. |
| [3] | Gaillard P J, Visser C C, Appeldoorn C C, et al. Targeted blood-to-brain drug delivery-10 key development criteria[J]. Curr Pharm Biotechnol, 2012, 13 (12) :2328–2339 . |
| [4] | 王丽娟, 刘克辛. 介导肿瘤多药耐药的ATP结合盒转运体的研究进展[J]. 药物评价研究, 2014,37 (2) :173–177. |
| [5] | Pardridge W M. Blood-brain barrier delivery[J]. Drug Discov Today, 2007, 12 (1/2) :54–61 . |
| [6] | Lamanna J C, Harik S I. Regional comparisons of brain glucose influx[J]. Brain Res, 1985, 326 (2) :299–305 . |
| [7] | Vannucci S J. Developmental expression of GLUT1 and GLUT3 glucose transporters in rat brain[J]. J Neurochem, 1994, 62 (1) :240–246 . |
| [8] | Torchilin V P. Recent advances with liposomes as pharmaceutical carriers[J]. Nat Rev Drug Discov, 2005, 4 (2) :145–160 . |
| [9] | 张丹, 廖芳, 周洁, 等. Box-Behnken Design-响应面优化法优化芍药总苷脂质体的制备工艺及体外释放研究[J]. 中草药, 2015,46 (3) :359–364. |
| [10] | Qin Y, Fan W, Chen H, et al. In vitro and in vivo investigation of glucose-mediated brain-targeting liposomes[J]. J Drug Target, 2010, 18 (7) :536–549 . |
| [11] | Xie F, Yao N, Qin Y, et al. Investigation of glucose-modified liposomes using polyethylene glycols with different chain lengths as the linkers for brain targeting[J]. Int J Nanomed, 2012, 7 :163–175 . |
| [12] | Qu B, Li X, Guan M, et al. Design, synthesis and biological evaluation of multivalent glucosides with high affinity as ligands for brain targeting liposomes[J]. Eur J Med Chem, 2014, 72 (1) :110–118 . |
| [13] | 李海姣, 樊维, 李贤坤, 等. 脑靶向脂质体配体葡萄糖-胆甾偶联物的设计与合成[J]. 华西药学杂志, 2010 (3) :251–253. |
| [14] | Barnett J E, Holman G D, Munday K A. Structural requirements for binding to the sugar-transport system of the human erythrocyte[J]. Biochem J, 1973, 131 (2) :211–221 . |
| [15] | Vulfson E N. Enzymatic synthesis of food ingredients in low-water media[J]. Trends Food Sci Tech, 1993, 4 (7) :209–215 . |
| [16] | 聂华, 郑品劲, 罗利华, 等. 有机相脂肪酶催化合成脂质体修饰物胆固醇癸二酸单烯酯[J]. 中草药, 2013,44 (23) :3289–3295. |
| [17] | 王利娟, 刘准, 郭登峰, 等. 乙烯基交换合成壬酸乙烯酯工艺研究[J]. 热固性树脂, 2012,27 (4) :29–32. |
| [18] | Nie H, Zheng P, Luo L, et al. Optimization of lipase-catalyzed synthesis of novel galactosyl ligands for selective targeting of liposomes to the asialoglycoprotein receptor[J]. Biocatal Biotransfor, 2015, 33 (2) :130–139 . |
| [19] | Shieh M, Chu I, Lee C, et al. Liposomal delivery system for taxol[J]. J Ferment Bioeng, 1997, 83 (1) :87–90 . |
| [20] | Chen C, Han D, Cai C, et al. An overview of liposome lyophilization and its future potential[J]. J Controlled Release, 2010, 142 (3) :299–311 . |
| [21] | 郭海燕, 莫穗林. 脂质体物理稳定性和包封率的影响因素[J]. 中国新药杂志, 2004,13 (6) :498–501. |
| [22] | 王向涛, 杨天智, 李沙, 等. 饱和磷脂脂质体的室温下制备及其性质的研究[J]. 药学学报, 2002,37 (12) :976–980. |
| [23] | Mueckler M, Makepeace C. Transmembrane segment 6 of the Glut1 glucose transporter is an outer helix and contains amino acid side chains essential for transport activity[J]. J Biol Chem, 2008, 283 (17) :11550–11555 . |
| [24] | Degn P, Zimmermann W. Optimization of carbohydrate fatty acid ester synthesis in organic media by a lipase from Candida antarctica[J]. Biotechnol Bioeng, 2001, 74 (6) :483–491 . |
| [25] | 杨莉斌, 沈静, 胡荣. 抗肿瘤药物脂质体粒径对肿瘤靶向性的影响[J]. 华西药学杂志, 2007,22 (4) :428–430. |
| [26] | Zhang X M, Patel A B, de Graaf R A, et al. Determination of liposomal encapsulation efficiency using proton NMR spectroscopy[J]. Chem Phys Lipids, 2004, 127 (1) :113–120 . |
| [27] | 喻樊. 绞股蓝总皂苷脂质体的制备与表征[J]. 中草药, 2013,44 (18) :2526–2530. |
 2016, Vol. 47
2016, Vol. 47


