2. 浙江中医药大学第一临床医学院, 浙江 杭州 310053 ;
3. 浙江中医药大学附属第一医院 中心实验室, 浙江 杭州 310006 ;
4. 浙江中医药大学附属第一医院 病理科, 浙江 杭州 310006
2. First Clinical Medical College of Zhejiang Chinese Medical University, Hangzhou 310053, China ;
3. Central Laboratory, First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310006, China ;
4. Department of Pathology, First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310006, China
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease,IBD)的一种类型,其发病与自身免疫异常相关[1]。目前的治疗以氨基水杨酸、类固醇激素与免疫抑制剂3类药物为主[2-3],但是无法有效的防治,不可长期使用。近年来,大量研究以中药复方、单味药或者活性成分为研究对象,以期开发出治疗、预防溃疡性结肠炎的新型药物。雷公藤多苷片(Tripterygium wilfordii Polycoride Tablet,TWPT)是以雷公藤多苷为主要成分的口服制剂,临床上发现其具有免疫调控及抗炎作用,被应用于治疗一些自身免疫性疾病[4-5],但其对UC的作用及作用机制至今尚未明确。
目前对于TLR4/MyD88依赖信号通路在UC发病中的地位已得到重视[6],既往文献提示微小RNA(miR-146a和miR-146b)与该信号通路密切相关,参与调控肠道内的炎症反应[7]。因此,本实验尝试通过2,4,6-三硝基苯磺酸(TNBS)/乙醇诱导UC大鼠模型作为研究对象,观察TWPT的抗炎作用,并通过检测miR-146a、miR-146b及TLR4/MyD88依赖信号通路的表达情况来探讨TWPT的抗炎作用机制,为TWPT治疗UC提供理论依据。
1 材料 1.1 动物SPF级雄性Wistar大鼠90只,体质量(200±20)g,动物合格证号2007000556038,由浙江中医药大学动物中心提供,常规饲养。
1.2 药物TWPT(浙江德恩制药有限公司生产,批号1311108B,每克雷公藤多苷片原料粉中含有4.17 mg雷公藤内酯甲、0.176 mg雷公藤甲素);硫唑嘌呤片(AZA,上海医药集团有限公司信谊制药总厂生产,批号008953)。
1.3 试剂与仪器5% TNBS(Sigma公司);10%水合氯醛(浙江省中医院);无水乙醇(杭州龙山精细化工有限公司);中心静脉导管(上海景年医疗器械有限公司); miR-146a、miR-146b引物(上海伯豪生物技术有限公司设计);Toll样受体4(TLR4)、髓样分化因子88(MyD88)、肿瘤坏死因子受体相关因子6(TRAF-6)、核因子-κB(NF-κB)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)PCR引物由Takara公司合成;β-actin、NF-κB抗体(Cell Signaling Technology);TLR4抗体、MyD88抗体、TRAF-6抗体、IL-1β抗体(Abcam);TNF-α抗体(R&D);兔二抗;羊二抗;电泳仪及电泳槽(Bio-rad);RNA抽提试剂盒、反转录试剂盒(Takara,Shiga,日本);PCR扩增仪(Applied Biosystems,Foster City,CA,美国)。
2 方法 2.1 分组将90只健康Wistar大鼠随机分为6组,分别为对照组,模型组,TWPT低、中、高剂量(30、60、120 mg/kg)组,AZA阳性对照组,每组15只。
2.2 模型制备大鼠适应性喂养1周,使体质量达到(200±20)g,禁食24 h。10%水合氯醛3 mL/kg ip麻醉后,将石蜡油润滑过的深静脉置管由肛门缓慢插入结肠约8 cm处,模型组和药物组按每只大鼠0.02 mL/kg 5% TNBS+0.25 mL 50%乙醇进行灌肠,对照组按0.02 mL/kg生理盐水+0.25 mL生理盐水进行灌肠,灌肠结束加推0.3 mL空气,用棉签堵住大鼠肛门,轻揉大鼠腹部1 min并倒置5 min,造模结束后将大鼠平放,自然清醒后常规饮食。3 d后评价模型成功与否,具体造模成功标准:造模后2 d内大鼠出现精神倦怠甚至萎靡、懒动、进食明显减少,嗜卧伴消瘦、毛发脏乱、失去光泽,腹泻,大便次数增多,肛周皮毛污秽黏腻,粪便稀烂及血便。
2.3 给药对照组、模型组ig给予0.1 mL/kg生理盐水; AZA组:将AZA研成细末,在细末中加生理盐水制成混悬液,按大鼠AZA 60 mg/kg的剂量ig给药; TWPT低、中、高剂量组:将TWPT研成细末,在细末中加生理盐水制成混悬液,分别按30、60、120 mg/kg的剂量分别ig给药。以上药物在造模3 d后开始给药,每天1次,连续给药14 d。
2.4 观察项目每日观察大鼠体质量、毛发、饮食、大便等一般情况,并进行隐血试验及疾病活动指数(DAI)评分[6]。
2.5 标本采集末次给药24 h后,处死大鼠,各组大鼠均留取距肛门8 cm、前后各多保留0.5 cm的结肠组织进行相关检测。
2.6 观察指标及检测方法 2.6.1 结肠炎症评价①DAI评分:按照Fitzpatrick等[8]提出的标准,通过结合给药l4 d后大鼠体质量下降百分率、大便性状及大便隐血情况进行评分;②大体形态损伤评分:参照Wallace等[9]提出的标准进行评分;③镜下结肠损伤评分:取病变组织进行HE染色,按照Geboes等[10]提出的评分标准进行评分。
2.6.2 qRT-PCR法测定miR-146a及miR-146b的表达情况按RNA抽提试剂盒说明书提取总RNA,紫外分光光度计测定总RNA浓度,重复测定3次,取500 ng RNA按反转录试剂盒说明书(QIAGEN,美国)进行逆转录反应合成cDNA,用ABI 7500 PCR仪(Applied Biosystems,Foster City,CA,美国)按RT-PCR说明书将cDNA进行PCR扩增,以U6为内参,以95 ℃预变性30 s,然后进行循环扩增,95 ℃变性5 s,60 ℃退火加延伸30 s,共40个循环,反应结束后进行熔解曲线分析。miRNA的相对表达量以2−ΔΔCt的形式表示。miR-146a及miR-146b的引物由上海伯豪生物技术有限公司设计。miR-146a、miR-146b引物序列见表 1。
|
|
表 1 miR-146a和miR-146b引物序列 Table 1 Primer sequences for miR-146a and miR-146b |
2.6.3 RT-PCR法测定TLR4/MyD88信号通路相关分子mRNA表达水平
所取标本按RNA抽提试剂盒说明书提取总RNA,紫外分光光度计测定总RNA浓度,重复测定3次,取500 ng RNA按反转录试剂盒说明书进行逆转录反应合成cDNA,用ABI 7500 PCR仪按RT-PCR说明书将cDNA进行PCR扩增,以β-actin为内参,以95 ℃预变性30 s,然后进行循环扩增,95 ℃变性5 s,60 ℃退火加延伸30 s,共40个循环,反应结束后进行熔解曲线分析。采用2−ΔΔCt法分析目的基因的相对表达水平。各信号mRNA分子引物情况见表 2。
|
|
表 2 各信号分子引物情况 Table 2 Primers for each signaling molecules |
2.6.4 Western blotting法测定TLR4/MyD88信号通路相关蛋白表达水平
将所取肠组织标本研磨粉碎后,加入6倍量冷蛋白裂解液[20 mmol/L Tris/HCl(pH 7.5),10 mmol/L APMSF,1 mmol/L EDTA,1 mmol/L DTT]制成缓冲液。取一定量蛋白上样,于10%聚丙烯酰胺凝胶电泳分离,分离的蛋白质转移至PVDF膜。5%脱脂奶封闭2 h,加入TLR4(1∶500)、MyD88(1∶1 000)、TRAF-6(1∶500)、NF-κB(1∶1 000)、TNF-α(1∶5 000)、IL-1β(1∶2 500)单克隆抗体,4 ℃孵育过夜。TBST洗膜5 min×3次。分别加入相应荧光二抗(1∶15 000),室温缓慢震摇2 h,TBST洗膜5 min×3次。采用Odyssey曝光机进行图像显影,Odyssey软件进行图像数据分析,目的蛋白的表达值为目的蛋白的灰度值与β-actin灰度值的比值。
2.7 统计学方法 采用SPSS 17.0统计软件处理数据。数据以
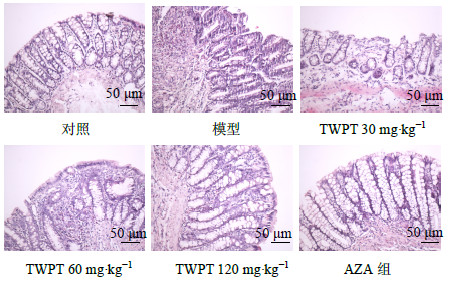
与对照组相比,模型组肠壁与周围组织粘连,肠管增粗,剖开可见溃疡灶,溃疡病变处肠壁增厚,周边黏膜充血水肿,镜下结肠黏膜水肿,黏膜层及浆肌层可见多量淋巴细胞,浆细胞及中性粒细胞浸润,明显的隐窝脓肿,溃疡形成,溃疡表面可见坏死层,肉芽组织形成;TWPT各剂量组及AZA组肠壁与周围组织粘连较轻或无,溃疡少见,隐窝结构基本完整,中性粒细胞、淋巴细胞等炎性细胞少量浸润,其中TWPT高剂量组、AZA组肠壁与周围组织少有粘连,肠管未见明显增粗,肠壁轻度增厚,剖开未见明显溃疡,有轻度黏膜充血水肿,镜下黏膜主要表现为中度慢性炎症,部分黏膜及黏膜下层有少量炎性细胞浸润。治疗14 d后,与对照组相比,模型组大鼠DAI、大体形态损伤以及组织学评分明显增加(P<0.001);与模型组相比,TWPT高剂量组及AZA组结肠炎症评分均有明显降低(P<0.001);与AZA组相比,TWPT高剂量组结肠炎症评分无显著性差异(P>0.05)。远端结肠组织大体图见图 1,病理图见图 2,具体炎症评分见表 3。

|
图 1 远端结肠组织大体图 Fig.1 General pictures of distal colon tissue |
|
图 2 远端结肠组织病理图 Fig.2 Pathological pictures of distal colon tissue |
|
|
表 3 TWPT对UC大鼠结肠炎症评分的影响 (  |
3.2 结肠组织miR-146a及miR-146b表达水平
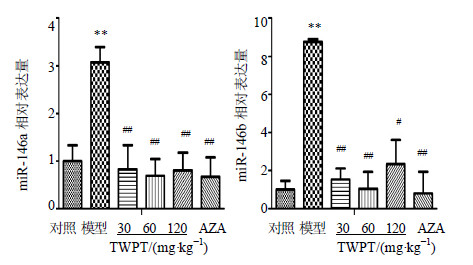
与对照组相比,模型组大鼠结肠组织中miR-146a和miR-146b表达明显增加(P<0.01)。与模型组相比,TWPT及AZA均可显著抑制miR-146a、miR-146b表达(P<0.05、0.01)。从抑制强度而言,TWPT中剂量组对miR-146a、miR-146b的抑制作用最强,TWPT高剂量组略弱于TWPT中剂量组(P<0.05)。各组结肠组织中miR-146a和miR-146b的表达情况见图 3。
|
图 3 各组结肠组织中miR-146a及miR-146b的表达(  |
3.3 结肠组织TLR4/MyD88依赖信号通路相关分子mRNA的表达
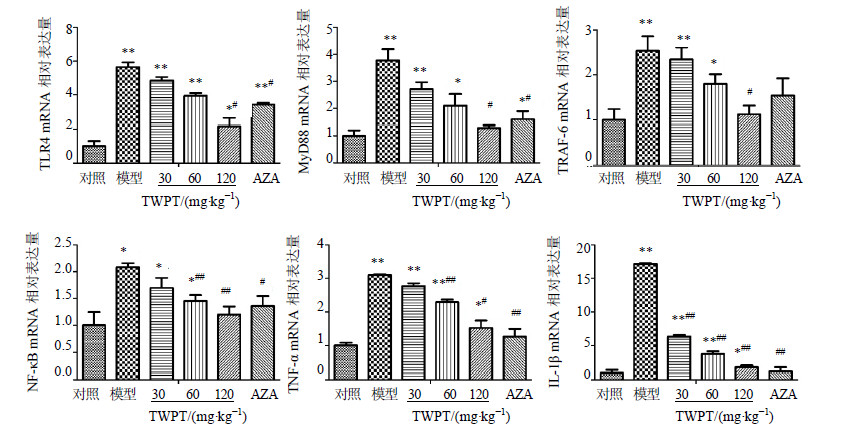
对TLR4/MyD88依赖信号通路的各节点分子mRNA表达水平(TLR4、MyD88、TRAF-6、NF-κB、 TNF-α、IL-1β)而言:与对照组相比,模型组中这些重要节点分子的mRNA表达水平显著升高(P<0.05、0.01)。与模型组相比,TWPT呈剂量依赖性地抑制该信号通路上各节点分子mRNA的表达,其中TWPT高剂量组中各节点分子mRNA表达水平显著低于模型组(P<0.05、0.01)。TWPT高剂量组对TLR4、MyD88、TRAF-6、NF-κB mRNA表达的抑制作用略强于AZA组,而对该信号通路的末端炎症因子IL-1β及TNF-α mRNA水平的抑制作用却略逊于AZA组,但上述2种差异均无统计学意义(P>0.05)。各组结肠组织中TLR4/MyD88依赖信号通路相关mRNA的表达情况见图 4。
|
图 4 各组结肠组织中TLR4/MyD88依赖信号通路相关分子mRNA的表达 (  |
3.4 结肠组织TLR4/MyD88依赖信号通路相关蛋白的表达
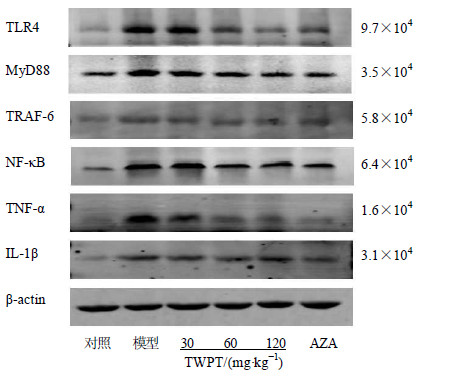
对TLR4/MyD88依赖信号通路的各节点分子蛋白表达水平(TLR4、MyD88、TRAF-6、NF-κB、 TNF-α、IL-1β)而言:与对照组相比,模型组中这些重要节点分子的蛋白表达水平显著升高(P<0.01)。与模型组相比,TWPT呈剂量依赖性地抑制该信号通路上各节点分子蛋白的表达,其中TWPT高剂量组中各节点分子蛋白表达水平显著低于模型组(P<0.01)。与AZA组比较,TWPT高剂量组对该信号通路上游因子(TLR4、MyD88、 TRAF-6、NF-κB)蛋白表达的抑制作用略好于AZA组,而对该信号通路的末端炎症因子IL-1β及TNF-α蛋白水平的抑制作用却略逊于AZA组,但上述2组差异均无统计学意义(P>0.05)。结果见图 5和6。
|
图 5 Western blotting法检测TLR4/MyD88依赖信号通路相关蛋白条带图 Fig.5 Western blotting analysis of related proteins in TLR4/MyD88 dependent signaling pathway |

|
图 6 各组结肠组织中TLR4/MyD88依赖信号通路相关蛋白的表达 (  |
4 讨论
TNBS/乙醇UC大鼠模型是研究UC的极佳模型,其炎症反应与TNBS引起的免疫异常反应密切相关[11]。本研究在TNBS/乙醇灌肠造模后,观察模型组造模后一般情况,发现造模2 d后模型组大鼠出现精神、饮食、毛发、大便次数及性状的改变,隐血测试阳性。造模后DAI评分浮动于7~13分,较对照组显著升高,实验结束后解剖大鼠,观察其结肠组织,均可见病变部位组织与周围组织粘连,有较多、较大的溃疡病灶,周围组织充血水肿,高倍镜下可见结肠黏膜水肿,黏膜层及浆肌层可见大量炎症细胞浸润,溃疡形成,溃疡表面可见坏死层,肉芽组织形成,结肠组织大体形态及镜下组织病理学评分较对照组均有显著升高(P<0.01),证实本研究TNBS/乙醇方法制备大鼠溃疡性结肠炎模型成功。
用TWPT进行3 d的ig治疗后,可见大鼠精神状态开始好转,进食、饮水量及活动量较模型组好转明显,ig 8 d后,大便逐渐成形,偶有稀便,肛周皮毛稍粘,但无便血,体质量有所恢复。实验结束后观察大体形态可见,TWPT高剂量组大鼠肠道黏膜溃疡、炎症状态较模型组改善明显(P<0.01);光镜下可见与模型组相比,TWPT高剂量组淋巴细胞、中性粒细胞、浆细胞等炎性细胞浸润减少,偶可见溃疡,溃疡较浅表(P<0.01);与AZA组镜下组织学评分有所降低(P<0.05),大体评分略高(P>0.05)。提示TWPT对UC大鼠临床症状的改善上及黏膜愈合上具有一定作用,该作用与AZA相比相当或强于AZA。
MicroRNA(miRNA)是一种由19~22个核苷酸组成的非编码微小内源性RNA,它可以作用于3’非编码区(3’untranslated region,3’UTR),最终通过抑制mRNA转录或目标mRNA降解的方式,调控基因表达[12]。因miRNA绑定方式的多样性,miRNA在UC发病过程中扮演重要角色[13]。研究表明miR-146a、miR-146b大多作为一种保护因子,抑制肠道炎症的发生[14-15]。而与以往的文献研究不同,本研究发现:与对照组相比,TNBS/乙醇UC大鼠模型中miR-146a和miR-146b表达明显增加(P<0.01)。与模型组相比,药物TWPT及AZA均可显著抑制miR-146a和miR-146b(P<0.01)。从抑制强度而言,TWPT中剂量组对miR-146a和miR-146b的抑制作用最强,TWPT高剂量组略逊于TWPT中剂量组(P<0.05)。该现象可能提示,TWPT对miR-146a和miR-146b的作用存在一定剂量限制性。
与此同时,本研究分别从蛋白及mRNA水平探讨TLR4/MyD88依赖信号通路在炎症发生中的变化,以及TWPT对此的影响。
由于TLR4可以识别病原体相关分子模式或损伤相关分子模式,经过中间接头蛋白的介导激活相关信号激酶,导致转录因子活化,从而使炎症效应分子转录表达,完成天然免疫应答或激活获得性免疫反应和炎症反应。TLR4信号通路按是否需要接头蛋白MyD88介导,主要分MyD88依赖和非依赖的信号通路[16]。在MyD88依赖的通路中,TLR通过MyD88募集和活化下游白介素-1受体相关激酶4(interleukin-1 receptorassociatedkinase 4,IRAK4)、白介素-1受体相关激酶1(interleukin-1 receptor- associated kinase 1,IRAK1)、白介素-1受体相关激酶2(interleukin-1 receptor-associated kinase 2,IRAK2)和TRAF-6,进而激活丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)、干扰素调节因子5(interferon regulatory factor 5,IRF5)和NF-κB通路完成末端炎症因子IL-1β、TNF-α的转录、释放[17]。因此,本研究将TLR4、MyD88、TRAF-6、NF-κB作为检测分子,能反映TLR4/MyD88依赖信号通路在炎症发生中的改变,并通过对末端炎症因子IL-1β及TNF-α的检测来阐述该信号通路对炎症因子的调控作用。
针对TLR4/MyD88依赖信号通路的上游分子(TLR4、MyD88、TRAF-6、NF-κB)而言,Western blotting及RT-PCR结果均显示:与对照组相比,该信号通路上游分子无论在mRNA水平还是蛋白水平,模型组表达显著升高(P<0.01)。提示该疾病模型与TLR4/MyD88依赖信号通路的异常表达密切相关。与模型组相比,TWPT呈剂量依赖性地抑制该信号通路的上游因子,其中高剂量组与模型组具有显著差异(P<0.05)。同时,TWPT对TLR4、MyD88、TRAF-6、NF-κB组成的级联反应无论在mRNA及蛋白水平,其抑制趋势均呈现递减现象,且蛋白水平更典型。与阳性对照AZA组比较,高剂量TWPT对该信号通路上游因子的抑制作用略好于AZA组,但无显著性差异(P>0.05)。提示TWPT与AZA均能通过抑制TLR4/MyD88依赖信号通路来达到抗炎的目的,TWPT对该信号通路的抑制程度略好于AZA,抑制TLR4/MyD88依赖信号通路为TWPT抗炎的途径之一。
末端炎症因子的Western blotting及RT-PCR结果均显示:与对照组相比,该信号通路末端炎症因子IL-1β及TNF-α无论在mRNA水平还是蛋白水平模型组表达显著升高(P<0.01)。与模型组相比,TWP呈剂量依赖性地抑制该信号通路的末端炎症因子IL-1β及TNF-α,其中高剂量组与模型组具有显著差异(P<0.01)。与阳性对照AZA比较,高剂量TWPT对该信号通路末端炎症因子IL-1β及TNF-α的抑制作用略逊于AZA组,但无显著性差异(P>0.05)。提示TWPT与AZA均对末端炎症因子IL-1β及TNF-α具有抑制作用。与抑制TLR4/MyD88依赖信号通路的上游分子作用程度相比,TWPT对末端炎症因子IL-1β及TNF-α的抑制作用未显示略好于AZA的趋势。这些现象提示,药物对信号通路调控的复杂性,这些复杂性可能会影响到药物最终的抗炎结果。
研究结果提示,中剂量TWPT对miR-146a和miR-146b的抑制作用最强,高剂量TWPT略逊于中剂量,但无显著差异(P>0.05)。与TWPT抑制TLR4/MyD88依赖信号通路及末端炎症因子作用与剂量呈正相关不同,TWPT对miR-146a和miR-146b的作用未表现出这种正相关的趋势。既往文献提示miR-146a和miR-146b的抑制作用也并非局限在TLR4/MyD88依赖信号通路上,它也可通过抑制SHH信号发挥抗炎作用[18],这提示TWPT调控miRNAs及信号通路作用也应具有复杂性,有待进一步研究。
综上所述,本研究显示在TNBS/乙醇UC大鼠模型中,TWPT能通过抑制miR-146a和miR-146b的表达,并能抑制TLR4/MyD88依赖信号通路及炎症因子IL-1β及TNF-α释放,对信号通路及炎症因子的作用强度与剂量呈正相关。
| [1] | Zhu H, Li Y R. Oxidative stress and redox signaling mechanisms of inflammatory bowel disease:updated experimental and clinical evidence[J]. Exp Biol Med, 2012, 237 (5) :474–480 . |
| [2] | 丁海荣, 王丙信, 任清华, 等. 复方甘草酸苷联合柳氮磺吡啶治疗溃疡性结肠炎的临床研究[J]. 现代药物与临床, 2016,31 (3) :367–370. |
| [3] | 刘茉莉, 陈刚, 林琳, 等. 复方肠泰对葡聚糖硫酸钠诱导的溃疡性结肠炎治疗作用的研究[J]. 药物评价研究, 2016,39 (1) :52–56. |
| [4] | Zhang C, Jiang M, He X J, et al. Clinical trials of integrative medicine for rheumatoid arthritis:Issues and recommendations[J]. Chin J Integr Med, 2015, 21 (6) :403–407 . |
| [5] | 池婕, 林兵, 刘志宏, 等. 基于最小二乘回归分析法的雷公藤多苷片免疫抑制作用谱效关系研究[J]. 中草药, 2015,46 (18) :2755–2758. |
| [6] | González-Navajas J M, Fine S, Law J, et al. TLR4 signaling in effector CD4+ T cells regulates TCR activation and experimental colitis in mice[J]. J Clin Invest, 2010, 120 (2) :570–581 . |
| [7] | Schulte L N, Westermann A J, Vogel J. Differential activation and functional specialization of miR-146 and miR-155 in innate immune sensing[J]. Nucl Acids Res, 2013, 41 (1) :542–553 . |
| [8] | Fitzpatrick L R, Wang J, Le M. In vitro and in vivo effects of gliotoxin, a fungal metabolite:Efficacy against dextran sodium sulfate-induced colitis in rats[J]. Dig Dis Sci, 2000, 45 (12) :2327–2336 . |
| [9] | Wallace J L, Keenan C M, Gale D, et al. Exacerbation of experimental colitis by NSAIDs is not related to elevated leukotriene B4 synthesis[J]. Gastroenterology, 1992, 102 (1) :18–27 . |
| [10] | Geboes K, Riddell R, Ost A, et al. A reproducible grading scale for histological assessment of inflammation in ulcerative colitis[J]. Gut, 2000, 47 (3) :404–409 . |
| [11] | Driss V, El Nady M, Delbeke M, et al. The schistosome glutathione S-transferase P28GST, a unique helminth protein, prevents intestinal inflammation in experimental colitis through a Th2-type response with mucosal eosinophils[J]. Mucosal immunol, 2016, 9 (2) :322–335 . |
| [12] | Bartel D P. MicroRNAs:target recognition and regulatory functions[J]. Cell, 2009, 136 (2) :215–233 . |
| [13] | Zwiers A, Kraal L, van de Pouw Kraan T C, et al. Cutting edge:a variant of the IL-23R gene associated with inflammatory bowel disease induces loss of microRNA regulation and enhanced protein production[J]. J Immunol, 2012, 188 (4) :1573–1577 . |
| [14] | Baltimore D, Boldin M, Taganov K. Modulation of innate immunity receptors' signaling by microRNAs miR-146a and miR-146b:U. S. Patent 8, 669, 235[P]. 2014-3-11. |
| [15] | Schulte L N, Westermann A J, Vogel J. Differential activation and functional specialization of miR-146 and miR-155 in innate immune sensing[J]. Nucl Acids Res, 2013, 41 (1) :542–553 . |
| [16] | Saito K, Katakura K, Suzuki R, et al. Modulating Toll-like receptor 4 signaling pathway protects mice from experimental colitis[J]. Fukushima J Med Sci, 2013, 59 (2) :81–88 . |
| [17] | Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J]. Immunity, 2011, 34 (5) :637–650 . |
| [18] | Ghorpade D S, Sinha A Y, Holla S, et al. NOD2-nitric oxide-responsive micro RNA-146a activates Sonic hedgehog signaling to orchestrate inflammatory responses in murine model of inflammatory bowel disease[J]. J Biol Chem, 2013, 288 (46) :33037–33048 . |
 2016, Vol. 47
2016, Vol. 47


