2. 国家教育部抗肿瘤天然药物工程研究中心, 黑龙江哈尔滨 150076
2. Engineering Research Center of Natural Antineoplastic Drugs, Ministry of Education, Harbin 150076, China
石蒜科(Amaryllidaceae)石蒜属Lycoris Herb.植物主产于亚洲,其中中国是石蒜属植物的产出大国,目前我国发现有15种石蒜属植物,主要分布于长江以南地区,尤其温热带地区数量较多[1]。研究发现石蒜属植物富含生物碱类化学成分,且石蒜属植物生物碱种类繁多、结构多样、药理活性广泛。目前发现石蒜属植物生物碱具有抗肿瘤、抗乙酰胆碱酯酶(AchE)、抗菌、抗病毒、抗疟疾等多方面药理作用。近年来,石蒜属植物生物碱的研究受到了国内外学者的广泛关注,对其药理作用的报道也屡见不鲜,但对石蒜属植物生物碱的归纳分类及其药理作用的系统性总结尚显缺乏。本文对石蒜属植物生物碱类化学成分的分类、来源、结构、药理作用等研究现状进行综述,重点总结了该属植物中生物碱的种类和药理活性方面的研究进展。
1 石蒜属植物生物碱类化学成分石蒜属植物主要分布于亚洲,产量丰富,常见的石蒜属植物有18种(表 1)[2]。生物碱类化学成分分类有多种方法,石蒜属植物生物碱按其分子骨架不同,主要分为7类:石蒜碱型(lycorine type)、文殊兰型(crinine type)、加兰他敏型(galanthamine type)、水仙花碱型(tazettine type)、水仙环素型(narciclasine type)、石蒜宁碱型(lycorenine type)或高石蒜碱型(homolycorine type)、猛他宁型(montanine type);除此之外,近年来研究发现,在石蒜属植物中又发现一些新型的石蒜碱,暂时归为其他类[3]。
| 表 1 常见的石蒜属植物 Table 1 Common plants of Lycoris Herb. |
从石蒜属植物分离得到17个石蒜碱型生物碱(图 1)。从红花石蒜[4, 5, 6, 7]、紫花石蒜[8, 9]、广西石蒜[10]、香石蒜[11]、长筒石蒜[12]中分离得到石蒜碱(lycorine,1)、从红花石蒜[6]中分离得到5,6-dehydrolycorine(2)、dihydrolycorine(3)、7-oxodihydrolycorine(4);从红花石蒜[13]、香石蒜[11, 14]中分离得到了雪花碱(galanthine,5);从红花石蒜[15]中分离得到了孤挺花宁碱(caranine,6);从红花石蒜[15]、香石蒜[11]中分离得到了ungminorine(7);从香石蒜[11]中分离得到了ungminorine N-oxide(8);从红花石蒜[16]中分离得到hippadine(9);从红花石蒜[17]、紫花石蒜[8, 9]、广西石蒜[10]中分离得到了pseudolycorine(10);从红花石蒜[17]、紫花石蒜[8]中分离得到norpluviine(11);从红花石蒜[18]中分离得到lycoranineA(12)、lycoranine B(13);从长筒石蒜[19]中分离得到 (−)-amarbellisine(14);从紫花石蒜[8]、黄花石蒜[20]中分离得到pluviine(15);从橙黄石蒜[21]中分离得到LT1(16);从香石蒜[14]中分离得到incartine(17)。
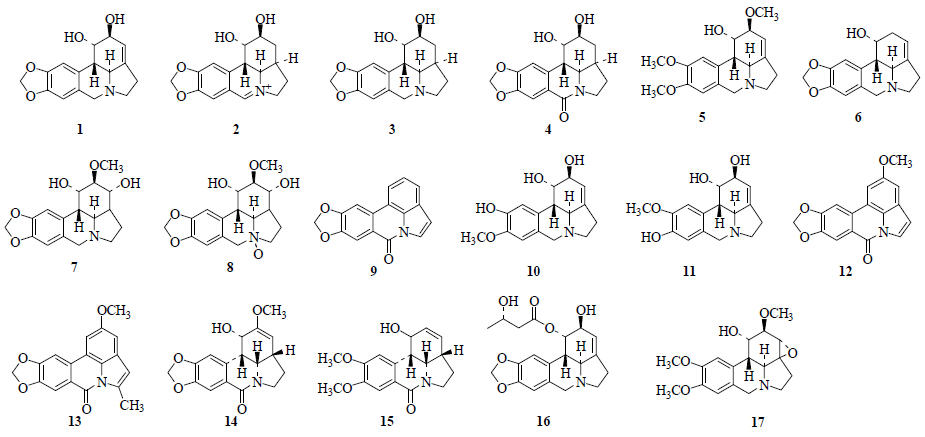 | 图 1 石蒜属植物中石蒜碱型生物碱 Fig.1 Lycorine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到14个加兰他敏型生物碱(图 2)。从红花石蒜[4, 6, 15]、长筒石蒜[19]、广西石蒜[10]、香石蒜[11]、黄花石蒜[22]、紫花石蒜[8, 9]中分离得到加兰他敏(galanthamine,18);从红花石蒜[4]、香石蒜[11]中分离得到了N-氧化加兰他敏(galanthamine N-oxide,19);从红花石蒜[4, 5, 15]、长筒石蒜[19]、紫花石蒜[8]、红石蒜[23]、广西石蒜[10]、香石蒜[11]、红石蒜[24]、黄花石蒜[25]、乳白石蒜[26]、紫花石蒜[9]中分离得到了石蒜胺(lycoramine,20);从红花石蒜[4]、乳白石蒜[26]、红石蒜[23]中分离得到了N-氧化石蒜胺(lycoramine N-oxide,21);从红花石蒜[4, 5, 13, 15]、香石蒜[11]、紫花石蒜[9]、黄花石蒜[25]中分离得到了O-去甲石蒜胺(O- demethyllycoramine,22);从红石蒜[27]、香石蒜[11]、红花石蒜[13]、紫花石蒜[9]、黄花石蒜[22]中分离得到sanguinine(23);从红石蒜[23]中分离得到sanguinine N-oxide(24);从紫花石蒜[8]中分离得到表加兰他敏(epi-galanthamine,25);从广西石蒜[10]中分离得到那维定(narwedine,26);从广西石蒜[10]、紫花石蒜[9]、黄花石蒜[22]中分离得到norgalanthamine(27);从广西石蒜[10]中分离得到N- allylnorgalanthamine(28);从红花石蒜[15]中分离得到N-demethyllycoramine(29);从红石蒜[27]中分离得到norsanguinine(30)、norbutsanguininem(31)。
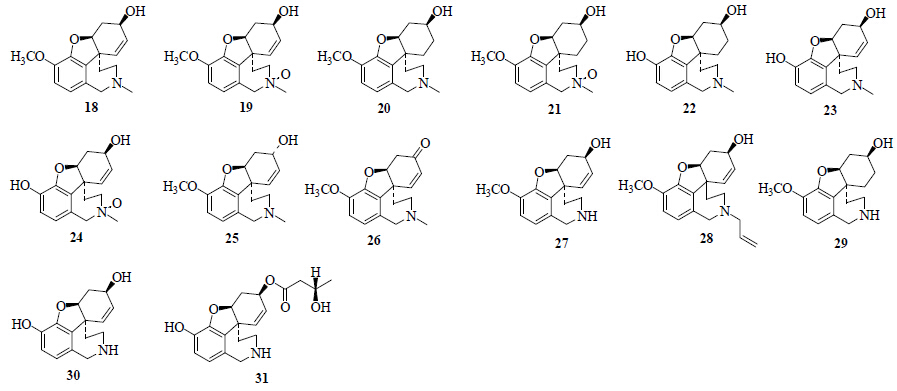 | 图 2 石蒜属植物中加兰他敏型生物碱 Fig.2 Galanthamine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到10个文殊兰型或网球花胺型生物碱(图 3)。从红花石蒜[6]中分离得到了6β-乙酰基文殊兰胺(6β-acetoxycrinamine,32);从广西石蒜[10]、长筒石蒜[12]中分离得到文殊兰碱(crinine,33);从红花石蒜[6]、长筒石蒜[19]中分离得到了6β-羟基文殊兰胺(6β-hydroxycrinamine,34);从长筒石蒜[19]中分离得到了6α-羟基文殊兰胺(6α- hydroxycrinamine,35);从红花石蒜[15]、紫花石蒜[9]、长筒石蒜[12]中分离得到了11-羟基条纹碱(11-hydroxyvittatine,36);从红花石蒜[4, 15]、紫花石蒜[9]、红石蒜[24]、白花石蒜[26]中分离得到了网球花定碱(haemanthidine,37);从红花石蒜[4, 28]、紫花石蒜[8]中分离得到了条纹碱(vittatine,38);从长筒石蒜[19]中分离得到了macowine(39);从红花石蒜[15]中分离得到了O-去甲球花胺(O-demethylhaemanthamine,40);从红花石蒜[28]、乳白石蒜[26]、紫花石蒜[9]、红石蒜[24]中分离得到了网球花胺(haemanthamin,41)。
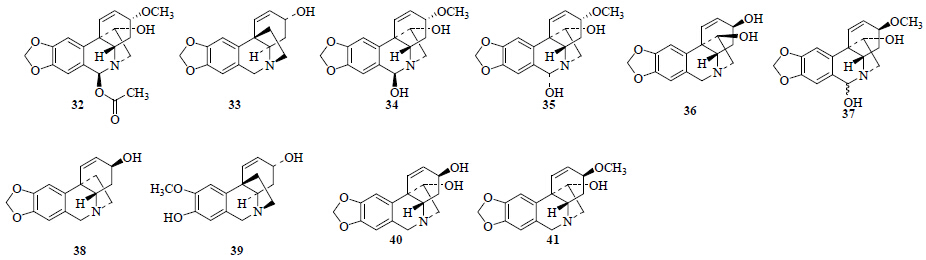 | 图 3 石蒜属植物中文殊兰型或网球花胺型生物碱 Fig.3 Crinine and haemanthidine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到4个水仙花碱型生物碱(图 4),从红花石蒜[4]、长筒石蒜[19]、紫花石蒜[8, 9]、红石蒜[24]中分离得到了水仙花碱(tazettine,42);从红石蒜[7]、红花石蒜[5]中分离得到了前多花水仙碱(pretazettine,43);从黄花石蒜[24]中分离得到了3-O-乙烷基水仙花碱醇(3-O-ethyltazettinol,44);从紫花石蒜[9]中分离得到了6-O-甲基前多花水仙碱(6-O-methyopretazettine,45)。
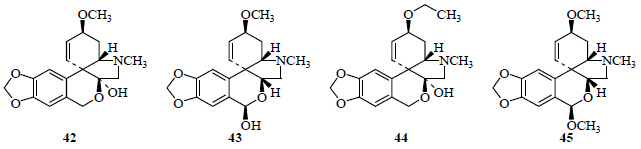 | 图 4 石蒜属植物中水仙花碱型生物碱 Fig.4 Tazettine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到13个石蒜宁碱型或高石蒜碱型生物碱(图 5)。从红花石蒜[4, 5, 6]、紫花石蒜[8]、乳白石蒜[26]中分离得到了高石蒜碱(homolycorine,46);从红花石蒜、乳白石蒜中分离得到了N-氧化高石蒜碱(homolycorine N-oxide,47)[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26]和2a-hydroxy-6-O-methoxyloduline [(5a,7a)-7-methoxy-1- methyl-9,10-[methylenebis (oxy)]-1ycorenan-5-ol](49)[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26];从红花石蒜[6]中分离得到了 (+)-8-O-acetylhomolycorine- α-N-oxide(48);从红花石蒜[4, 5, 6, 15]、紫花石蒜[8]、黄花石蒜[22]、乳白石蒜[26]中分离得到了小星蒜碱(hippeastrine,50);从红花石蒜[4, 15]、乳白石蒜[26]中分离得到了N-氧化小星蒜碱(hippeastrine N-oxide,51);从红花石蒜[4, 5, 17]、黄花石蒜[25]、白花石蒜[26]中分离得到了O-二甲基高石蒜碱(O- demethlyhomolycorine,52);从红花石蒜[5]、紫花石蒜[8]中分离得到了石蒜宁碱(lycorenine,53);从红花石蒜[4]、黄花石蒜[22]中分离得到了O-甲基石蒜宁碱(O-methyllycorenine,54);从红花石蒜中分离得到了N-氧化-O-甲基石蒜宁碱(O-methyllycorenine N-oxide,55)[4]、5-羟基-10-O-去甲高石蒜碱(5-hydroxy-10-O- demethyl-homolycorine,56)[15]、radiatine(57)[29]、不老蒜碱(ungerine,58)[15]。
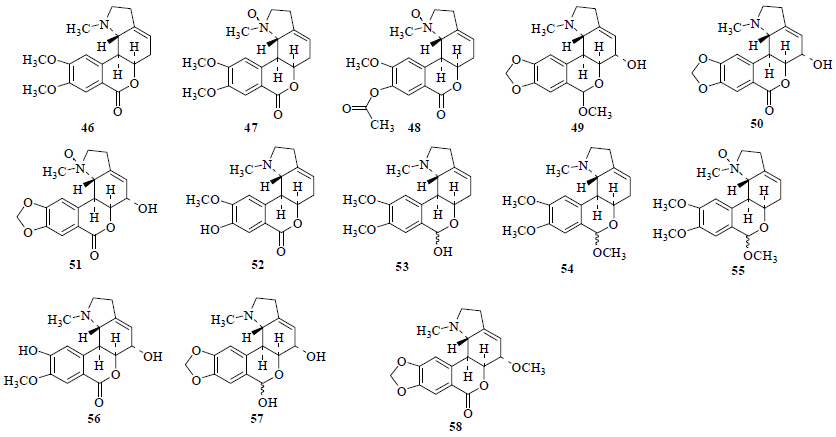 | 图 5 石蒜属植物中石蒜宁碱型或高石蒜碱型生物碱 Fig.5 Lycorenine and homolycorine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到5个水仙环素型生物碱(图 6)。从红花石蒜[15, 30]、紫花石蒜[9]、长筒石蒜[12]、乳白石蒜[26]中分离得到了水仙环素(narciclasine,59);从红花石蒜[6, 30]、紫花石蒜[9]、乳白石蒜[26]中分离得到了7-脱氧水仙环素(7-deoxynarciclasine,60);从红花石蒜[6, 13]中分离得到了三球定(trisphaeridine,61)、5,6-二氢七叶苷(5,6-dihydrobicolorine,62)、七叶苷(bicolorine)(63)。
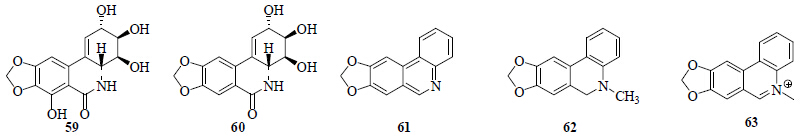 | 图 6 石蒜属植物中水仙环素型生物碱 Fig.6 Narciclasine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中分离得到3个猛他宁型生物碱(图 7),从紫花石蒜[9]中分离得到了猛他宁碱(montanine,64);从长筒石蒜[12]中分离得到了乌克兰狭叶水仙碱(nangustine,65);从紫花石蒜[9]、红花石蒜[15]、长筒石蒜[12]中分离得到了pancratinine C(66)。
 | 图 7 石蒜属植物中猛他宁型生物碱 Fig.7 Montanine type alkaloids from plants of Lycoris Herb. |
从石蒜属植物中还分离得到5种生物碱(图 8)。从红花石蒜[15]中分离得到了8-demethoxyhostasine(67);从黄花石蒜中分离得到了lycosinine A(68)[22]、lycosinine B[22](69)、海胆灵(echinulin,70)[25];从紫花石蒜[9]中分离得到了2R-hydroxy-O,N- dimethylnorbelladine(71)。
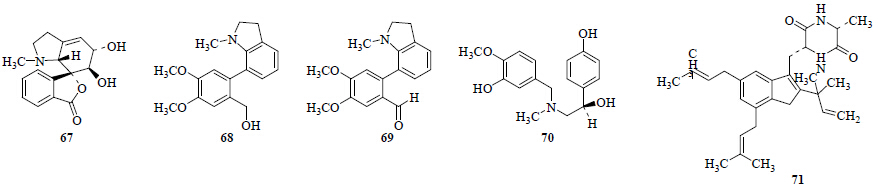 | 图 8 石蒜属植物中其他类型生物碱 Fig.8 Other type alkaloids from plants of Lycoris Herb. |
石蒜属植物生物碱类化学成分具有抗肿瘤活性,其中,石蒜碱型、文殊兰碱型生物碱抗肿瘤活性尤为显著。研究发现,石蒜碱是最早从石蒜中分离得到的石蒜碱型生物碱类单体成分,其对人乳腺癌MCF-7细胞、人早幼粒白血病HL-60细胞、转移性黑素瘤C8161细胞显示出较强的抗肿瘤活性[31]。通过对石蒜碱抗肿瘤作用机制深入研究发现,石蒜碱可以通过线粒体途径、死亡受体途径和细胞周期阻滞途径抑制肿瘤细胞增殖,在3条途径中通过触发线粒体途径诱导肿瘤细胞凋亡起主导作用[32];文殊兰碱型生物碱文殊兰碱、文殊兰胺、网球花胺具有较强的抗肿瘤活性,其中网球花胺对人宫颈癌HeLa细胞具有较强的增殖抑制活性[33];水仙环素和石蒜西定对多种人肿瘤细胞具有抑制活性[34];此外漳州水仙碱对人宫颈癌HeLa细胞、人乳腺癌MCF-7细胞和表皮癌A431细胞具有较强的增殖抑制作用,其作用强度可以和顺铂相比[35],小星蒜碱对人宫颈癌HeLa细胞具有抗肿瘤活性,而且可以抑制胶原蛋白I的侵染[31]。加兰他敏型、石蒜宁碱型生物碱的抗肿瘤活性相对较弱[31]。
2.2 抗AchE作用石蒜属植物生物碱类化学成分具有抗AchE活性,其中加兰他敏型、石蒜碱型生物碱活性最为显著。研究发现加兰他敏型生物碱加兰他敏、O-去甲加兰他敏具有抗AchE活性;加兰他敏对AchE的抑制作用表现为竞争可逆性抑制,其作用的IC50为1.9 μmol/L[36, 37, 38];石蒜碱型生物碱1-O-乙酰基石蒜碱对AchE具有显著抑制活性,其作用强度相当于加兰他敏的2倍,石蒜碱型生物碱中石蒜碱、1,2-二乙酰基石蒜碱抗AchE活性较差[39, 40]。此外研究还发现小星蒜碱对AchE显示出一定的抑制作用,其作用强度较加兰他敏稍低[41]。水仙明、6-羟基文殊兰胺也具有抗AchE活性[42, 43]。
2.3 抗菌、抗病毒作用石蒜属植物生物碱类化学成分具有抗菌活性,有学者研究发现,文殊兰碱型生物碱具有广谱抗菌活性[44],文殊兰碱对金黄色葡萄球菌具有抑制活性;文殊兰碱和ainarbellisine具有抗大肠杆菌活性;石蒜宁碱型生物碱小星蒜碱具有抗白色念珠菌的活性[45]。石蒜属植物生物碱类化学成分还具有抗病毒活性,石蒜碱型生物碱石蒜碱对流感病毒、麻疹病毒、脊髓灰质炎病毒和SARS冠状病毒具有抑制作用[46, 47];文殊兰型生物碱中网球花定、网球花胺对HIV-1病毒具有抗反转录活性,石蒜宁碱型高石蒜碱、水仙花碱型水仙碱对HIV-1病毒也具有抗反转录活性[48]。
2.4 抗疟活性石蒜属植物生物碱类化学成分具有抗疟活性,研究发现,石蒜碱型生物碱石蒜碱和文殊兰型生物碱中网球花胺对恶性疟原虫具有抗疟活性,其IC50为0.38~1.03 μg/mL[49, 50]。有学者发现,石蒜碱型生物碱LT1生物碱对恶性疟原虫具有抗疟活性,其IC50分别为K1株系为0.60 μg/mL,FCR3株系为0.45 μg/mL[51]。体外研究发现,文殊兰型生物碱中的6-羟基网球花胺、网球花胺,对恶性疟原虫也具有一定的抗疟活性。此外加兰他敏、水仙花碱抗疟活性较弱[52]。
2.5 其他作用石蒜属植物生物碱类化学成分还具有降血压作用,石蒜宁碱、加兰他敏、9-O-去甲高石蒜碱、高石蒜碱对小鼠显示出降血压作用[53]。研究发现二氢石蒜碱可以通过拮抗外周α、β受体,从而改善能量代谢,进而保护心肌细胞缺氧损伤[54]。研究发现水仙花碱型生物碱水仙花碱、石蒜碱型生物碱1-O-乙酰基石蒜碱具有一定的抗抑郁症作用[55]。小星蒜碱、montanine、布蕃君、martidine及O- methylmartidine也具有抗抑郁和抗惊厥作用[56]。
3 结语石蒜属植物作为我国传统中药材,具有分布广泛、资源丰富等特点,石蒜属植物富含大量生物碱类化学成分,随着近年来石蒜属植物生物碱类化学成分、药理作用的深入研究,生物碱的种类、数量不断增加,药理作用不断丰富,但大多数石蒜属植物生物碱类化学成分的研究还是处于起步阶段,药理作用机制还不明确,因此有必要对石蒜属植物生物碱类化学成分、药理作用机制进行深入系统的研究,为研发高效低毒的药物提供理论基础,使石蒜属植物更好地发挥其药用价值。
| [1] | 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社, 1985. |
| [2] | 令狐昱慰,李多伟.石蒜属植物的研究进展[J].亚热带植物科学, 2007, 36(2):73-76. |
| [3] | 王欢,王跃虎,陈丽娟,等.石蒜属植物生物碱成分研究进展[J].天然产物研究与开发, 2012, 24(5):691-697. |
| [4] | Kihara M, Konishi K, Xu L, et al. Alkaloidal constituents of the flowers of Lycoris radiata Herb.(Amaryllidaceae)[J]. Chem Pharm Bull, 1991, 39(7):1849-1853. |
| [5] | Kobayashi S, Yuasa K, Imakura Y, et al. Isolation of O-demethyllycoramine from bulbs of Lycoris radiata Herb.[J]. Chem Pharm Bull, 1980, 28(3):3433-3436. |
| [6] | Feng T, Wang Y Y, Su J, et al. Amaryllidaceae alkaloids from Lycoris radiata[J]. Helv Chim Acta, 2011, 94:178-183. |
| [7] | Kobayashi S, Takeda S, Ishkawa H, et al. Alkaloids of the Amaryllidaceae. A new alkaloid, sanguinine, from Lycoris sanguinea Maxim var. kiushiana Makino and pretazettine from Lycoris radiata Herb.[J]. Chem Pharm Bull, 1976, 24(5):1537-1543. |
| [8] | 洪山海,马广恩.石蒜科生物碱的研究III.紫花石蒜和其他两种石蒜中的生物碱及新生物喊紫花石蒜碱[J].药学学报, 1964, 11(1):1-14. |
| [9] | Kitajima M, Kinoshita E, Kogure N, et al. Two new alkaloids from bulbs of Lycoris squamigera[J]. Heterocycles, 2009, 77(5):1389-1396. |
| [10] | Li H Y, Ma G E, Xu Y, et al. Alkaloids of Lycoris guangxiensis[J]. Planta Med, 1987, 53(5):259-261. |
| [11] | Kihara M, Lai W, Konishi K, et al. Isolation and structure elucidation of a novel alkalooid, incartine, a supposed biosynthetic intermediate[J]. Chem Pharm Bull, 1994, 42(3):289-292. |
| [12] | 赵友谊,梁永奇,陈雨,等.长筒石蒜麟莲化学成分研究[J].中药材, 2011, 34(9):1366-1368. |
| [13] | Wang L, Yin Z Q, Cai Y, et al. Amaryllidaceae alkaloids from the bulbs of Lycoris radiata[J]. Biochem Syst Ecol, 2010, 38(3):444-446. |
| [14] | Kihara M, Xu L, Konishi K, et al. Incartine a biosynthetic intermediate, from the flowers of Lycoris incarnata[J]. Heterocycsle, 1992, 34(5):1299-1301. |
| [15] | Wang H, Wang Y H, Zhao R W. Benzylphenethylamine alkaloids from the bulbsand flowers of Lycoris[J]. Chin Herb Med, 2011, 3(1):60-63. |
| [16] | Noshita T, Miyashita H, Shimizu H, et al. Isolation of hippadine from the roots of Lycoris mdiata[J]. Nat Med, 2002, 56(4):216-218. |
| [17] | Uyeo S, Yanaihara N. Phenolic alkaloids occurring in Lycoris radiata[J]. J Chem Soc, 1959:172-177. |
| [18] | Wang L, Zhang X Q, Yin Z Q, et al. Two new Amaryllidaceae alkaloids from the bulbs of Lycoris[J]. Chem Pharm Bull, 2009, 57(6):610-611. |
| [19] | 梁永奇,冯胞,赵兴增,等.长筒石蒜麟莲中的生物碱类成分[J].天然产物研究与开发, 2010, 22(2):241-244. |
| [20] | Keck G E, Wager T T, Rodriquez J F D. Total syntheses of(-)-lycoricidine,(-)-lycoricidine, and(+)-narciclasine via 6-exo cyclizations of substituted vinyl radicals with oxime ethers[J]. J Am Chem Soc, 1999, 30(4):5176-5190. |
| [21] | Toriizuka Y, Kinoshita E, Kogure N, et al. New lycorine-type alkaloid from Lycoris traubii and evaluation of antitrypanosomal and antimalarial activities of lycorine derivatives[J]. Bioorg Med Chem, 2008, 16(24):10182-10189. |
| [22] | Yang Y, Huang S X, Zhao Y M, et al. Alkaloids from the bulbs of Lycoris awrea[J]. Helv Chim Acta, 2005, 88(9):2550-2553. |
| [23] | Kobayashi S, Satoh K, Numata A, et al. Alkaloid N-oxides from Lycoris sanguinea[J]. Phytochemistry, 1991, 30(2):675-677. |
| [24] | Takagi S, Yamaki M. On the constituents of the bulbs of Lycoris sanguinea Maxim.[J]. Yakugaku Zasshi, 1974, 94(5):617-622. |
| [25] | 杨郁.黄花石蒜、鬼针草的化学成分和生理活性研究[D].北京:中国人民解放军军事医学科学院, 2005. |
| [26] | Jitsuno M, Yokosuka A, Hashimoto K, et al. Chemical constituents of Lycoris albiflora and their cytotoxic activities[J]. Nat Prod Commun, 2011, 6(2):187-192. |
| [27] | Abdallah O. Minor alkaloids from Lycoris 5a/7gwmea[J]. Phytochemistry, 1995, 39:477-478. |
| [28] | Uyeo S, Kotera K, Okada T, et al. Occurrence of the alkaloids vittatine and haemanthamine in Lycoris radiata Herb.[J]. Chem Pharm Bull, 1966, 14(2):793-794. |
| [29] | Uyeo S, Yamato Y. The structure of radiatine, a new alkaloid occurring in Lycoris radiata Herb.[J]. Yakugaku Zasshi, 1965, 85(7):615-618. |
| [30] | Okamoto J, Torii Y, Isogai Y. Lycoricidinol and lycoricidine, new plant-growth regulators in the bulbs of Lycoris radiata Herb.[J]. Chem Pharm Bull, 1968, 16(5):1860-1864. |
| [31] | Evidente A, Kornienko A. Anticancer evaluation of structural-ly diverse amaryllidaceae alkaloids and their synthetic derivatives[J]. Phytochem Rev, 2009, 8(2):449-459. |
| [32] | Liu R F, Cao Z F, Tu J, et al. Lycorine hydrochloride inhibits metastatic melanoma cell-dominant vasculogenic mimicry[J]. Pigment Cell Melanoma Res, 2012, 25(5):630-638. |
| [33] | Evidente A, Kireev A S, Jenkins A R, et al. Biological evaluation of structurally diverse amaryllidaceae alkaloids and their synthetic derivatives:discovery of novel leads for anticancer drug design[J]. Planta Med, 2009, 75(5):501-507. |
| [34] | Ingrassia L. Amaryllidaceae isocarbostyril alkaloids and their derivatives as promising antitumor agents[J]. Translat Oncol, 2008, 1(1):1-13. |
| [35] | Zup Q I, Rethy B, Hohmann J, et al. Antitumor activity of alkaloids derived from amaryllidaceae species[J]. In Vivo, 2009, 23(1):41-48. |
| [36] | Lqpez S, Bastida J, Viladomat F, et al. Acetylcholinesterase inhibitory activity of some amaryllidaceae alkaloids and narcissus extracts[J]. Life Sci, 2002, 71(21):2521-2529. |
| [37] | Elgorashi E E. Acetycholinesterase enzyme inhibitory effects of amaryllidaceae alkaloids[J]. Planta Med, 2004, 70(3):260-262. |
| [38] | Mary A, Renko D Z, Guillou C, et al. Potent acetylcholinesterase inhibitors:design, synthesis, and structure-activity relationships of bis-interacting ligands in the galanthamine series[J]. Bioorg Med Chem, 1988, 6(10):1835-1850. |
| [39] | 宋德芳,石子琪,辛贵忠,等.石蒜科生物碱的药理作用研究进展[J].中国新药杂志, 2013, 22(13):1519-1524. |
| [40] | Mcnulty J, Nair J J, Littlej R, et al. Structure-activity studies on acetylcholinesterase inhibition in the lycorine series of Amaryllidaceae alkaloids[J]. Bioorg Med Chem Lett, 2010, 20(17):5290-5294. |
| [41] | Pagliosal B, Monteiro S C, Silva K B, et al. Effect of isoquinoline alkaloids from two Hippeastrum species on in vitro acetylcholinesterase activity[J]. Phytomedicine, 2010, 17(8/9):698-701. |
| [42] | Nair J J, Aremu A O, Van Staden J. Isolation of narciprimine from Cyrtanthus contractus(Amaryllidaceae) and evaluation of its acetylcholinesterase inhibitory activity[J]. J Ethnopharmacol, 2011, 137(3):1102-1106. |
| [43] | Adewusi E A, Fouche G, Steenkamp V. Cytotoxicity and acetylcholinesterase inhibitory activity of an isolated crinine alkaloid from Boophane disticha(Amaryllidaceae)[J]. J Ethnopharmacol, 2012, 143(2):572-578. |
| [44] | Cheesman L, Nair J J, Van Staden J. Antibacterial activity of crinane alkaloids from Boophone disticha(Amaryllidaceae)[J]. J Ethnopharmacol, 2012, 140(2):405-408. |
| [45] | Evidente A, Andolfi A, Abou-Donia A H, et al.(-)-Amarbellisine, a lycorine-type alkaloid from Amaryllis belladonna L. growing in Egypt[J]. Phytochemistry, 2004, 65(14):2113-2118. |
| [46] | Liu J N, Yang Y J, Xu Y F, et al. Lycorine reduces mortality of human enterovirus 71-infected mice by inhibiting virus replication[J]. Virol J, 2011, 8(1):483-452. |
| [47] | Li S Y. Identification of natural compounds with antiviral activities against SARS-associated coronavirus[J]. Antiviral Res, 2005, 67(1):18-23. |
| [48] | Szlavik L, Gyuris A, Minarovits J, et al. Alkaloids from Leucojum vernum and antiretroviral activity of Amaryllidaceae alkaloids[J]. Planta Med, 2004, 70(9):871-873. |
| [49] | Szlavik L. Alkaloids from Leucojum vernum and antiretroviral activity of amaryllidaceae alkaloids[J]. Planta Med, 2004, 70(9):871-873. |
| [50] | Cedron J C, Gutierrez D, Flores N, et al. Synthesis and antiplasmodial activity of lycorine derivatives[J]. Bioorg Med Chem, 2010, 18(13):4694-4701. |
| [51] | Toriizuka Y. New lycorine-type alkaloid from Lycoris traubii and evaluation of antitrypanosomal and antimalarial activities of lycorine derivatives[J]. Bioorg Med Chem, 2008, 16(3):10182-10189. |
| [52] | Sener B, Orhan I, Satayavivad J. Antimalarial activity screening of some alkaloids and the plant extracts from Amaryllidaceae[J]. Phytother Res, 2003, 17(10):1220-1223. |
| [53] | Schmeda-Hirschmann G. Activity of amaryllidaceae alkaloids on the blood pressure of normotensive rats[J]. Pharm Pharmacol Commun, 2000, 6(5):309-312. |
| [54] | 张秋芳,汪选斌,戢艳琼,等.二氢石蒜碱对过氧化氢损伤的PC12细胞的保护作用[J].中国新药杂志, 2012, 21(11):1288-1290. |
| [55] | Stafford G I, Pedersen M E, Van Staden J, et al. Review on plants with CNS-effects used in traditional South African medicine against mental disease[J]. J Ethnopharmacol, 2008, 119(3):513-537. |
| [56] | Da Silva A F, De Andrade J P, Bevilaqual R, et al. Anxiolytic-antidepressant and anticonvulsant-like effects of the alkaloid montanine isolated from Hippeastrum vittatum[J]. Pharmacol Biochem Behav, 2006, 85(1):148-154. |
 2016, Vol. 47
2016, Vol. 47


