2. 江苏康缘药业股份有限公司, 江苏连云港 222001;
3. 中国药材集团公司, 北京 100195
2. Jiangsu Kanion Pharmaceutical Co. Ltd, Lianyungang, Lianyungang, 222001, China;
3. China National Group Company of Traditional & Herbal Medicine, Beijing 100195, China
王不留行为石竹科植物麦蓝菜Vaccaria segetalis (Neck.) Garcke的干燥成熟种子[1],主产于我国的河北、山东、辽宁等地,以河北产量最大[2]。现代研究表明王不留行的成分主含黄酮苷类、三萜皂苷类化合物。它的种子具有活血通经、下乳消肿、利尿通淋的功能[3]。近年来在临床上王不留行一直作为妇科中成药的配方原料,而且有抗癌作用;王不留行的催乳作用使它成为母畜饲料的添加剂。所以,王不留行具有良好的开发利用前景,是一种很有研究价值的药用植物[4]。目前,王不留行的开发利用突飞猛进,但是王不留行常用种子繁殖,生长很慢,生物量较小,给临床使用和质量控制带来诸多困扰。
利用发根农杆菌Agrobacterium rhizogenes可对药用植物进行诱导生根,诱导得到的毛状根能够合成原植物所含的次生代谢产物,甚至得到次生代谢产物的量高于原植物。由于发根系统具有生长迅速、合成次生代谢产物能力强和遗传性状稳定等特点[5]。据不完全统计,很多药用植物都已培育成功毛状根培养体系[6],如蒙古黄芪[7]、曼陀罗[8]、人参[9]、西洋参[10]、颠茄[11]、莨菪[12]、决明[13]、丹参[14, 15]、云南萝芙木[16]、长春花[17]等毛状根已经在小规模范围内培养成功,并获得了可喜的成果。目前,国内外学者对王不留行的研究主要集中于化学成分及药理活性,而对王不留行毛状根培养的研究尚未见报道。本实验利用发根农杆菌侵染王不留行诱导得到毛状根,并利用HPLC对种子和发根中黄酮苷的量进行测定和比较,为进一步筛选适宜的王不留行毛状根培养系统并调控次生代谢产物的研究奠定基础。
1 材料与仪器 1.1 材料王不留行Vaccaria segetalis (Neck.) Garcke种子,采自吉林农业大学药用植物科技示范园,经吉林农业大学中药材学院刘霞教授鉴定。发根农杆菌菌株Agrobacterium rhizogenes R15834、R1000、R1601、A4,由中国农业微生物研究所菌种保藏中心提供。对照品王不留行黄酮苷(批号111853-201102)购于中国食品药品检定研究院。
1.2 仪器与试剂VS-840-1单人单面垂直净化工作台,SD-YX(F)3200立式双层智能精密型摇床。Waters 1525 HPLC系统(美国Waters公司),包括Waters 2487 Dual Absorbance Detector,Waters In-Line Degasser AF型在线脱气机,Waters 1525 Binary HPLC型二元泵,Waters 717型自动进样器,恒温柱箱,Breeze 色谱工作站。
2 方法 2.1 无菌苗的培养挑选当年采收色泽鲜亮干燥成熟的王不留行种子,在生物洁净工作台内,用无菌水清洗3次,75%乙醇浸泡30 s,取出后无菌水再清洗3遍,每次清洗30 s;最后用0.1% HgCl2浸泡8 min,无菌水清洗5~6次,每次清洗2~3 min,用无菌滤纸将种子表面的水吸干,将种子接种到MS固体培养基中。每天置于光照强度2 000 lx,光照/黑暗12 h/12 h,温度24~25 ℃的条件下培养。待叶片完全张开后,作为遗传转化用的外植体。
2.2 发根农杆菌的活化在无菌条件下,用接菌针挑出,接种于固体发根农杆菌培养基(YEB)平皿上划线培养,28 ℃恒温暗培养,1~2 d就可以长出单克隆菌斑,挑取单菌落,活化3次,之后接种于加有20 mL卡那霉素(50 mg/L)液体YEB培养基中,28 ℃,180 r/min震荡培养,24 h后观察,YEB液体培养基由透明的红棕色渐渐变淡,YEB液体培养基呈现出云雾状浑浊,此时说明这4种菌株已经成功复苏。但是还需对菌液进行再次活化,将成功复苏的菌液用移液枪取出1 mL加入装有50 mL液体YEB培养基的三角瓶中,于相同的条件下再次培养12 h,这时培养基中活化的菌液达到了对数生长期,可以对外植体进行侵染,结果见图 1。
2.3 毛状根的诱导在无菌环境下,将预培养的外植体(茎段、叶片)转移至已灭菌的锥形瓶中,然后将达到对数生长期的菌液倒入其中,对其进行侵染10 min。期间,轻轻地摇晃锥形瓶,让外植体和菌液充分接触,之后用无菌滤纸把外植体表面菌液完全吸干,再把吸干后的外植体接种到MS固体培养基上,于24 ℃,黑暗条件下共培养48 h,之后转接到含有环磷酰胺(CTX)(500 mg/L)的MS固体培养基上暗培养,同时以未被菌液感染的外植体作为对照(对照组其余操作均相同)。每周转接1次,多次继代直至达到完全除菌后再去掉抗生素继续培养,转至液体培养基中建立发根培养体系,见图 1。液体培养基每瓶(100 mL三角瓶)装培养液50 mL,每瓶发根的接种量约为0.5 g鲜质量,培养温度为(25±2)℃,pH为6.0左右。在摇床上培养,每处理重复3次,21 d后称取发根鲜质量,计算发根的增殖倍数。然后将发根置于40 ℃烘干至恒定质量,并保存备用。
 | 图 1 毛状根的诱导和培养 Fig.1 Induction and culture of hairy roots |
虽然可以根据毛状根形态学上的特点对其进行判断,然而这种判断可信度不高,所以采用PCR对成功诱导出来的王不留行叶片转化根进行验证,来确定转化是否成功。分析R1601菌株中质粒DNA片段是否已整合进入叶片转化根的基因组中,本实验对诱导出的毛状根和自然根进行PCR分子检测、比较。利用rol B基因引物(购于北京三博远志生物技术有限责任公司)进行PCR扩增。PCR扩增rol B序列为上游:CTCCTGACATCAAACTCGTC;下游:TGCTTCGAGTTATGGGTACA。PCR反应条件:95 ℃预变性1 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,最后72 ℃延伸10 min,共35个循环,4 ℃保存。
2.5 王不留行毛状根培养条件优化在无菌条件下,选取0.5 g生长迅速、根系发达、分支较多、除菌完全的王不留行毛状根,分别在无激素的MS、1/2 MS、R2、LS、B5、N6、改良White 7种不同液体培养基,pH为3.0、5.0、6.0、7.0、8.0、9.0的MS液体培养基、碳源质量分数为1%、3%、5%、7%、9%及种类为葡萄糖、蔗糖、D-果糖、麦芽糖的MS液体培养基进行悬浮培养。
2.6 王不留行毛状根中黄酮苷的分析 2.6.1 对照品溶液的制备精密称取王不留行黄酮苷对照品4.60 mg,置于10 mL量瓶中,先加少量甲醇溶解,然后加甲醇至刻度,振摇使混合均匀,即得对照品储备液。
2.6.2 供试品溶液的制备取王不留行种子及干燥毛状根粉碎,过四号筛,称取约1.00 g,放入到具塞三角瓶中,精密加入甲醇25 mL,超声处理30 min,放置至室温后,将上层液体滤过到25 mL容量瓶中,加甲醇补至刻度,摇匀,用0.22 μm微孔滤膜滤过,即得。
参照《中国药典》2010年版方法[1],测定王不留行种子及毛状根中王不留行黄酮苷,其中,体积流量1.0 mL/min,柱温30 ℃。
3 结果与分析 3.1 PCR检测结果R15834、R1601、R1000、A4 4种发根农杆菌所诱导的王不留行毛状根中,R1601菌株较另外3种菌株,不仅诱导率高,而且生长迅速、根系发达、分支较多。在超净工作台内将上述毛状根剪下,转接到含有500 mg/L CTX的固体培养基上,于24 ℃,黑暗条件下培养,每周转接1次到固体MS培养基上进行除菌,直到完全除菌。最后挑选根系发达、分支较多、生长迅速的毛状根,转入MS液体培养基中进行悬浮培养,得到王不留行毛状根株系,保存备用,对其进行PCR分子检测,拍照(125 V电压,20 min),结果见图 2。
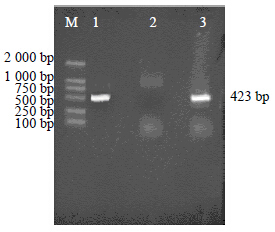 | M-Marker 1-R1601质粒DNA 2-自然根 3-叶片转化根 M-Marker 1-R1601 plasmid DNA 2-natural roots 3-conversion blade roots图 2 毛状根PCR检测结果 Fig.2 PCR results of hairy roots |
从PCR检测结果看出在叶片转化根条带(423 bp)出现了与基因引物相同的条带,自然状态生长的根(未转化)则没有出现与基因引物相同的条带,证明R1601菌株中质粒DNA片段已整合进转化根的基因组中。
3.2 王不留行液体培养基筛选液体培养基种类不同,毛状根的生长状态也不同,增殖倍数也有较大的差别。21 d后观察统计,MS液体培养基中培养的毛状根生长迅速,转化根较粗,颜色白色,根系发达,具很多细小的分枝,而且鲜质量增殖倍数最高,达到43.5倍,其他依次为R2>LS>1/2 MS>B5>N6>改良White。由此可见MS液体培养基较其他6种培养基更适合王不留行毛状根的培养。从图 3中可以看出液体培养基培养王不留行毛状根,它的生长量都随培养时间的推移而逐渐增加,毛状根的生长趋势呈缓慢上升式的“S”型曲线。在1/2 MS、R2、LS、B5、N6、改良White培养基中培养1~13 d,毛状根的生长比较缓慢,迟滞期较长;14~21 d内毛状根进入对数生长期,生长加快,根系非常发达;22 d后毛状根的生长速度变慢,开始进入稳定期,也就是生长的平台期,生长状态及质量几乎没什么变化。
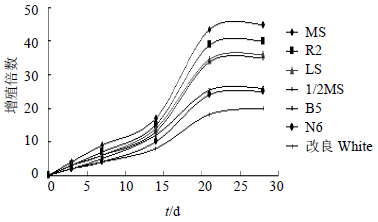 | 图 3 培养基种类对王不留行毛状根生长的影响 Fig.3 Effects of media on growth of hairy roots of V. segetalis |
培养基的pH值对发根和次生代谢产物的诱导与产生均有影响,一般认为pH值为酸性对某些农杆菌
Vir区基因有激活的作用,pH值一般在5.0~6.0时,有利于农杆菌的转化。由表 1可以看出,王不留行毛状根在不同pH值的培养基中培养,生长状况存在差异,随着pH值的升高毛状根的鲜质量随之增加;当pH值增加到6.0左右时,毛状根的鲜质量达到最大,而且生长旺盛;当pH值大于6.0时,毛状根的鲜质量开始降低,当pH值达到9.0左右时,毛状根停止生长。可能是因为在活化发根农杆菌时,当pH为6.0左右,有利于Vir区基因的激活,使毛状根快速增殖。过酸或过碱性均不适合王不留行毛状根的生长。培养王不留行毛状根的最适合培养基的pH值为6.0。
| 表 1 不同pH值对王不留行毛状根的影响 Table 1 Effects of different pH values on V. segetalis hairy roots |
如图 4所示,当以葡萄糖、蔗糖、D-果糖、麦芽糖这4种糖为碳源进行培养,毛状根的增殖倍数均随着培养基中碳源浓度的增加而增加,当这4种碳源的质量分数为3%,毛状根的增殖倍数均达到最大,都高于本碳源的其他质量分数;当碳源浓度超过3%时,随着培养基碳源浓度继续增加,毛状根增殖倍数反而降低,说明毛状根的生长受到抑制。培养基中碳源质量分数太高会抑制毛状根的生长,然而浓度低又满足不了发根对碳源的吸收需求,所以培养基中碳源质量分数既不能过高也不能过低,碳源质量分数过高过低均不利于毛状根的生长。本实验筛选出了最佳碳源为蔗糖,增殖效果最佳,增殖倍数最高,而且生长旺盛,颜色白色,其他依次为麦芽糖>D-果糖>葡萄糖,而且当蔗糖质量分数达到3%时,最适合王不留行毛状根的生长,此时毛状根的生长最旺盛,21 d后增殖倍数最高达到41倍。
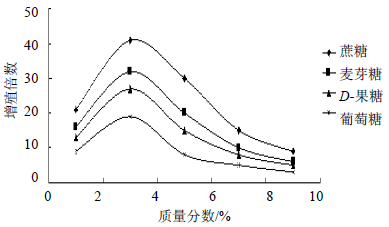 | 图 4 不同碳源及浓度对毛状根的影响 Fig.4 Effects of different carbon sources on V. segetalis hairy roots |
分别对王不留行种子和诱导成功的王不留行毛状根的黄酮苷进行测定,对照品及样品的HPLC图见图 5。
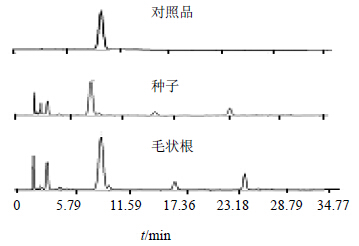 | 图 5 王不留行黄酮苷对照品及样品HPLC色谱图 Fig.5 HPLC of vaccarin reference substances and samples |
其中王不留行种子中王不留行黄酮苷质量分数为0.599%,王不留行叶片诱导的毛状根中王不留行黄酮苷质量分数为0.621%,质量分数略高于种子中的黄酮苷。测定结果符合《中国药典》2010年版规定的含王不留行黄酮苷应不少于0.40%。
4 讨论为了建立毛状根的培养体系,对各种影响因素进行试验及考察,比如发根农杆菌菌株的种类,培养基的种类,外源激素的种类及其他理化因子。
可是每种植物都有其自身的特点,每种植物毛状根最佳培养条件也是不同的,这需要进行大量的实验来验证。
有关王不留行的遗传转化目前还没有报道。该研究利用4种不同发根农杆菌转化王不留行叶片,确定发根农杆菌R1601转化王不留行叶片的诱导率高,而且生长迅速、根系发达。通过对不同培养基、不同pH值、不同碳源及碳源质量分数的筛选,确定pH值为6.0,蔗糖质量分数为3%的MS培养基培养毛状根增殖速度最快,并扩大培养获得了快速生长、多分支、多根毛的毛状根株系。用PCR对成功诱导出来的王不留行叶片转化根进行验证,叶片转化根在紫外透射仪下显示出特异性DNA片段,而未转化的王不留行自然根则没有出现同样的条带,证明R1601菌株中质粒DNA片段已整合进叶片转化根的基因组中,以提供分子生物学证据。
利用HPLC对王不留行毛状根中黄酮苷的量进行分析,其中王不留行种子中王不留行黄酮苷质量分数为0.599%,王不留行叶片诱导的毛状根中王不留行黄酮苷质量分数为0.621%,其量略高于种子中的黄酮苷。测定结果符合《中国药典》2010年版规定的王不留行黄酮苷应不少于0.40%。本实验建立王不留行毛状根培养体系,并初步测定了毛状根中的黄酮苷量,为今后筛选适宜的王不留行发根培养体系及次生代谢产物活性成分分析研究奠定了基础。
| [1] | 中国药典[S].一部. 2010. |
| [2] | Jia Z H, Koike K, Sahu N P, et al. Triterpenoid saponins from Caryophyllaceae family[J]. Studies Nat Prod, 2002, 26:3-61. |
| [3] | 贲爱玲,蔡小宁,任源浩,等.中药王不留行的组织培养技术初探[J].南京晓庄学院学报, 2006(6):54-56. |
| [4] | 李帆,梁敬钰.王不留行的研究进展[J].海峡药学, 2007, 19(3):1-5. |
| [5] | 邱德有,宋经元,马小军,等.丹参毛状根生物反应器大规模培养的研究[J].分子植物育种, 2004, 2(5):699-703. |
| [6] | 陈伟莉,牟旭鹏,刘冬影.毛状根在植物次生代谢产物生产方面应用的研究进展[J].黑河学院学报, 2010, 1(4):122-126. |
| [7] | 李雅丽,张凯.用农杆菌Ri诱导蒙古黄芪发根培养的研究[J].云南植物研究, 2005, 27(2):204-210. |
| [8] | 彭春秀,张梅,刘庆丰,等.曼陀罗毛状根的诱导及其悬浮培养合成天麻素初探[J].云南农业大学学报, 2008, 23(4):492-497. |
| [9] | 刘峻,丁家宜,徐红,等. Ri质粒人参转化系统的建立及鉴定[J].中国中药杂志, 2001, 26(2):95-99. |
| [10] | 王冲之,丁家宜.不同培养基及外源激素对西洋参毛状根的生长和皂苷含量的影响[J].植物资源与环境学报, 2001, 10(4):l-4. |
| [11] | Bonhomme V, Laurain-Mattar D, Lacoux J, et al. Tropane alkaloid production by hairy roots of Atropa belladonna obtained after transformation with Agrobacterium rhizogenes 15834 and Agrobacterium tumefaciens containing rol A, B, C genes only[J]. J Biotechnol, 2000, 81(2/3):151-158. |
| [12] | 孟超,左旭,王莉,等.唐古特山莨菪毛状根中东莨菪碱产生的研究[J].天然产物研究与开发, 2002, 14(1):21-24. |
| [13] | 杨世海,刘晓峰,果德安,等.决明毛状根诱导及激素与诱导子对毛状根生长和蒽醌类化合物合成的影响[J].中草药, 2005, 36(5):752-756. |
| [14] | 冯珂.丹参毛状根培养体系建立及诱导子的作用研究[D].杨凌:西北农林科技大学, 2010. |
| [15] | 盛东峰,陈龙.聚乙二醇-6000胁迫对丹参毛状根中丹参酮积累的影响[J].中草药, 2013, 44(9):1181-1185. |
| [16] | 王泓,廖志华,田桂香,等.发根农杆菌介导云南萝芙木的遗传转化[J].西南师范大学学报:自然科学版, 2006, 31(2):137-141. |
| [17] | 孙敏,汪洪,王颖.长春花转化毛状根诱导及培养条件的优化[J].西南师范大学学报:自然科学版, 2002, 27(4):549-552. |
 2016, Vol. 47
2016, Vol. 47


