2. 南京中医药大学中药复方分离工程重点实验室, 江苏南京 210029;
3. 南京中医药大学第一临床医学院, 江苏南京 210046;
4. 南京中医药大学江苏省中医药防治肿瘤协同创新中心, 江苏南京 210023
2. Key Laboratory of Separation Engineering for Chinese Medicine Compound, Nanjing University of Chinese Medicine, Nanjing 210029, China;
3. The First Clinical Medical College, Nanjing University of Chinese Medicine, Nanjing 210046, China;
4. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
《本草纲目》中记载虫类药大多具有活血化瘀、通经疏络之功效。现代研究表明,发挥此类药理作用的物质多为蛋白质或多肽,如地鳖溶纤蛋白[1]、全蝎酶解抗凝多肽[2]、单环刺螠纤溶酶[3]等。在动物药的组成中,蛋白质所占比例非常大,如蛇毒内的蛋白质质量分数为90%[4],蜈蚣体内的蛋白质质量分数为60%~70%[5],鹿血中的蛋白质质量分数为70%~80%,而蚂蚁中的蛋白质质量分数也有42%~67%。从全蝎体内提取得到的全蝎酶解抗凝多肽[2]具有抗惊厥、抗癫痫和镇痛镇静的作用,现代研究表明尚可用于肿瘤等恶性疾病的治疗[6, 7];从地龙中提取的蚓激酶具有溶解纤维蛋白作用[8, 9, 10]。从天然药物中分离纯化出具有高纤维蛋白特异性的纤溶酶成了目前研究热点之一。
本课题组已经成功从中药鼠妇Armadillidium vulgare Latreille中分离出鼠妇纤溶酶,其相对分子质量为3.849×104,前期对其酶学性质研究发现[11],鼠妇纤溶酶的最适反应温度为40 ℃,最适反应pH值为7.0;对甲苯磺酰-L-赖氨酰氯甲酮(TLCK)、乙二胺四乙酸(EDTA)、乙二醇二乙醚二胺四乙酸(EGTA)、苯甲基磺酞氟(PMSF)抑制作用相对较弱,剩余纤溶酶活力均高于75%,而aprotinin、pepstain A对鼠妇纤溶酶纤溶活性则完全抑制;而且其口服有效。
为使其发挥更广泛的用途,本实验通过模拟胃肠环境对鼠妇活性粗蛋白进行酶解后再分离而获得相对分子质量更小、效价更高的蛋白或多肽。胃蛋白酶和胰蛋白酶是酶解提取法中常用的2种蛋白酶。胃蛋白酶(pepsin)属于天冬氨酸蛋白水解酶类,是胃消化蛋白水解酶,相对分子质量为3.1×104~3.6×104[12],其前体是胃蛋白酶原。胰蛋白酶(trypsin)为蛋白酶的一种,相对分子质量小于2.4×104[13],是从牛、羊、猪的胰脏中提取的一种丝氨酸蛋白水解酶[13]。在蛋白质组学分析中,胰蛋白酶是应用最多的蛋白酶,由于许多蛋白质富含赖氨酸和精氨酸,因而经胰蛋白酶作用之后得到的片段很适合用于质谱分析蛋白质的氨基酸排列[14]。
据文献报道[15, 16],胃蛋白酶和胰蛋白酶都具有纤溶活性,而对于如何有效地使这2种蛋白酶纤溶活性完全失活缺乏系统研究和文献报道,本实验的聚集点在于如何在保证酶解产物纤溶活性的基础上有效地使上述2种蛋白酶完全失活。本实验在前期鼠妇纤溶酶的酶学性质研究的基础上分别探讨:①pH值、温度、金属离子、酶抑制剂和表面活性剂[17, 18, 19, 20, 21]对模拟胃肠环境中胃蛋白酶和胰蛋白酶纤溶活性的影响,并获取较佳的酶失活工艺;②较佳酶失活工艺对尿激酶、蚓激酶和鼠妇纤溶酶的纤溶活性的影响,希望得出最优失活方案,即在保持尿激酶、蚓激酶和鼠妇纤溶酶最大稳定性的前提下使胃蛋白酶和胰蛋白酶的纤溶活性有效失活。
1 仪器与材料BFM-T6BI贝利超微粉碎机,济南倍力粉体技术工程有限公司;Allegra 64R Centrifμge高速冷冻离心机,美国贝克曼库尔特有限公司;HH-1恒温水浴锅,常州国华电器有限公司;LRSH-150-III恒温恒湿培养箱,上海跃进医疗器械有限公司;Centrivap型抗酸型冷冻离心浓缩仪,美国Labconco公司。
牛血清纤维蛋白原(批号BJ0624YA13)、凝血酶(批号XJ0719XA13),上海源叶生物科技有限公司;琼脂糖(批号20131121),国药集团化学试剂有限公司;硫酸铵(批号1302151),西陇化工股份有限公司;胃蛋白酶(批号313A0313)、胰蛋白酶(批号112B1220),Solarbio公司;尿激酶标准品(批号140607)、蚓激酶标准品(批号140736),中国食品药品检定研究院。
人工胃液:取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g,摇匀后,加水稀释至1 L,即为人工胃液[22]。记为W液(10.0 mg/mL)。
人工肠液:取磷酸二氢钾(KH2PO4)6.8 g,加水500 mL使溶解,用0.1 mol/L的氢氧化钠调节pH值至6.8,另取胰蛋白酶10 g加水适量溶解,2种溶液混合后,加水稀释至1 L,即为人工肠液[22]。记为Y液(10.0 mg/mL)。
2 方法与结果 2.1 W液中胃蛋白酶和Y液中胰蛋白酶纤溶活性的影响因素 2.1.1 剩余酶相对纤溶活性的测定按照Astrup的纤维蛋白平板法[23](稍有改进),制备纤维蛋白平板:牛血清纤维蛋白原、凝血酶用PBS缓冲液(pH 7.8)溶解,先配制1.0%的琼脂糖20 mL煮沸,冷却至50~60 ℃,向其中加入5 mg/mL牛血清纤维蛋白原溶液10 mL及10 U/mL的凝血酶1 mL迅速摇匀,倒入培养皿中,室温静置使其充分凝固,并在其上打出若干直径约为2 mm的小孔。分别加入10 μL经各种因素处理的W液(Y液)或10 μL W液(Y液)。放入37 ℃恒温培养箱中,18 h后测量纤维平板溶圈半径(mm)大小。通过测量溶圈半径,计算溶圈面积(mm2),通过溶圈面积大小来反映纤溶活性强弱。
剩余酶相对纤溶活性=经各种因素处理的W液(Y液)的溶圈面积/W液(Y液)的溶圈面积
2.1.2 pH值对胃蛋白酶和胰蛋白酶纤溶活性的影响分别配制如下缓冲液:0.1 mol/L NaAc-HCl(pH 1.0~2.0)、0.1 mol/L CH3COONH4-HCl(pH 3.0~6.0)、0.1 mol/L Tris-HCl(pH 7.0~8.0)、0.1 mol/L glycine-NaOH(pH 9.0~12.0)、0.1 mol/L Na2HPO4(pH 13.0),分别向各缓冲液中加入Y液或W液适量(Y液或W液-pH缓冲液1∶10),充分混合37 ℃孵化60 min后各取10 μL分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 1)。剩余胃蛋白酶或胰蛋白酶在不同pH值中相对纤溶活性结果见表 1。
分别以W液(pH 1.5)作为胃蛋白酶的空白对照和Y液(pH 6.8)作为胰蛋白酶的空白对照,由图 1-a和表 1可以看出,胃蛋白酶在不同的pH值环境中,溶圈面积大小差异明显,表明pH值对于胃蛋白酶的纤溶活性有较显著影响,在pH 1.5时,溶圈是最大的;pH 6.0~8.0,溶圈无变化,以及剩余酶相对活性接近0,结果表明pH值在这个范围内,胃蛋白酶已有效失活。由图 1-b和表 1可以看出,胰蛋白酶在pH 6.8时,溶圈是最大的,在pH 1.0~13.0,溶圈是有变化的,在pH 2.0~4.0的剩余酶相对活性已降到22%以下,提示pH值的改变并不能使胰蛋白酶完全失活。推测可能是由于各自不同的酶学性质决定胃蛋白酶和胰蛋白酶在不同pH值环境中的纤溶活性存在差异。
| 表 1 胃蛋白酶和胰蛋白酶在不同pH 值中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 1 Relative fibrinolytic activity of pepsin and trypsin in different pH values $\left( {\bar x \pm s,n = 5} \right)$ |
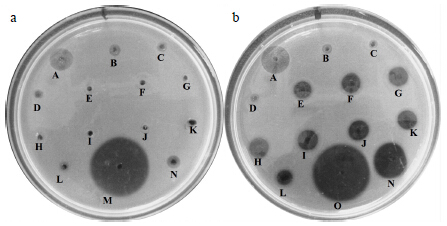 | A-pH 1.0 B-pH 2.0 C-pH 3.0 D-pH 4.0 E-pH 5.0 F-pH 6.0 G-pH 7.0 H-pH 8.0 I-pH 9.0 J-pH 10.0 K-pH 11.0 L-pH 12.0 N-pH 13.0 M-pH 1.5 O-pH 6.8图 1 胃蛋白酶 (a) 和胰蛋白酶 (b) 在不同pH 值中纤溶活性 Fig.1 Fibrinolytic activity of pepsin (a) and trypsin (b) in different pH values |
重复性试验:取同样以上缓冲液(Y液或W液-pH缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.5%,表明该方法重复性好。
2.1.3 温度对胃蛋白酶和胰蛋白酶纤溶活性的影响取Y液或W液适量分别置于10、20、30、40、50、60、70、80、90、100 ℃的恒温水浴中保温0.8 h后各取10 μL,分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 2)。剩余胃蛋白酶或胰蛋白酶在不同温度中相对活性结果见表 2。
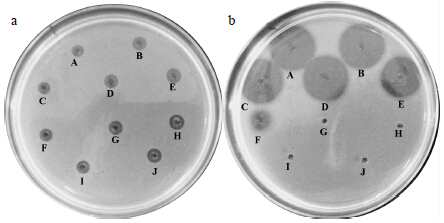 | A-10 ℃ B-20 ℃ C-30 ℃ D-40 ℃ E-50 ℃ F-60 ℃ G-70 ℃ H-80 ℃ I-90 ℃ J-100 ℃图 2 胃蛋白酶 (a) 和胰蛋白酶 (b) 在不同温度中纤溶活性 Fig.2 Fibrinolytic activity of pepsin (a) and trypsin (b) in different temperatures |
| 表 2 胃蛋白酶和胰蛋白酶在不同温度中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 2 Relative fibrinolytic activity of pepsin and trypsin in different temperatures $\left( {\bar x \pm s,n = 5} \right)$ |
以20 ℃(常温)作为胃蛋白酶和胰蛋白酶空白对照,由图 2-a和表 2可以看出,在10~100 ℃,胃蛋白酶溶圈面积大小差异不显著,其剩余酶相对活性在(96.52±1.42)%~(101.07±0.24)%,提示温度对于胃蛋白酶纤溶活性基本无影响,且在10~100 ℃无法完全失活,推测可能原因为人工胃液中的胃蛋白酶在较高温度下发生水解产生具有纤溶活性的小分子肽。由图 2-b和表 2可以看出,胰蛋白酶溶圈面积大小差异明显,在10~40 ℃溶圈面积随着温度升高而逐渐增大,其剩余酶相对活性从(98.83±0.95)%逐渐上升至(100.07±0.99)%,提示胰蛋白酶的纤溶活性越来越强,推测其原因是正常人体体温范围是36.0~37.5 ℃,正好处在胰蛋白酶纤溶活性较强的温度范围内[18],说明肠液中胰蛋白酶在正常人体中纤溶活性较强;在50 ℃以上时,溶圈面积越来越小,其剩余酶相对活性急剧下降;在70 ℃以上时,无溶圈出现,其剩余酶相对活性接近0,表明温度对于胰蛋白酶的纤溶活性有较为显著的影响。
重复性试验:取同样以上缓冲液(不同温度)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.2%,表明该方法重复性好。
2.1.4 金属离子对胃蛋白酶和胰蛋白酶纤溶活性的影响用20 mmol/L Tris-HCl(pH 7.2)缓冲液分别配制0.1 mol/L CuSO4·5H2O、MnSO4·H2O、MgSO4·7H2O、FeSO4·7H2O、CaCl2、ZnCl2、NaCl、KCl、AlCl3、FeCl3·6H2O、BaCl2·2H2O金属离子溶液。分别向各金属离子溶液中加入Y液或W液适量(Y液或W液-金属离子缓冲液1∶10),充分混合37 ℃孵化60 min后各取10 μL分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 3)。剩余胃蛋白酶或胰蛋白酶相对活性结果见表 3。
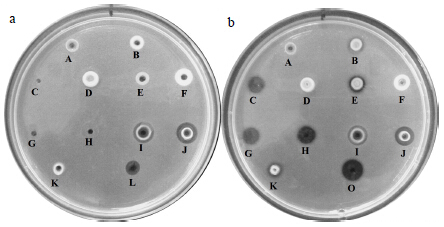 | A-CuSO4·5H2O B-MnSO4·H2O C-MgSO4·7H2O D-FeSO4·7H2O E-CaCl2 F-ZnCl2 G-NaCl H-KCl I-AlCl3 J-FeCl3·6H2O K-BaCl2·2H2O L-W solution O-Y solution图 3 胃蛋白酶 (a) 和胰蛋白酶 (b) 在不同金属离子中纤溶活性 Fig.3 Fibrinolytic activity of pepsin (a) and trypsin (b) in different metal ions |
| 表 3 胃蛋白酶和胰蛋白酶在不同金属离子中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 3 Relative fibrinolytic activity of pepsin and trypsin in different metal ions $\left( {\bar x \pm s,n = 5} \right)$ |
以W液作为胃蛋白酶的空白对照,以Y液作为胰蛋白酶的空白对照,由图 3-a和表 3可以看出,不同的金属离子环境下,溶圈面积大小差异明显,在0.1 mol/L Mg2+、K+、Na+环境中,无溶圈出现,其剩余酶相对活性接近0,提示胃蛋白酶的活性已有效失活,由此可推测在较大量服用Mg2+、K+、Na+时,胃液中胃蛋白酶的纤溶活性可以有效失活。由图 3-b和表 3可以看出,溶圈面积大小差异不明显,其剩余酶相对活性都在36%以上,表明金属离子对于胰蛋白酶的纤溶活性无显著影响,提示胰蛋白酶无法完全失活,这可能由于肠液中复杂的环境和胰蛋白酶的酶学性质决定。
重复性试验:取同样以上缓冲液(Y液或W液-金属离子缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.3%,表明该方法重复性好。
2.1.5 酶抑制剂和表面活性剂对胃蛋白酶和胰蛋白酶纤溶活性的影响本实验采用10种不同的蛋白酶抑制剂和2种表面活性剂[16, 17, 18, 19, 20],分别如下:苯甲基磺酞氟(PMSF)、对甲苯磺酰-L-赖氨酰氯甲酮(TLCK)、对甲苯磺酰-L-苯丙氨酰氯甲酮(TPCK)、乙二胺四乙酸(EDTA)、乙二醇二乙醚二胺四乙酸(EGTA)、β-巯基乙醇(β-mercaptoethanol)、胃酶抑素A(pepstain A)、大豆胰蛋白酶抑制剂(KTI,主要对胰蛋白酶直接且专一性起作用)、大豆蛋白酶抑制剂(SBTI,主要是抑制胰蛋白酶的活性)、抑肽酶(aprotinin)和失水山梨醇单油酸酯聚氧乙烯醚(Tween 80,是一种表面活性剂)、十二烷基硫酸钠(SDS)。用20 mmol/L Tris-HCl(pH 7.2)缓冲液分别配制相应溶液(浓度配制依据:根据预试验、各试剂的溶解度和相关报道[16, 17, 18, 19, 20],表 4)。
| 表 4 各酶抑制剂和表面活性剂配制的溶液浓度 Table 4 Each enzyme inhibitor and surfactant in different formulating concentration |
分别向各酶抑制剂和表面活性剂的溶液中加入Y液或W液适量(Y液或W液-酶抑制剂和表面活性剂缓冲液1∶10),充分混合37 ℃孵化60 min后各取10 μL分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 4、5)。剩余胃蛋白酶或胰蛋白酶相对活性结果见表 5、6。
 | A-pepstain A B-KTI C-SBTI D-aprotinin E-Tween 80 F-SDS G-PMSF H-TLCK I-TPCK J-EGTA L-EDTA M-β-mercaptoethanol 1→6溶液浓度递增(外圈→内圈溶液浓度递增) 7-W液 1→6 solution concentration increase progressively (outer→inside) 7-W solution图 4 胃蛋白酶在不同酶抑制剂和表面活性剂中纤溶活性 Fig.4 Fibrinolytic activity of pepsin in different enzyme inhibitors and surfactants |
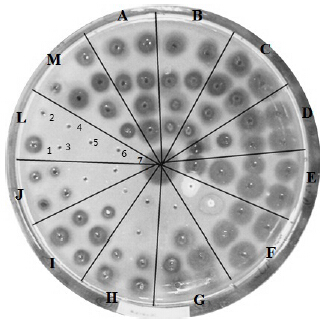 | A-pepstain A B-KTI C-SBTI D-aprotinin E-Tween 80 F-SDS G-PMSF H-TLCK I-TPCK J-EGTA L-EDTA M-β-mercaptoethanol 1→6溶液浓度递增(外圈→内圈溶液浓度递增) 7-Y液 1→6 solution concentration increase progressively (outer→inside) 7-Y solution图 5 胰蛋白酶在不同酶抑制剂和表面活性剂中纤溶活性 Fig.5 Fibrinolytic activity of trypsin in different enzyme inhibitors and surfactants |
| 表 5 胃蛋白酶在不同酶抑制剂和表面活性剂中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 5 Relative fibrinolytic activity of pepsin in different enzyme inhibitors and surfactants $\left( {\bar x \pm s,n = 5} \right)$ |
| 表 6 胰蛋白酶在不同酶抑制剂和表面活性剂中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 6 Relative fibrinolytic activity of trypsin in different enzyme inhibitors and surfactants $\left( {\bar x \pm s,n = 5} \right)$ |
以W液作为胃蛋白酶的空白对照,从图 4和表 5可以看出,在不同浓度酶抑制剂和表面活性剂的环境下,溶圈面积大小差异明显,随着浓度的增大,大部分的溶圈面积有减小的趋势,其剩余酶相对活
性总体也呈现下降趋势,表明酶抑制剂和表面活性剂的浓度对于胃蛋白酶的纤溶活性有较为显著影响。尤其在PMSF、TLCK、TPCK、EDTA、EGTA各浓度下,溶圈面积大小差异显著,在EGTA达到50 mmol/L时,溶圈无变化,其剩余酶相对活性为0,表明胃蛋白酶的纤溶活性已经有效失活,这可能与胃蛋白酶长期处在胃液中有紧密的关系。
重复性试验:取同样以上缓冲液(W液-酶抑制剂和表面活性剂缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明该方法重复性好。
以Y液作为胰蛋白酶的空白对照,从图 5和表 6可以看出,在不同浓度酶抑制剂和表面活性剂的环境下,溶圈面积大小差异明显,随着浓度的增大,大部分的溶圈面积有减小的趋势,其剩余酶相对活性总体也呈现下降趋势,提示酶抑制剂和表面活性剂的浓度对于胰蛋白酶的纤溶活性有较为显著影响。尤其在PMSF、TLCK、TPCK、EDTA、EGTA各浓度下溶圈面积大小差异更显著,在PMSF浓度达到100 mmol/L;TLCK质量浓度达到25 mg/mL以上;TPCK质量浓度达50 mg/mL;EGTA浓度达到20 mmol/L以上;EDTA浓度达到1 mmol/L以上;以上酶抑制剂的浓度时无溶圈,其剩余酶相对活性均为0,提示胰蛋白酶活性已经失活,推测可能与上述酶抑制剂的特殊分子结构以及胰蛋白酶的酶学性质有关。
重复性试验:取同样以上缓冲液(Y液-酶抑制剂和表面活性剂缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.4%,表明该方法重复性好。
综上所述,成功获取了较佳的酶失活工艺,对于胃蛋白酶:可以在pH 6~8,Mg2+、Na+、K+环境中有效失活;对于胰蛋白酶:可以在PMSF浓度达到100 mmol/L;TLCK质量浓度达到25 mg/mL以上;TPCK质量浓度达50 mg/mL;EGTA浓度达到20 mmol/L以上;EDTA浓度达到1 mmol/L以上时有效失活。
2.2 较佳酶失活工艺对尿激酶、蚓激酶和鼠妇纤溶酶纤溶活性的影响为使上述较佳的酶失活工艺能应用推广于目前常用的其他纤溶酶,如尿激酶、蚓激酶等,以及本课题组发现的鼠妇纤溶酶;并寻找最优失活方案,即在保持尿激酶、蚓激酶和鼠妇纤溶酶最大稳定性的前提下,让胃蛋白酶和胰蛋白酶有效失活,进一步研究了较佳酶失活工艺对尿激酶、蚓激酶和鼠妇纤溶酶的纤溶活性的影响。
根据图 1-a、3-a、4、5所示结果,分别配制0.1 mol/L Tris-HCl(pH 6~8),0.1 mol/L MgSO4∙7H2O、NaCl、KCl;50、25 mg/mL TPCK,50、25 mg/mL TLCK,50、20、10、5、1 mmol/L EDTA,50、20、10、5、1 mmol/L EGTA,100 mmol/L PMSF溶液,分别向以上溶液中加入尿激酶液(10.0 mg/mL)、蚓激酶液(10.0 mg/mL)、鼠妇纤溶酶液(10.0 mg/mL)适量(尿激酶液或蚓激酶液或鼠妇纤溶酶液-以上缓冲液1∶10),充分混合37 ℃孵化60 min后各取10 μL分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 6~8)。剩余尿激酶或蚓激酶或鼠妇纤溶酶相对活性结果见表 7。
2.2.1 对尿激酶纤溶活性的影响以尿激酶作为空白对照,由图 6和表 7可以看出,尿激酶在较佳酶失活工艺中,所呈现的溶圈面积存在差异,其剩余酶的相对活性同样有差异,说明在以上不同的缓冲液中其纤溶活性强弱不一致。pH 6~8,Mg2+、Na+、K+、EDTA和EGTA对其活性影响不是很显著;TPCK和TLCK对其活性影响明显,当TPCK和TLCK质量浓度达到50 mg/mL时,其剩余酶的相对活性基本维持在1.5%以下,在其他缓冲液中其剩余酶的相对活性均维持在85%以上(除了在PMSF中剩余酶的相对活性维持在67%)。这可能与TPCK和TLCK特殊的分子结构有关。可以推测:如果尿激酶口服,针对胃蛋白酶的失活建议在中性环境下或者在Mg2+、Na+、K+中,尽量不要在TPCK和TLCK环境中;针对胰蛋白酶的失活建议在EDTA、EGTA、PMSF中,尽量不要在TPCK和TLCK环境中。
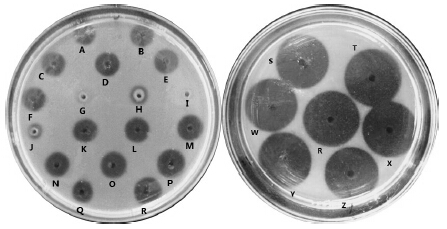 | A-pH 6 Tris-HCl B-pH 7 Tris-HCl C-pH 8 Tris-HCl D-MgSO4·7H2O E-NaCl F-KCl G-50 mg/mL TPCK H-25 mg/mL TPCK I-50 mg/mL TLCK J-25 mg/mL TLCK K-50 mmol/L EDTA L-20 mmol/L EDTA M-10 mmol/L EDTA N-50 mmol/L EGTA O-20 mmol/L EGTA P-10 mmol/L EGTA Q-100 mmol/L PMSF R-urokinase W-1 mmol/L EGTA S-5 mmol/L EGTA T-10 mmol/L EGTA X-10 mmol/L EDTA Y-1 mmol/L EDTA Z-5 mmol/L EDTA图 6 尿激酶在不同溶液中纤溶活性 Fig.6 Fibrinolytic activity of urokinase in different solutions |
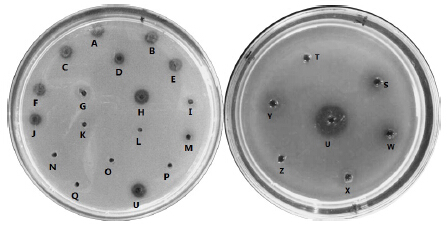 | A-pH 6 Tris-HCl B-pH 7 Tris-HCl C-pH 8 Tris-HCl D-MgSO4·7H2O E-NaCl F-KCl G-50 mg/mL TPCK H-25 mg/mL TPCK I-50 mg/mL TLCK J-25 mg/mL TLCK K-50 mmol/L EDTA L-20 mmol/L EDTA M-10 mmol/L EDTA N-50 mmol/L EGTA O-20 mmol/L EGTA P-10 mmol/L EGTA Q-100 mmol/L PMSF U-lumbrokinase W-1 mmol/L EGTA S-5 mmol/L EGTA T-10 mmol/L EGTA X-10 mmol/L EDTA Y-1 mmol/L EDTA Z-5 mmol/L EDTA图 7 蚓激酶在不同溶液中纤溶活性 Fig.7 Fibrinolytic activity of lumbrokinase in different solutions |
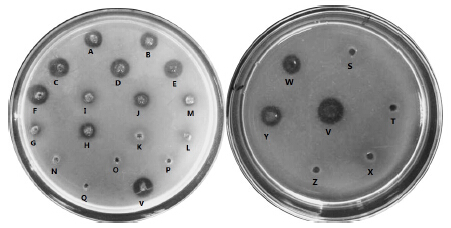 | A-pH 6 Tris-HCl B-pH 7 Tris-HCl C-pH 8 Tris-HCl D-MgSO4·7H2O E-NaCl F-KCl G-50 mg/mL TPCK H-25 mg/mL TPCK I-50 mg/mL TLCK J-25 mg/mL TLCK K-50 mmol/L EDTA L-20 mmol/L EDTA M-10 mmol/L EDTA N-50 mmol/L EGTA O-20 mmol/L EGTA P-10 mmol/L EGTA Q-100 mmol/L PMSF V-porcellio plasmin W-1 mmol/L EGTA S-5 mmol/L EGTA T-10 mmol/L EGTA X-10 mmol/L EDTA Y-1 mmol/L EDTA Z-5 mmol/L EDTA图 8 鼠妇纤溶酶在不同溶液中纤溶活性 Fig.8 Fibrinolytic activity of porcellio plasmin in different solutions |
| 表 7 尿激酶、蚓激酶、鼠妇纤溶酶在不同溶液中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 7 Relative fibrinolytic activity of urokinase,lumbrokinase,and porcellio plasmin in different solutions $\left( {\bar x \pm s,n = 5} \right)$ |
稳定性试验:取同样以上缓冲液(尿激酶液-缓冲液1∶10),精密吸取10 μL,分别于0、2、6、9、14、18、24 h点样于纤维蛋白平板的孔中,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明以上缓冲液24 h内稳定。
重复性试验:取同样以上缓冲液(尿激酶液-缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明该方法重复性好。
2.2.2 对蚓激酶纤溶活性的影响以蚓激酶作为空白对照,由图 7和表 7可以看出,蚓激酶在较佳酶失活工艺中,所呈现的溶圈面积存在显著差异。尤其是TPCK和TLCK达到50 mg/mL时,EDTA、EGTA浓度达到1 mmol/L以上时和PMSF浓度达到100 mmol/L时对其活性影响很大,基本上无溶圈出现,其剩余酶的相对活性为0,说明其活性完全失活;在pH 6、8,Mg2+、Na+、K+溶液中以及在TPCK和TLCK质量浓度达到25 mg/mL时,溶圈面积较大(相对尿激酶的溶圈面积),其剩余酶的相对活性基本维持在80%以上,说明对其活性影响较小。可以推测,如果蚓激酶口服,针对胃蛋白酶的失活建议在中性环境下或者在Mg2+、Na+、K+中;针对胰蛋白酶的失活建议在TLCK质量浓度为25 mg/mL环境中。
稳定性试验:取同样以上缓冲液(蚓激酶液-缓冲液1∶10),精密吸取10 μL,分别于0、2、6、9、14、18、24 h点样于纤维蛋白平板的孔中,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明以上缓冲液24 h内稳定。
重复性试验:取同样以上缓冲液(蚓激酶液-缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明该方法重复性好。
2.2.3 对鼠妇纤溶酶纤溶活性的影响以鼠妇纤溶酶作为空白对照,由图 8和表 7可以看出,较佳酶失活工艺对于鼠妇纤溶酶纤溶活性的影响有差异性,在TPCK和TLCK达到25 mg/mL时,EDTA和EGTA达到1 mmol/L时以及在pH 6~8,Mg2+、Na+、K+中溶圈面积较大(相对于鼠妇纤溶酶的溶圈面积),其剩余酶的相对活性均维持在75%以上;在其他浓度的缓冲液中,溶圈变化不显著,其剩余酶的相对活性基本维持在30%以下。可以推测,在保持鼠妇纤溶酶最大稳定性的前提下让胃蛋白酶和胰蛋白酶有效失活的最优失活方案,即胃蛋白酶活性完全失活可以在pH 6~8,Mg2+、Na+、K+环境中;胰蛋白酶活性完全失活可以在TLCK质量浓度为25 mg/mL和EDTA浓度为1 mmol/L。
稳定性试验:取同样以上缓冲液(鼠妇纤溶酶液-缓冲液1∶10),精密吸取10 μL,分别于0、2、6、9、14、18、24 h点样于纤维蛋白平板的孔中,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明以上缓冲液24 h内稳定。
重复性试验:取同样以上缓冲液(鼠妇纤溶酶液-缓冲液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.0%,表明该方法重复性好。
综上所述,得出了胃蛋白酶最优失活方案即在保持尿激酶、蚓激酶和鼠妇纤溶酶最大稳定性的前提下让胃蛋白酶有效失活,即pH 6.0~8.0;质量浓度为25 mg/mL TLCK和浓度为1 mmol/L EDTA是比较适合胰蛋白酶失活的较好条件,如果单一制剂,1 mmol/L EDTA对尿激酶和鼠妇纤溶酶的活性影响较小,但对蚓激酶活性影响较大;25 mg/mL TLCK对蚓激酶和鼠妇纤溶酶的活性影响较小,但对尿激酶活性影响较大;所以需要进一步验证质量浓度为25 mg/mL TLCK和浓度为1 mmol/L EDTA的混合制剂对蚓激酶、尿激酶、鼠妇纤溶酶和胰蛋白酶活性的影响。
2.3 混合制剂对尿激酶、胰蛋白酶、蚓激酶和鼠妇纤溶酶的纤溶活性的影响配制质量浓度为25 mg/mL TLCK和浓度为1 mmol/L EDTA的混合制剂溶液,分别向混合制剂溶液中加入尿激酶液(10.0 mg/mL)、蚓激酶液(10.0 mg/mL)、鼠妇纤溶酶液(10.0 mg/mL)、Y液(10.0 mg/mL)适量(尿激酶液或蚓激酶液或鼠妇纤溶酶液或Y液-混合制剂液1∶10),充分混合37 ℃孵化60 min后各取10 μL分别点样于纤维蛋白平板的孔中,37 ℃保温,18 h后比较溶圈半径大小(图 9)。剩余尿激酶、蚓激酶、鼠妇纤溶酶、胰蛋白酶相对活性结果见表 8。
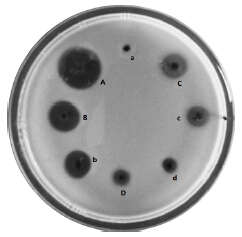 | A-胰蛋白酶 a-加1 mmol/L EDTA和25 mg/mL TLCK失活的胰蛋白酶 B-尿激酶 b-加1 mmol/L EDTA和25 mg/mL TLCK失活的尿激酶 C-蚓激酶 c-加1 mmol/L EDTA和25 mg/mL TLCK失活的蚓激酶 D-鼠妇纤溶酶 d-加1 mmol/L EDTA和25 mg/mL TLCK失活的鼠妇纤溶酶 A-trypsin a-trypsin deactivation by 1 mmol/L EDTA and 25 mg/mL TLCK B-Urokinase b-urokinase deactivation by 1 mmol/L EDTA and 25 mg/mL TLCK C-lumbrokinase c-lumbrokinase deactivation by 1 mmol/L EDTA and 25 mg/mL TLCK D-porcellio plasmin d-porcellio plasmin deactivation by 1 mmol/L EDTA and 25 mg/mL TLCK图 9 尿激酶、蚓激酶、鼠妇纤溶酶和胰蛋白酶在混合制剂溶液中纤溶活性 Fig.9 Fibrinolytic activity of urokinase,lumbrokinase,porcellio plasmin and trypsin in mixture |
| 表 8 尿激酶、蚓激酶、鼠妇纤溶酶和胰蛋白酶在混合制剂溶液中相对纤溶活性 $\left( {\bar x \pm s,n = 5} \right)$ Table 8 Relative fibrinolytic activity of urokinase,lumbrokinase,porcellio plasmin and trypsin in mixed preparation $\left( {\bar x \pm s,n = 5} \right)$ |
由图 9和表 8可以看出,在加了质量浓度为25 mg/mL TLCK和浓度为1 mmol/L EDTA的混合制剂的尿激酶、蚓激酶、鼠妇纤溶酶的溶液中剩余酶的相对活性基本维持在95%以上,故可推测混合制剂对尿激酶、蚓激酶、鼠妇纤溶酶活性影响较单一制剂更小,说明混合制剂优于单一制剂;而且混合制剂对胰蛋白酶活性的影响根据溶圈无变化和剩余酶的相对纤溶活性为0,可以推测其已有效失活。所以胰蛋白酶的最佳失活条件:质量浓度为25 mg/mL TLCK和浓度为1 mmol/L EDTA的混合制剂,同时也是保持尿激酶、蚓激酶和鼠妇纤溶酶最大稳定性的前提下让胃蛋白酶和胰蛋白酶有效失活的最优失活方案。
稳定性试验:取同样以上缓冲液(蚓激酶或尿激酶或鼠妇纤溶酶或胰蛋白酶液-混合制剂液1∶10),精密吸取10 μL,分别于0、2、6、9、14、18、24 h点样于纤维蛋白平板的孔中,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.2%,表明以上缓冲液24 h内稳定。
重复性试验:取同样以上缓冲液(蚓激酶或尿激酶或鼠妇纤溶酶或胰蛋白酶液-混合制剂液1∶10)5份,按“2.1.1”项方法计算出剩余酶相对活性。结果显示剩余酶相对活性RSD<1.2%,表明该方法重复性好。
3 讨论本实验主要研究pH值、温度、金属离子、酶抑制剂和表面活性剂对模拟胃肠环境中胃蛋白酶和胰蛋白酶纤溶活性的影响,并且得到了使胃蛋白酶和胰蛋白酶纤溶活性可以有效失活的较佳酶失活工艺。酶是一类蛋白质的大分子物质,容易受到各种物理的、化学的因素变性而失活。酶较其他化学催化剂更为脆弱,更容易失去活性。文献报道[16, 17, 18, 19, 20],影响酶纤溶活性的因素主要是pH值、温度、金属离子、酶抑制剂和表面活性剂等,本实验在相关文献研究的基础上,探讨了单因素对酶纤溶活性的影响。大多数酶在温度达到60 ℃以上就发生变性[20],但本实验结果提示胃蛋白酶在高于70 ℃的环境中活性依旧存在,推测有可能是W液中的胃蛋白酶在较高温度下发生水解产生了具有纤溶活性的小分子肽,这有待实验进行验证。
目前市场上常用的溶栓药物如尿激酶、蚓激酶等,临床上应用主要是注射给药或静脉滴注,但效果并不理想,为给尿激酶和蚓激酶口服给药提供一种可能,本实验分别研究了较佳的酶失活工艺对尿激酶、蚓激酶和鼠妇纤溶酶的纤溶活性的影响。试图得出最优失活方案,即在保持鼠妇纤溶酶最大稳定性的前提下让胃蛋白酶和胰蛋白酶有效失活。以通过模拟胃肠环境对鼠妇活性粗蛋白进行酶解,以获取相对分子质量更小、效价更高的蛋白质或多肽。
最终实验中失活的比例选择的是体积比1∶10,即W液或Y液-失活剂的缓冲液1∶10。由于在前期的预试验中考察了1∶1、1∶2、1∶5、1∶10,在达到1∶10时才可以完全失活。并且在纤维蛋白平板上点样时,为了保持失活前后W液(Y液)中的胃蛋白酶(胰蛋白酶)的浓度一致,用于失活前对照的胃蛋白酶(胰蛋白酶)的浓度同样也稀释了11倍。
综上所述,本实验初步探究了影响胃蛋白酶和胰蛋白酶纤溶活性因素,并较系统地研究了胃蛋白酶和胰蛋白酶纤溶活性的有效失活方法。
| [1] | 韩雅莉,李张伟.地鳖虫纤溶成分的分离纯化和活性测定[J].中药材, 2006, 29(8):765-767. |
| [2] | 许文博,王玉蓉,黄能听.全蝎胃蛋白酶酶解混合多肽体外抗凝活性研究及其组成分析[J].北京中医药大学学报, 2010, 33(2):127-129. |
| [3] | Qing Q B, Jin X C, Yi L F, et al. Purification and characterization of a new serine protease with fibrinolytic activity from the Marine Invertebrate, Urechis unicinctus[J]. Appl Biochem Biotechnol, 2013, 170(3):525-540. |
| [4] | 张豁中,温玉麟.动物活性成分化学[M].天津:天津科学技术出版社, 1995. |
| [5] | 王贤纯.蜈蚣的药用研究进展[J].动物学杂志, 2002, 37(3):88-91. |
| [6] | 王继红.全蝎抗癌的研究进展[J].现代中西医结合杂志, 2003, 12(15):1662-1663. |
| [7] | 刘玉清,洪澜,吴宏美,等.全蝎治疗恶性肿瘤的临床研究[J].热带医学杂志, 2003, 3(4):484-488. |
| [8] | Wang B J, Won S J, Yu Z R, et al. Free radical scavenging and apoptotic effects of Cordyceps sinensis fractioned by supercritical carbon dioxide[J]. Food Chem Toxicol, 2005, 43(4):543-552. |
| [9] | Wang F, Wang C, Li M, et al. Purification characterization and crystallization of a group of earthworm fibrinolytic enzymes from Eisenia foetida[J]. Biotechnol Lett, 2003, 25:1105-1109. |
| [10] | Zhao R, Ji J G, Tong Y P, et al. Isolation and Identification of proteins with anti-tumor and fibrinolysogen kinase activities from Eisenia foetida[J]. Acta Bioch Bioph Sin, 2002, 34(5):576-582. |
| [11] | Tian Z, Li B, Guo L W, et al. Purification and biochemical characterization of a novel fibrinolytic enzyme, PSLTro01, from a medicinal animal Porcellio scaber Latreille[J]. Int J Biol Macromol, 2015, 80:536-546. |
| [12] | 童耕雷.实用生物化学与分子生物学词典[M].北京:科学出版社, 2003. |
| [13] | Rawlings N D, Barrett A J. Families of serine peptidases[J]. Methods Enzymol, 1994, 244:19-61. |
| [14] | Mann M, Hendrickson R C, Pandey A. Analysis of proteins and proteomes by mass spectrometry[J]. Annu Rev Biochem, 2001, 70:437-473. |
| [15] | Uesugi Y, Usuki H, Iwabuchi M, et al. Highly potent fibrinolytic serine protease from Streptomyces[J]. Enzyme Microb Technol, 2011, 48(1):7-12. |
| [16] | Hellebrekers B W J, Trimbos-Kemper T C M, Trimbos J B M Z, et al. Use of fibrinolytic agents in the prevention of postoperative adhesion formation[J]. Fertil Steril, 2000, 74(2):203-212. |
| [17] | Ktari N, Ben-Khaled H, Nasri R, et al. Trypsin from zebra blenny(Salaria basilisca) viscera:Purification, characterisation and potential application as a detergent additive[J]. Food Chem, 2012, 130(3):467-474. |
| [18] | Ana G V, Juan C R, Elisa M V, et al. Trypsin from viscera of vermiculated sailfin catfish, Pterygoplichthys disjunctivus, Weber, 1991:Its purification and characterization[J]. Food Chem, 2013, 141(2):940-945. |
| [19] | Khangembam B K, Chakrabarti R. Trypsin from the digestive system of carp Cirrhinus mrigala:Purification, characterization and its potential application[J]. Food Chem, 2015, 175:386-394. |
| [20] | Klomklao S, Kishimura H, Yabe M, et al. Purification and characterization of two pepsins from the stomach of pectoral rattail(Coryphaenoides pectoralis)[J]. Compd Biochem Physiol Part B:Biochem Mol Biol, 2007, 147(4):682-689. |
| [21] | Meridor D, Gedanken A. Enhanced activity of immobilized pepsin nanoparticles coated on solid substrates compared to free pepsin[J]. Enzyme Microb Technol, 2014, 67:67-76. |
| [22] | 中国药典[S].一部. 2010. |
| [23] | Astrup T, Müllertz S. The fibrin plate method for estimating fibrinolytic activity[J]. Arch Biochem Biophys, 1952, 40(2):346-351. |
 2016, Vol. 47
2016, Vol. 47


