刺五加Eleutherococcus senticosus (Rupr. et Maxim.) Maxim. 是我国传统的珍贵药用植物,具有增强免疫力、抗衰老等多种生物活性,以齐墩果酸为配基或在齐墩果烷型配基上连有单糖链或双糖链的三萜皂苷类化合物是其主要活性成分之一[ 1 ]。在植物体中,三萜类物质的生成需经过类异戊二烯途径形成氧化鲨烯后,形成环化的碳链结构,进而连接羟基、羧基等官能团,最后经糖基化后形成各种以齐墩果烷型配基为基础单位的三萜皂苷类化合物的生物合成过程[ 2 ]。这一过程中,氧化鲨烯环化酶(oxidosqualene cyclases,OSC)催化2,3-氧化鲨烯的环化反应[ 2,3 ]。同属OSC超家族的β-香树酯醇合成酶(β-amyrin synthase,bAS)与环阿屯醇合酶(cycloartenol synthase,CAS)竞争2,3-氧化鲨烯,其中,bAS催化2,3-氧化鲨烯环化形成β-香树酯醇,进而进入三萜皂苷合成支流[ 2,4 ],而CAS则使2,3-氧化鲨烯环化成为环阿屯醇,从而进入甾醇等物质的合成支流[ 4,5 ]。人参Panax ginseng C. A. Mey [ 3 ]、黑种草Nigella sativa L.[ 6 ]的bAS表达量上升后,可减少甾醇的合成,使2,3-氧化鲨烯进入三萜皂苷合成支流,从而提高三萜皂苷的量。这说明,bAS是三萜皂苷生物合成过程中的一个关键限速酶。
目前已从人参[ 3 ]、远志Polygala tenuifolia Willd [ 2 ]、黑种草[ 6 ]等多个物种中先后克隆出编码bAS的cDNA序列,但尚未见关于刺五加bAS的相关报道。本实验室在已经克隆出刺五加鲨烯合酶、鲨烯环氧酶等多个参与刺五加皂苷生物合成的关键酶基因基础上[ 7,8 ],利用RT-PCR法首次克隆到刺五加bAS基因家族的2条cDNA序列,并对其表达与皂苷量的相关性进行了分析,为阐明bAS基因家族对皂苷合成的机制奠定基础。
1 材料与试剂 1.1 材料刺五加采自河北省兴隆县,辽宁省本溪市、吉林省穆棱市、伊通满族自治县、梅河口市、珲春市和黑龙江省鸡西市,经华北理工大学生命科学学院邢朝斌教授鉴定为五加科植物刺五加Eleutherococcus senticosus (Rupr. Et Maxim.) Maxim. 。为了便于对结果进行比较,参照文献方法[ 9,10 ],分别以萌芽期(4月26日)、叶片完全展开期(5月26日)、盛花期(6月26日)、果实快速生长期(7月26日)、果实基本成熟期(8月26日)、叶片衰老期(9月26日)的叶片和8月16日的茎、叶片、叶柄和根为提取RNA和测定皂苷量的试材。
1.2 试剂Taq DNA聚合酶、SYBR Premix Ex TaqTM II、LA Taq DNA聚合酶和琼脂糖凝胶DNA回收试剂盒购自Takara公司。植物总RNA提取试剂盒、质粒小提试剂盒和PGM-T克隆试剂盒购自天根生化科技(北京)有限公司。RevertAidTM First strand cDNA synthesis Kit购自Thermo公司。琼脂糖凝胶DNA回收试剂盒购自Biomiga公司。齐墩果酸对照品(批号110709-200505)购自中国食品药品检定研究院;其他均为国产分析纯。引物由生工生物工程(上海)股份有限公司合成,PAGE纯化。
2 方法 2.1 茉莉酸甲酯(MeJA)处理以产地吉林省伊通满族自治县的刺五加为试材,分别于2013年4月26日、5月1日和5月6日连续喷施5 mmol/L MeJA至滴水为止,共3次。以蒸馏水为对照,进行平行处理。
2.2 RNA的提取、逆转录与引物根据天根公司植物总RNA提取试剂盒的说明,分别提取各样本中的总RNA,并按照Takara公司RevertAidTM First strand cDNA synthesis Kit的要求,加入2 μL总RNA,逆转录为cDNA。
根据辽东楤木Aralia elata (Miq.) Seem(HM219225.1)、积雪草Centella asiatica (L.) Urban.(AY520818.1)和人参(AB009030.1)bAS基因的cDNA序列,设计RT-PCR扩增刺五加bAS基因的简并引物bASS1和bASX1(表 1)。根据测序得到的刺五加bAS1、bAS2和已经克隆得到的actin基因(KC469585)[ 11 ]的cDNA序列,利用Primer premier 5.0软件分别设计Real time PCR扩增bAS1、bAS2及actin基因的特异性引物bAS1rts、bAS1rtx,bAS2rts、bAS2rtx,ACTrts、ACTrtx(表 1),预计扩增长度分别为:104、117和128 bp[ 11 ]。
| 表 1 引物序列 Table 1 Sequences of primers |
以“2.2”项中逆转录获得的刺五加cDNA为模板,RT-PCR扩增刺五加bAS基因的cDNA序列。反应体系25 μL,其中引物bASS1和bASX1各1 μL,cDNA 1 μL,2.5 mmol/L dNTP 2 μL,LA Taq酶0.3 μL,10×LA Taq 缓冲液2.5 μL,补dd H2O至25 μL。反应条件为95 ℃、3 min;95 ℃、1 min;56 ℃、30 s;72 ℃、1 min 30 s。35个循环后72 ℃补充延伸10 min。扩增产物经2%琼脂糖凝胶电泳、回收后,克隆入PGM-T质粒载体,转化大肠杆菌TOP10。将验证转化成功的菌株随机选取5株,提取质粒,送Takara公司测序。参照文献的方法[ 9 ]进行生物信息学分析。
2.4 Real time PCR与定量分析以“2.2”项中各样本的cDNA为模板,分别利用扩增bAS1、bAS2和actin基因的引物进行特异性PCR扩增,产物经电泳后切胶回收,获得含高浓度各基因的DNA溶液。以其为标准品,10倍梯度稀释,共5个梯度,制作标准曲线。利用ABI 7900 HT real-time PCR system,按照Takara公司SYBR® Premix Ex TaqTM II的说明进行real time PCR反应。总反应体系中上、下游引物各0.3 μL,SYBR® Premix Ex TaqTM II 5 μL,各样本的cDNA或回收的高浓度DNA模板0.2 μL,50×ROX reverse 0.2 μL,ddH2O 4 μL,共10 μL。反应条件为95 ℃ 50 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。反应结束后,进行熔解曲线分析,鉴定产物的特异性。每个反应重复3次。利用SDS2.4软件进行数据收集,根据标准曲线以及荧光曲线的Ct值,参照文献的方法[ 12 ]计算bAS1和bAS2的相对表达量。
参照文献的方法[ 7 ]测定刺五加不同生长期叶片和不同器官中的总皂苷量。应用SPSS 17.0软件分析bAS1和bAS2基因表达量与刺五加皂苷量间的相关性。
3 结果与分析 3.1 刺五加bAS基因的克隆利用简并引物bASS1和bASX1,以刺五加的cDNA为模板,RT-PCR扩增获得长度约1 300 bp的片段(图 1)。将该片段重组入PGM-T质粒后的测序结果表明,RT-PCR获得2条刺五加bAS 基因的cDNA序列,分别命名为bAS1(GenBank登录号:JF818130)和bAS2(GenBank登录号:JF818131)。bAS1基因cDNA的长度为1 223 bp,推测其编码407个氨基酸残基组成的多肽。bAS2基因cDNA的长度为1 226 bp,推测其编码408个氨基酸残基组成的多肽。bAS1的核苷酸序列与辽东楤木(HM219225.1)、人参(AB009030.1)的bAS核苷酸序列一致性分别为95.42%、94.28%,氨基酸序列的一致性分别为96.07%、94.84%。bAS2的核苷酸序列与积雪草(AY520818.1)、三七(KC953035.1)的bAS核苷酸序列一致性分别为82.31%、81.04%,氨基酸序列的一致性分别为90.69%、88.48%。刺五加bAS1蛋白336~378和385~407位的氨基酸残基处和bAS2蛋白339~379和387~408位的氨基酸残基处为OSC家族的重要特征序列(图 2)。
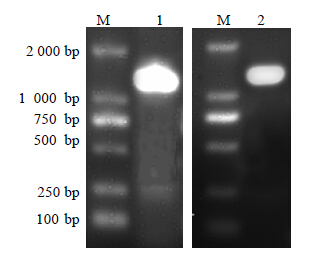 |
M-Marker 1-bAS基因的RT-PCR扩增 2-bAS基因重组质粒的PCR扩增 M-Marker 1-RT-PCR amplification of bAS gene 2-PCR amplification of bAS recombinant plasmid 图 1 刺五加bAS基因的克隆Fig. 1 Cloning of bAS gene from E. senticosus |
 |
1-辽东楤木bAS 2-人参bAS 3-刺五加bAS1 4-刺五加bAS2 5-积雪草bAS *代表保守氨基酸 1-A. elata bAS 2-P. ginseng bAS 3-E. senticosus bAS1 4-E. senticosus bAS2 5-C. asiatica bAS *stand for conservative amino acid 图 2 刺五加与辽东楤木、人参、积雪草bAS氨基酸序列比对Fig. 2 Comparison on amino acid sequence alignment of bAS in E. senticosus with those in P. ginseng,A. elata,and C. asiatica |
刺五加的bAS1和bAS2在整个生长发育期中均有表达(图 3),但表达量差异显著(P<0.05)。在萌芽期(4月26日)和叶片衰老期(9月26日)bAS1的表达量显著高于bAS2的表达量,其中萌芽期两者的表达量差异最大,bAS1的表达量达bAS2的35.78倍。叶片完全展开期(5月26日)至果实基本成熟期(8月26日),bAS1的表达量显著低于bAS2。其中,盛花期(6月26日)两者的表达量差异最大,bAS2的表达量达bAS1的3.92倍。bAS1在萌芽期的表达量最高,之后急速下降,并维持恒定。bAS2则呈现低-高-低的变化趋势,其中盛花期的表达量最高,为最低表达量(叶片衰老期)的20.49倍。
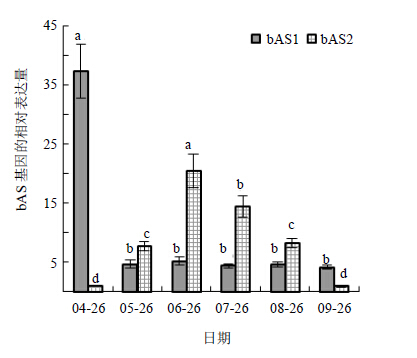 |
不同小写字母代表差异显著(P<0.05),下同 Different lowercase letters indicate significant difference (P<0.05),same as below 图 3 不同生长发育时期刺五加bAS基因家族的表达Fig. 3 Expression changes of bAS gene family at different growth and development stages of E. senticosus |
bAS1和bAS2在刺五加的叶片、叶柄、茎和根器官中均有表达(图 4),但bAS2的表达量均显著高于bAS1的表达量(P<0.05)。其中,叶片中两者的表达量差异最大,bAS2达bAS1的6.38倍,根中两者表达的差异最小,bAS2的表达量为bAS1的2.34倍。bAS1在叶片、叶柄、茎和根中的表达基本恒定。bAS2在叶片和叶柄中的表达量显著高于茎和根中的表达量,bAS2在叶片中的表达量最高,为最低表达量(茎)中的2.23倍。
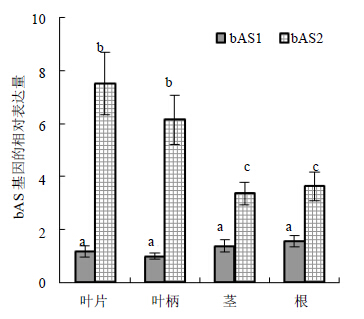 | 图 4 刺五加不同器官中bAS基因家族的表达Fig. 4 Expression quantity of bAS gene family in different organs of E. senticosus |
MeJA处理刺五加后bAS1和bAS2的表达变化规律与对照组基本相符(图 5),但MeJA处理显著提高了刺五加bAS2的表达水平(P<0.05),而bAS1的表达量则无显著变化。在MeJA处理的早期(4月26日),bAS2的表达量显著提升至对照组的6.30倍,之后基本维持在2倍左右,其中果实基本成熟期(9月26日)的提升幅度最小,为对照组的1.51倍。
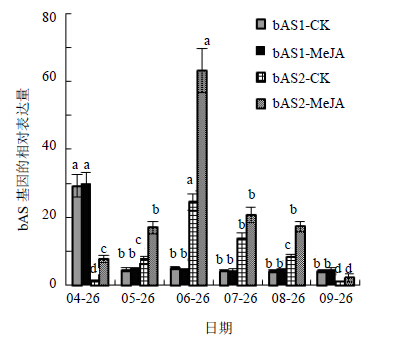 | 图 5 MeJA处理对刺五加bAS基因家族表达的影响Fig. 5 Effect of MeJA treatment on expression of bAS gene family in E. senticosus |
刺五加叶片中的皂苷平均量为25.5 mg/g,叶柄、茎和根中未检测到皂苷的存在。刺五加叶片各生长发育时期的皂苷量如图 6所示,其中盛花期(6月26日)的皂苷量为叶片衰老期的4.28倍。刺五加的皂苷量与bAS2的表达量同升同降,两者间的相关系数高(r=0.964),呈极显著的正相关关系(P<0.01)。而bAS1的表达量与皂苷量间的相关系数低(r=-0.276),未达显著水平。
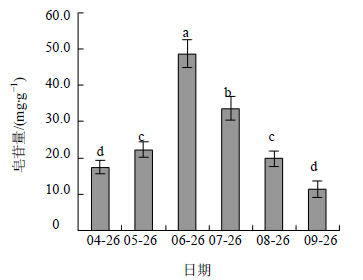 | 图 6 刺五加不同生长发育时期的皂苷量Fig. 6 Saponin contents of E. senticosus at different growth and development stages |
OSC家族成员的氨基酸具有较高的同源性,所有的成员均具备2个高度保守的序列,即DDTAEA序列和谷氨酰胺和色氨酸(QW)特征序列[ 13 ]。其中QW序列的作用是在2,3-氧化鲨烯环化反应中稳定碳阳离子,而DDTAEA序列的作用则是参与底物的结合。QW区域通常带有负电荷,而且常出现4~8次重复的芳香族氨基酸。研究推测该重复序列可能与蛋白质结构的稳定性有关,在进行环化的过程中可以与中间阳离子相互作用[ 13,14,15 ]。这些特征同样也存在于刺五加的2个bAS中。系统发育的分析表明,刺五加bAS1和bAS2同源性很低,前者与人参bAS1相近,而后者与积雪草的bAS相近,这也与人参、积雪草中的主要皂苷类型相符[ 3 ]。
一般认为,大多数植物的三萜皂苷类化合物都是由齐墩果烷和达玛烷衍化而来的[ 16 ],而bAS的作用位点存在于三萜皂苷生物合成途径的下游阶段,是生物合成三萜皂苷的关键步骤,主要完成对官能团进一步的环化反应,将2,3-氧化鳖烯催化合成β-香树酯醇[ 2 ]。因此,研究bAS的表达与皂苷量的相关关系对阐明三萜类化合物的生物合成途径及其作用机制具有非常重要的意义。OSC家族的成员极其多样,其中的bAS负责催化形成齐墩果烷型三萜皂苷,而达玛烷型合成酶催化达玛烷型三萜皂苷的生物合成,两者各自形成一个代谢通路[ 14 ]。达玛烷型三萜皂苷是人参的主要活性物质,而刺五加的皂苷为齐墩果烷型三萜皂苷,因此刺五加皂苷的主要合成途径应为bAS介导的齐墩果烷型三萜皂苷代谢途径。对刺五加bAS1和bAS2基因的表达分析结果表明,与人参bAS相近的刺五加bAS1在各器官及除萌芽期外的所有生长期中基本恒定表达,与皂苷量相关性不显著,而与积雪草bAS相近的bAS2则在皂苷分布丰富的叶片及盛花期表达量升高,两者同升同降,相关系数高达0.964,呈现出显著的正相关关系。这与龙牙楤木bAS在盛花期的叶中高表达的特点完全相符[ 15 ],也与远志bAS在皂苷量器官中高表达的特点相似。同时MeJA处理后,刺五加bAS2的表达量显著提高,这与MeJA长时间处理可显著提高积雪草bAS的表达水平,进而显著提高其齐墩果烷型皂苷产量的结果相似[ 5 ],说明刺五加bAS基因家族中的bAS2为调控刺五加皂苷生物合成的类型,可能是刺五加中三萜皂苷生物合成中的关键酶。
| [1] | 涂正伟, 周渭渭, 单 淇, 等. 刺五加的研究进展 [J]. 药物评价研究, 2011, 34(3): 213-216. |
| [2] | Jin M L, Lee D Y, Um Y, et al. Isolation and characterization of an oxidosqualene cyclase gene encoding a beta-amyrin synthase involved in Polygala tenuifolia Willd. saponin biosynthesis [J]. Plant Cell Rep, 2014, 33(3): 511-519. |
| [3] | Kim O T, Bang K H, Kim Y C, et al. Upregulation of ginsenoside and gene expression related to triterpene biosynthesis in ginseng hairy root cultures elicited by methyl jasmonate [J]. Plant Cell Tissue Org Cult, 2009, 98: 25-33. |
| [4] | 邢朝斌, 龙月红, 吴 鹏, 等. 刺五加环阿屯醇合酶基因的克隆及其表达分析 [J]. 中草药, 2012, 43(7): 1387-1392. |
| [5] | Kim O T, Kim M Y, Hwang S J, et al. Cloning and molecular analysis of cDNA encoding cycloartenol synthase from Centella asiatica (L.) Urban [J]. Biotechnol Bioproc Eng, 2005, 10(1): 16-22. |
| [6] | Scholz M, Lipinski M, Leupold M, et al. Methyl jasmonate induced accumulation of kalopanax saponin I in Nigella sativa [J]. Phytochemistry, 2009, 70(4): 517-522. |
| [7] | 邢朝斌, 劳凤云, 龙月红, 等. 刺五加鲨烯合酶和鲨烯环氧酶基因单核苷酸多态性及其与总皂苷量的相关性研究 [J]. 中草药, 2012, 43(10): 2020-2024. |
| [8] | 邢朝斌, 吴 鹏, 修乐山, 等. 刺五加功能基因密码子偏好性的分析 [J]. 中草药, 2013, 44(5): 598-603. |
| [9] | 邢朝斌, 刘 岩, 周 秘, 等. 刺五加液泡膜内在蛋白基因的克隆与表达分析 [J]. 中草药, 2014, 45(2): 250-254. |
| [10] | 邢朝斌, 龙月红, 吴 鹏, 等. 刺五加皂苷合成关键酶基因表达的半定量RT-PCR分析 [J]. 基因组学与应用生物学, 2011, 30(6): 691-696. |
| [11] | 邢朝斌, 龙月红, 修乐山, 等. 刺五加肌动蛋白基因的克隆和表达稳定性分析 [J]. 中草药, 2013, 44(13): 1819-1822. |
| [12] | 李宝财, 修乐山, 周 秘, 等. 刺五加鲨烯环氧酶基因的表达及其与刺五加皂苷量的相关分析 [J]. 中药材, 2013, 36(7): 1063-1066. |
| [13] | 陈 莉, 吴耀生. 三萜皂苷生物合成途径及相关酶 [J]. 国外医药: 植物药分册, 2004, 19(4): 156-161. |
| [14] | Yu F, Thamm A M, Reed D, et al. Functional characterization of amyrin synthase involved in ursolic acid biosynthesis in Catharanthus roseus leaf epidermis [J]. Phytochemistry, 2013, 91: 122-127. |
| [15] | Wu Y, Zou H D, Cheng H, et al. Cloning and characterization of a beta-amyrin synthase gene from the medicinal tree Aralia elata (Araliaceae) [J]. Genet Mol Res, 2012, 11(3): 2301-2314. |
| [16] | Haralampidis K, Trojanowska M, Osbourn A. Biosynthesis of triterpenoid saponins in plants [J]. Adv Biochem Eng Biotechnol, 2002, 75: 31-49. |
 2015, Vol. 46
2015, Vol. 46


