2. 复旦大学附属中山医院 老年科, 上海 200032;
3. 复旦大学医学院 解剖与组织胚胎学系, 上海 200032
2. Department of Geriatrics, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
3. Department of Anatomy Histology and Embryology, College of Medicine, Fudan University, Shanghai 200032, China
内毒素是肠道革兰阴性细菌细胞壁外层成分,可引起全身炎症反应综合征甚至进展为多器官功能障碍综合征,老年患者的肠道屏障功能受损,菌群和内毒素移位,肝脏成为较易受到内毒素血症影响的主要脏器之一,肝脏损伤可严重威胁患者的生命安全。临床上对于内毒素性肝损伤尚缺乏有效的治疗手段。既往研究表明血清白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNF-α)等细胞因子参与并介导了内毒素性肝损伤的发生发展[ 1 ]。疏风解毒胶囊为传统复方制剂,具有疏风清热、解毒利咽、抗肝炎病毒、保肝利胆的作用,临床上常用于治疗病毒性及细菌性感染[ 2,3,4,5 ]。目前研究揭示疏风解毒胶囊通过抑制丝裂原活化蛋白激酶(MAPK)信号通路从而起到抑制炎症反应、减少细胞因子分泌与表达的作用[ 6 ],因此本研究拟用D-氨基半乳糖/脂多糖(D-GalN/LPS)诱导大鼠急性肝损伤模型,观察疏风解毒胶囊对于急性肝损伤的保护作用,初步探讨其作用机制。
1 材料 1.1 实验动物SPF级雄性SD大鼠购自并饲养于复旦大学医学院临床动物实验中心,控制温度(22±2)℃、湿度(65±5)%,每日光照和黑暗时间各12 h。实验前禁食12 h。实验期间自由进食饮水。实验动物照顾与使用皆遵循实验动物学会实验动物饲养与管理指南规定。动物许可证号SCXK(沪)2009-0019。
1.2 试剂与药物注射用LPS和D-GalN购自Sigma公司,疏风解毒胶囊购自安徽济人药业有限公司(批号130815,规格0.52 g/粒)。丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转氨酶(AST)的ELISA试剂盒购自中生北控生物科技股份有限公司。IL-1β、TNF-α、鸟氨酸氨基甲酰转移酶(OCT)、谷胱甘肽转移酶(GST)、高迁移率族蛋白B-1(HMGB-1)的ELISA试剂盒购自上海飞轩生物科技有限公司。
2 方法 2.1 分组、造模及给药SD大鼠80只,体质量为(250±20)g,按随机数字表法分为4组:对照组、模型组、地塞米松组、疏风解毒胶囊组,每组20只。实验第1天以氯胺酮ip麻醉动物后,模型组、地塞米松组、疏风解毒胶囊组大鼠腹腔缓慢注入D-GalN(700 mg/kg)制剂1mL,1 h后ip LPS(10 μg/kg)制剂1mL,对照组则采用同样的方法ip同体积的生理盐水。对照组和模型组大鼠每天ig生理盐水2 mL/kg,地塞米松组每天ip地塞米松5 mg/kg,疏风解毒胶囊组每天ig疏风解毒胶囊100 mg/kg(剂量根据预试验确定),各给药组均是造模当天给药,每天1次,连用7 d。
2.2 标本取材及处理上述4组均于第1、3、5、7天各随机取5只大鼠,乙醚麻醉后,采用心脏穿刺采血方法:剑突下,以角度25°~30°斜行向上进针刺入皮下,针尖穿过横膈膜继续斜行刺入2.5~3.0 cm。采血5 mL,离心后取其上清液,于-70 ℃低温冰箱中保存供ELISA法测定用。采血后大鼠断头处死,打开腹腔,完整分离肝脏,取右肝部分置于4%多聚甲醛固定,制备石蜡切片,进行苏木精-伊红(HE)染色,供病理学检查。
2.3 病理学检查取大鼠肝右叶相同部位约1 cm×1 cm×0.5 cm的肝组织小块,10%中性福尔马林固定,石蜡包埋4 μm切片,固定,常规HE染色,光镜(×200)下进行组织病理学观察。
2.4 ELISA法测定血清各因子水平取出冻存大鼠血清标本,用标本稀释液进行稀释,并按试剂盒要求,采用ELISA法测定大鼠血清中ALT、AST、IL-1β、TNF-α、OCT、GST、HMGB-1水平。
2.5 统计学处理采用SPSS 18.0软件,数据以x±s表示,资料符合正态分布,检验各组方差齐性,采用ANOVA进行总体比较。如果检验结果有统计学意义,则进一步作两两比较,两两比较的方法为LSD检验。
3 结果 3.1 各组大鼠的存活情况实验第1天模型组和地塞米松组大鼠各死亡1只,实验第3天疏风解毒胶囊组大鼠死亡1只,其中大鼠因内毒素休克、多器官功能障碍死亡。实验第5天及第7天模型组、地塞米松组、疏风解毒胶囊组均无大鼠死亡,对照组大鼠实验期间无死亡。
3.2 各组大鼠肝脏组织病理形态学改变对照组大鼠肝细胞索排列规则,肝小叶结构清晰,肝细胞核大而圆,核膜清晰,核仁明显,胞质丰富,汇管区无炎性细胞浸润,结构清晰可见。模型组大鼠第1天可见肝细胞轻度变性、肿涨,呈气球样变性,肝脏静脉窦充血水肿明显;第3天可见肝细胞广泛浊肿,肝脏静脉窦充血明显;第5、7天仍有持续性炎症反应表现,肝细胞广泛肿胀,汇管区炎症细胞浸润。地塞米松组和疏风解毒胶囊组大鼠肝组织第1天同样可见肝细胞轻度变性、肿涨及汇管区炎症细胞浸润;第3天肝细胞肿胀、炎症反应更为明显,伴有炎症细胞浸润,血管窦充血;于第5天时肝细胞肿胀减轻,疏风解毒组第7天时大鼠的肝细胞炎症反应基本缓解,肝脏组织病理形态接近恢复正常。疏风解毒胶囊组与地塞米松组的肝组织的炎症反应及细胞形态学恢复无差别。见图 1。
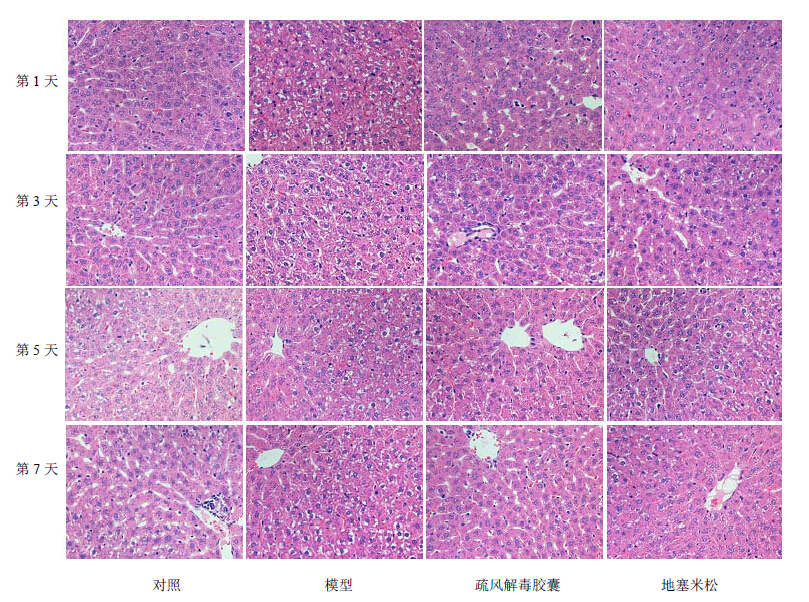 | 图 1 各组大鼠肝脏组织病理学观察结果Fig. 1 Histopathological observation on liver of rats in each group |
模型组、疏风解毒组和地塞米松组大鼠血清ALT、AST水平较对照组有明显升高,在第1、3、5、7天时疏风解毒胶囊组与地塞米松组的ALT及AST水平均显著低于模型组(P<0.05、0.01),疏风解毒胶囊组与地塞米松组相比无显著差异。见表 1和2。
| 表 1 疏风解毒胶囊对急性肝损伤大鼠血清ALT水平的影响(x±s) Table 1 Effect of Shufeng Jiedu Capsule on ALT level in serum of rats with acute liver injury(x±s) |
| 表 2 疏风解毒胶囊对急性肝损伤大鼠血清AST水平的影响(x±s) Table 2 Effect of Shufeng Jiedu Capsule on serum AST level in serum of rats with acute liver injury(x±s) |
模型组、疏风解毒胶囊组和地塞米松组大鼠血清的IL-1β、TNF-α水平较对照组有明显升高,在第3、5天时疏风解毒胶囊组与地塞米松组的IL-1β及TNF-α水平均显著低于模型组(P<0.05),疏风解毒胶囊组与地塞米松组相比无显著差异。见图 2。
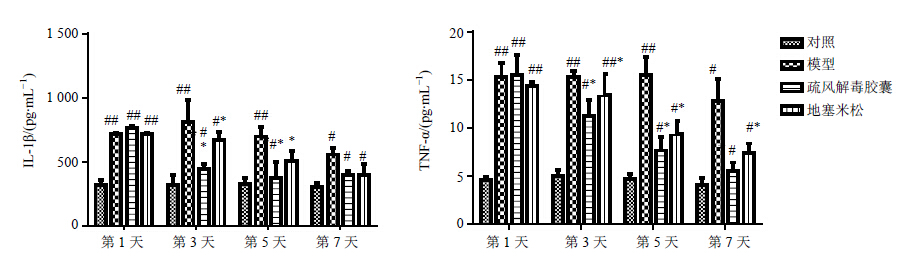 |
与对照组比较:#P<0.05,下同 #P < 0.05 vs control group,same as below 图 2 疏风解毒胶囊对急性肝损伤大鼠血清IL-1β和TNF-α水平的影响(x±s)Fig. 2 Effect of Shufeng Jiedu Capsule on IL-1β and TNF-α levels in serum of rats with acute liver injury(x±s) |
模型组、疏风解毒胶囊组和地塞米松组的大鼠血清OCT、GST、HMGB-1水平较对照组有明显升高,在第3、5天时疏风解毒胶囊组和地塞米松组的OCT、GST较模型组有明显降低(P<0.05),在第1、5天时疏风解毒胶囊组和地塞米松组HMGB-1水平较模型组有明显降低(P<0.05),疏风解毒胶囊组与地塞米松组相比无显著差异。见图 3。
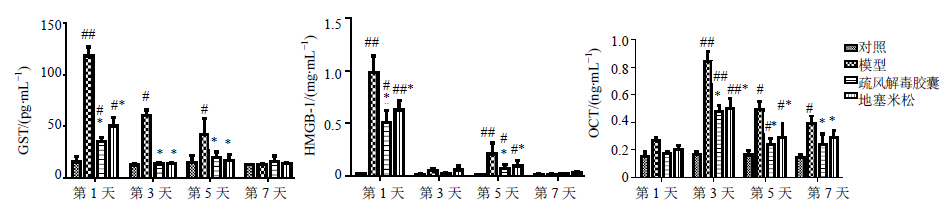 | 图 3 疏风解毒胶囊对急性肝损伤大鼠血清GST、HMGB-1、OCT水平的影响(x±s)Fig. 3 Effect of Shufeng Jiedu Capsule on OCT,GST,and HMGB-1 levels in serum of rats with acute liver injury(x±s) |
内毒素血症是急性肝损伤以及众多危重疾病的常见并发症,它不仅可导致全身炎症反应综合症,严重者可导致多器官功能障碍综合征[ 7 ]。肝脏是人体最重要的解毒脏器,也是清除内毒素的主要器官,是内毒素血症时受损最早、最明显的器官之一,两者之间存在相互作用、相互影响的关系,一旦发生肝损伤,内毒素肝脏解毒功能受损,机体容易形成恶性循环,导致不可逆转的脓毒血症甚至多器官功能障碍综合征。
正常情况下内毒素主要由肝脏的库普弗细胞(Kupffer cell)所清除[ 8 ]。内毒素血症时,机体肝细胞在内毒素及炎症等刺激下,炎症细胞分泌多种具有多重生物学活性的细胞因子如IL-1β、TNF-α等,可与肝细胞表面相关受体相作用,对肝脏具有明显的毒性,可引起肝细胞坏死[ 9,10 ];同时IL-1β和TNF-α细胞因子一起形成重要的炎性介质,从而激活核转录因子-κB(NF-κB),而NF-κB是细胞内重要的转录因子,具有基因转录多向调控作用,激活后可使参与免疫反应和炎症反应各阶段的许多分子如IL-6、IL-8等释放增加,引起瀑布效应,肝细胞损伤进一步加重。
已有文献表明地塞米松由于具有明确的抗炎作用,可以降低炎症细胞因子如IL-1β、TNF-α等的表达,从而在内毒素血症中起到减缓肝细胞损伤的作用[ 11 ]。但由于具有引起消化道出血及血糖升高等副作用,限制了其在临床的应用。疏风解毒胶囊作为中国传统医学中的天然植物药,功能主治疏风清热、解毒利胆。其主要组成包括虎杖、连翘、板蓝根、柴胡、败酱草、芦根、甘草等,虎杖中的大黄素具有明显的保肝退黄疸作用[ 12 ]。目前研究揭示疏风解毒胶囊通过抑制MAPK信号通路从而起到下调炎症反应、减少细胞因子的分泌与表达的作用[ 13 ],故考虑其是否可以通过下调炎症反应作用来抑制炎症因子IL-1β和TNF-α的产生,从而达到减轻肝组织损伤的作用。
血清中ALT水平可以显示肝细胞受损程度,AST可反映线粒体损伤情况。本实验结果表明与模型组相比,疏风解毒胶囊组可以明显降低血清ALT及AST水平,减缓肝细胞及线粒体损伤情况。GST和OCT是2个重要的肝脏损伤标志物,在肝脏损伤和炎症发生发展过程中明显升高。血清GST及OCT水平也是反映急性肝损伤的早期灵敏指标。通过与模型组相比较,疏风解毒胶囊治疗组血清中的GST及OCT水平明显降低,其效果与地塞米松组相当。HE染色病理学检查结果显示疏风解毒胶囊可以减轻内毒素对肝脏组织的炎症反应及损伤,其效果与地塞米松相当。
在肝损伤后期炎症细胞的HMGB-1分泌增加,HMGB-1可通过主动分泌和被动释放两种方式释放至血浆中,在炎症性肝损伤的中后期反应中起着重要作用,不仅使炎症反应的程度加深,而且使得炎症反应的时程延长,从而形成一个恶性循环,加速肝损伤,甚至肝衰竭的进程,阻断HMGB-1的作用可以明显缓解内毒素诱导的肝损伤,所以HMGB-1及其信号传导通路成为了肝脏抗炎症和损伤的重要靶点[ 14,15,16,17 ]。通过与模型组相比较,疏风解毒胶囊组血清中的HMGB-1水平明显降低,其效果与地塞米松组相当,提示疏风解毒胶囊可以抑制HMGB-1及其信号传导通路起到减缓肝组织损伤的作用。
本实验结果显示,模型组的IL-1β和TNF-α分泌明显较对照组高,而疏风解毒胶囊组的IL-1β和TNF-α分泌较模型组下降,其下降幅度与地塞米松组相当。提示疏风解毒胶囊可以通过下调炎症反应作用来抑制炎症因子IL-1β和TNF-α的产生,减少其与肝细胞表面相关受体的结合,减缓对肝脏的毒性,减慢肝细胞坏死,从而起到对D-GalN/LPS所致肝损伤的保护作用。同时疏风解毒胶囊多成分说明通过其对于肝损伤保护机制存在多靶点、多途径机制可能,还有待于进一步研究。
随着对疏风解毒胶囊研究的逐步深入,其独特的脏器保护作用不断被研究所证实,目前尚缺乏大规模的临床试验及循证医学证据,尚需要进一步深入研究。
| [1] | Liu X Q, Hu X J, Xu H X, et al. Xiaochaihu Decoction attenuates the vicious circle between the oxidative stress and the ALP inactivation through LPS-catecholamines interactions in gut, liver and brain during CCI4+ ethanol-induced mouse HCC [J]. BMC Complement Altern Med, 2013, 13(28): 375-384. |
| [2] | Oya S, Yokoyama Y, Kokuryo T, et al. Inhibition of Toll-like Receptor 4 suppresses liver injury induced by biliary obstruction and subsequent intraportal lipopolysaccharide injection [J]. Am J Physiol Gastrointest Liver Physiol, 2014, 306(3): 244-252. |
| [3] | Gulle K, Akpolat M, Kurcer Z, et al. Multi-organ injuries caused by lipopolysaccharide-induced periodontal inflammation in rats: role of melatonin [J]. J Periodontal Res, 2014, 49(6): 736-741. |
| [4] | Jung M G, Do G M, Shin J H, et al. Acanthopanax koreanum Nakai modulates the immune response by inhibiting TLR 4-dependent cytokine production in rat model of endotoxic shock [J]. Nutr Res Pract, 2013, 7(6): 460-465. |
| [5] | 胡 蓉, 王丽华, 张珺珺, 等. 疏风解毒胶囊治疗急性咽炎风热证的临床观察 [J]. 药物评价研究, 2014, 37(5): 460-462. |
| [6] | Ghazwani M, Zhang Y, Gao X, et al. Anti-fibrotic effect of thymoquinone on hepatic stellate cells [J]. Phytomedicine, 2014, 21(3): 245-260. |
| [7] | Tomasi M L, Ryoo M, Yang H, et al. Molecular mechanisms of lipopolysaccharide-mediated inhibition of glutathione synthesis in mice [J]. Free Radic Biol Med, 2014, 68(3): 148-158. |
| [8] | Bekpinar S, Develi I S, Unlucerci Y, et al. Modulation of arginine and asymmetric dimethylarginine concentrations in liver and plasma by exogenous hydrogen sulfide in LPS-induced endotoxemia [J]. Can J Physiol Pharmacol, 2013, 91(12): 1071-1075. |
| [9] | Stewart R K, Dangi A, Huang C, et al. A novel mouse model of depletion of stellate cells clarifies their role in ischemia/reperfusion- and endotoxin-induced acute liver injury [J]. J Hepatol, 2014, 60(2): 298-305. |
| [10] | Carchman E H, Whelan S, Loughran P, et al. Experimental sepsis-induced mitochondrial biogenesis is dependent on autophagy, TLR4, and TLR9 signaling in liver [J]. FASEB J, 2013, 27(12): 4703-4711. |
| [11] | Jia M, Jing Y, Ai Q, et al. Potential role of catalase in mice with lipopolysaccharide/D-galactosamine-induced fulminant liver injury [J]. Hepatol Res, 2014, 44(11): 1151-1158. |
| [12] | Chastre A, Bélanger M, Nguyen B N, et al. Lipopolysaccharide precipitates hepatic encephalopathy and increases blood-brain barrier permeability in mice with acute liver failure [J]. Liver Int, 2014, 34(3): 353-361. |
| [13] | Zhang Y, Shan L, Hua Y, et al. Baicalein selectively induces apoptosis in activated lymphocytes and ameliorates concanavalin a-induced hepatitis in mice [J]. PLoS One, 2013, 8(7): e69592. |
| [14] | 李云旭, 王玉珍, 王金玲, 等. 地塞米松对大鼠急性肝损伤的治疗作用及机制探讨 [J]. 内蒙古农业大学学报, 2012, 33(3): 136-140. |
| [15] | Sakai S, Iizuka N, Fujiwara M, et al. Mild obesity reduces survival and adiponectin sensitivity in endotoxemic rats [J]. J Surg Res, 2013, 185(1): 353-363. |
| [16] | Yi D, Hou Y, Wang L, et al. Dietary N-acetylcysteine supplementation alleviates liver injury in lipopoly- saccharide-challenged piglets [J]. Br J Nutr, 2014, 111(1): 46-54. |
| [17] | Tsung A, Sahai R, Tanaka H, et al. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion [J]. J Exp Med, 2005, 201(7): 1135-1143. |
 2015, Vol. 46
2015, Vol. 46


