2. 天津药物研究院,天津 300193;
3. 湖南中医药大学药学院,湖南 长沙 410208;
4. 长沙博海生物科技有限公司,湖南 长沙 410205
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China;
4. Changsha Broad-Ocean Bio-Science and Technique Co., Ltd., Changsha 410205, China
细柱五加Acanthopanax gracilistylus W. W. Smith(AGS)为五加科(Araliaceae)五加属Acanthopanax (Deche. Et Planch) Miq. 植物,具有祛风除湿、补益肝肾、强筋壮骨、利水消肿的功效[1]。现代药理学研究表明五加属植物AGS和刺五加的根皮多糖、红毛五加的茎皮多糖均具有抗癌作用,无梗五加果多糖具有抗疲劳作用等[2, 3, 4, 5, 6, 7, 8, 9]。本研究团队通过对细柱五加叶多糖(AGSL-P)的体外活性实验,显示AGSL-P具有促进细胞增殖,促进NO的释放,对激活细胞免疫具有一定的作用。所以对AGSL中的多糖进行提取工艺的研究以及进一步分离纯化是很有必要的。
天然植物多糖分离纯化的方法有很多种,如色谱法、超滤法、电泳法等。相比其他方法,柱色谱法操作简便,分离效果好,重复性高,分离条件缓和,应用广泛[9, 10]。本实验首先采用球面对称设计法对AGSL中多糖的闪式提取工艺进行优化,然后采用醇沉、Sevag法除蛋白、脱色、透析方法等进行初步纯化,采用琼脂糖凝胶色谱、葡聚糖凝胶分离等方法对AGSL粗多糖进一步分离纯化,并对其结构进行初步鉴定。天然植物多糖相对分子质量大,结构复杂,吸水性能好,已经成为了化妆护肤品中最重要的营养保湿材料。因此,本实验也对AGSL-P及其纯化产物AGSL-P-1、AGSL-P-2进行了保湿及吸湿性能的研究,为合理开发利用AGS资源提供依据。
1 仪器与材料UV-1750紫外可见分光光度计,日本岛津公司;JHBE-20A型闪式提取器,北京金鼐科技有限公司;AUW220D分析天平,日本岛津公司;高速冷冻离心机,德国Beckman公司;MD7044透析袋,上海源叶生物科技有限公司;AS 3120A型超声波清洗仪,天津奥特赛恩斯仪器有限公司;予华HH-S型水浴锅,巩义市英峪予华仪器厂;DZ-1BC型真空干燥箱,上海精密实验设备有限公司;SHZ-D(III)型循环水式真空泵,巩义市予华仪器有限公司。
细柱五加叶(AGSL),2012年8月采自于湖南省长沙市近郊,经湖南中医药大学药学院刘向前教授鉴定为细柱五加Acanthopanax gracilistylus W. W. Smith叶,自然干燥后,粉碎成粗粉(过40目筛)备用。标本(标本号为120815-Y)保存于湖南省重点实验室中药新药研究与开发实验室。
葡萄糖对照品,中国药品生物制品检定所,AR 级,批号150623-200901,质量分数≥98%;AGSL-P,本实验室自制,由闪式提取法制得;芦丁,本实验室自制,质量分数≥98%;苯酚、浓硫酸、三氯甲烷、正丁醇、乙醇、磷酸二氢钠、磷酸氢二钠、氯化钠、聚乙二醇400、甘油、1,3-丁二醇、水溶性淀粉、可溶性蛋白等试剂均为国产分析纯;蒸馏水自制。DEAE-Sepharose Fast Flow(45~165 μm)购自GE公司;Sephadex G-75购自瑞典Pharmacia公司。
2 方法与结果 2.1 多糖提取率测定 2.1.1 对照品溶液的配制葡萄糖对照品放置于105 ℃恒温干燥箱中,烘干到恒定质量,精密称取125.1 mg,加蒸馏水配成100 mL溶液,即为1.251 mg/mL的葡萄糖对照品溶液,备用。
2.1.2 AGSL-P样品的制备精密称取适量AGSL粗粉(过40目筛),加入蒸馏水,一定条件下闪式提取2次,离心,得上清液,浓缩成浸膏。浸膏加水溶解,离心,取上清液加乙醇至乙醇体积分数为80%,静置于冰箱24 h,离心分离。离心得到的醇沉物加水复溶,加入等体积的Sevage试剂(氯仿-正丁醇3∶1)除蛋白。向除完蛋白后水溶液中加入3% H2O2溶液脱色,然后装入透析袋流水透析除去小分子物质。向透析液中加乙醇至乙醇体积分数为80%,得到醇沉物,用无水乙醇洗涤,放置在真空干燥箱中干燥,得到AGSL-P粉末。
2.1.3 标准曲线的绘制从葡萄糖对照品溶液中取1.00、2.00、3.00、4.00、5.00、6.00 mL分别置于100 mL量瓶中,分别定容至刻度,摇匀。上述溶液分别取2.00 mL,置于具塞试管中,加入1.00 mL 5%苯酚溶液,再快速加入5.00 mL浓硫酸。室温静置5 min,40 ℃水浴中加热30 min,取出,冰水浴至室温。于葡萄糖最大吸收波长490 nm处测吸光度(A)值,蒸馏水作空白。以A值为纵坐标,质量浓度(C)为横坐标,得到回归方程A=12.762 C+0.006 8,R2=0.999 4;线性范围12.5~75.1 mg/mL。
2.1.4 AGSL-P提取率测定根据回归方程计算多糖溶液中葡萄糖的质量浓度。再按如下公式计算AGSL-P提取率。
AGSL-P提取率=CDM/(WM0)
C为溶液中葡萄糖的质量浓度(mg/mL),D为稀释倍数,W为称取的多糖质量(mg),M为每1份药材所提取到的粗多糖粉末质量(g),M0为药材质量(g)
2.2 AGSL-P提取工艺 2.2.1 最佳溶剂的选择取AGSL 50.0 g,采用闪式提取法,分别用不同体积分数的乙醇(0、10%、20%、30%、40%)在室温的条件下(固液比1∶12、提取3次、转速3 000 r/min、提取时间为3 min),按“2.1.2”项所述提取AGSL-P。所得AGSL-P按“2.1.4”中方法测定提取率。实验结果表明,随着乙醇体积分数的增加,AGSL-P的提取率逐步下降,同时纯度随之提高。乙醇体积分数提高,水溶性多糖溶出减少,导致提取率下降。与此同时,乙醇体积分数提高,水溶性杂质溶出也减少,AGSL-P的纯度随乙醇体积分数的加大而提高。用水提取AGSL-P提取率高,用乙醇提取虽然AGSL-P的纯度提高,但是提取率低,且成本高。综合考虑,选择水为本实验的提取溶剂。
2.2.2 球面对称设计试验根据球面对称设计原理,结合单因素试验结果,以实验考察因素的个数为空间维数,选取对AGSL-P提取率影响较大的3个因素:固液比(X1)、提取温度(X2)、提取时间(X3)为考察因素,以AGSL-P提取率(Y)为考察指标,设计球面对称试验。由于提取次数只能是整数,球面对称设计方法无法将提取次数作为考察因素,参考单因素考察实验中最佳提取次数3次作为球面对称实验提取次数。
取AGSL药材粗粉(过40目筛)50.0 g,精密称定,按球面对称试验设计方法和“2.1.2”项操作步骤制备AGSL-P。因素水平见表 1,球面对称试验设计见表 1。
| 表 1 球面对称设计试验 (n=3) Table 1 Spherical symmetric design test (n=3) |
当固液比(1∶12)≤X1≤(1∶16),提取温度50 ℃≤X2≤80 ℃,提取时间180 s≤X3≤300 s时,根据上述拟合回归方程计算出优化条件:固液比为1∶14.5,提取温度为71 ℃,提取时间为257 s。理论上在此优化条件下,AGSL-P提取率为1.62%。
2.2.3 验证及提取方法对比试验为了验证球面对称设计试验优化结果的准确性,取AGSL药材粗粉(过40目筛)50.0 g,精密称定,按AGSL最佳闪式提取工艺进行3次验证试验,同时采用回流提取法和超声提取法提取AGSL-P进行对比试验。回流提取固液比为1∶14,提取温度为90 ℃,提取3次,每次120 min。超声提取固液比为1∶14,提取温度为60 ℃,提取3次,每次90 min。其余操作同“2.1.2”项。结果(表 2)显示,闪式提取法、回流提取法、超声提取法AGSL-P提取率分别为1.65%、0.86%、1.06%。其中,闪式提取法提取AGSL-P提取率与理论拟合值相比相对误差为1.82%,可认为理论值与试验值近似相等。闪式提取257 s(4.28 min)明显比回流提取120 min、超声提取90 min的AGSL-P提取率分别高92%、56%,且重复性良好。
| 表 2 验证试验结果 Table 2 Results of validation test |
称取AGSL-P 1 g溶于20 mL磷酸盐(PBS)缓冲溶液中,离心,取上清液过0.45 μm微孔滤膜,把滤液加到DEAE-Sepharose Fast Flow柱上,分别用200 mL PBS缓冲液、蒸馏水及0.1、0.3、0.5 mol/L NaCl溶液和0.5 mol/L NaOH洗脱,体积流量为1 mL/min,分段收集,每管10 mL,用苯酚-硫酸法跟踪检测AGSL-P的量。按洗脱峰分段收集洗脱液(图 1),透析后,真空干燥得到AGSL-P-1(46.33%)、AGSL-P-2(9.67%)、AGSL-P-3(13.83%)、AGSL-P-4(11.75%),其中,AGSL-P-1洗脱产率最高,选定AGSL-P-1进行下一步研究。
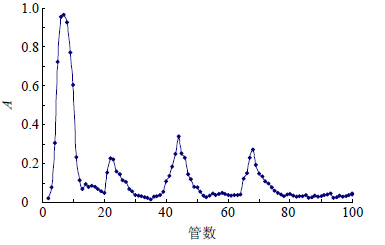 | 图 1 AGSL-P DEAE-Sepharose Fast Flow柱色谱洗脱曲线Fig. 1 Chromatogram on DEAE-Sepharose Fast Flow column for AGSL-P |
取AGSL-P-1粉末(463.3 mg)上Sephadex G-75柱,分别用PBS缓冲液、蒸馏水及0.1、0.3、0.5 mol/L NaCl溶液和0.5 mol/L NaOH洗脱,体积流量为1 mL/min,分段收集,每管10 mL,用苯酚-硫酸法跟踪检测。收集单一对称峰(图 2),透析后,真空干燥得到AGSL-P-1-1(31 3 mg)。
 | 图 2 AGSL-P-1 Sephadex G-75柱色谱洗脱曲线Fig. 2 Chromatogram on Sephadex G-75 column for AGSL-P-1 |
取AGSL-P-1-1,配制成2 mg/mL的溶液后,以蒸馏水作空白对照,分别以可溶性淀粉、芦丁、可溶性蛋白溶液作为阳性对照,进行碘-碘化钾、三氯化铁、双缩脲反应,结果显示,碘-碘化钾溶液、三氯化铁的水溶液、双缩脲试剂分别与AGSL-P-1-1反应,结果均为阴性,说明AGSL-P-1-1中不含淀粉、稀醇结构、酚类成分,不含或含极少量的蛋白质和多肽成分。
2.4.2 纯度测定AGSL-P-1-1经Sephadex G-75柱色谱后,得到单一对称的洗脱峰(图 3),说明AGSL- P-1-1是在一定相对分子质量范围的均一多糖。
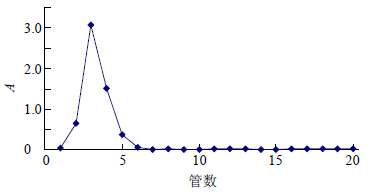 | 图 3 AGSL-P-1-1经Sephadex G-75柱色谱洗脱曲线Fig. 3 Chromatogram on Sephadex G-75 column for AGSL-P-1-1 |
取AGSL-P-1-1样品2 mg,加入200 mg经干燥的KBr晶体,研磨混合后压片,采用傅里叶变换红外光谱仪在4 000~400 cm−1扫描。结果见图 4,AGSL-P-1-1的IR图谱具 有多糖类物质的特征吸收峰:3 430.96、2 971.03、2 914.95、2 850.47、1 459.61、1 386.92 cm−1。尤其在1 386.92 cm−1处是单峰,说明CH3是孤立的。1 637.71 cm−1处的吸收峰是-CHO中C=O的伸缩振动所导致;1 420.56 cm−1处的吸收峰是C-H的弯曲振动所致,其和C-H的伸缩振动构成了糖环的特征吸收;1 033.98 cm−1处的强吸收应该是糖环C-O-C结构中C-O键的伸缩振动,也是葡萄糖的特征吸收,且在1 010~1 100 cm−1处有2个吸收峰,说明多糖应该为α构型;966.36 cm−1处为=C-H超平面弯曲振动峰;873.83 cm−1处可能为吡喃糖骨架伸缩振动吸收峰;603.21 cm−1处为吡喃糖骨架对称伸缩振动吸收峰,563.76 cm−1处为由糖环内酯C-O-C的α位置取代基产生的谱带。
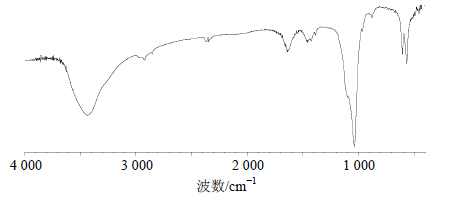 | 图 4 AGSL-P-1-1的IR谱图Fig. 4 IR spectrum of AGSL-P-1-1 |
称取AGSL-P-1-1 30 mg,溶于D2O中,配制成质量分数为4.0%的溶液,在常温下,进行1H-NMR测定。图 5为AGSL-P-1-1的1H-NMR谱图,δ 4.50~5.40是异头氢的区域,共有4处信号峰,其中δ 4.68处信号峰为溶剂信号,信号较强,有可能与其他的异头氢信号峰重叠。δ 5.02处信号峰可能是α-D-半乳糖的异头氢信号,δ 5.18处信号峰可能是α-D-鼠李糖的异头氢信号,δ 5.37处信号峰可能是α-D-葡萄糖异头氢信号,异头氢信号峰出现在δ 5.00以上,说明多糖为α构型,与IR图谱检测结果一致。作为多糖氢谱的特征,大部分质子共振峰出现在δ 3.66~4.15内,重叠严重,无法辨认。δ 3.28处可能是甲氧基的信号峰。δ 1.25和δ 1.26处为鼠李糖上甲基的质子共振吸收峰。结合IR的结果,多糖中可能含有葡萄糖、鼠李糖和半乳糖。
 | 图 5 AGSL-P-1-1的1H-NMR谱图Fig. 5 1H-NMR spectrum of AGSL-P-1-1 |
配制质量分数分别为1%的AGSL-P溶液、AGSL-P-1溶液、AGSL-P-2溶液、聚乙二醇400溶液、1,3-丁二醇溶液和5%甘油溶液,各10 mL。把上述样品放置在模拟环境相对湿度为43%和75%的干燥器中,20 ℃恒温,密封。吸湿12 h后称定质量,计算吸湿率,连续吸湿48 h。吸湿率=(W1-W0)/W0,W& lt; span lang="EN-US" xml:lang="EN-US">0和W1为样品吸湿前、后的质量。
从图 6可以看出,在相对湿度为43%环境下,吸湿率大小为AGSL-P-2>AGSL-P-1>1,3-丁二醇>5%甘油>聚乙二醇400>AGSL-P。AGSL-P-2的吸湿率随着时间的增加而增大,48 h时仍未达到饱和,直到168 h后达到最大吸湿率69%。AGSL-P-1的吸湿率在吸湿12 h时基本达到饱和。而AGSL多糖和其他3种保湿剂的吸湿率相差不大,随时间增长而缓慢增加,48 h时基本达到最大吸湿率。
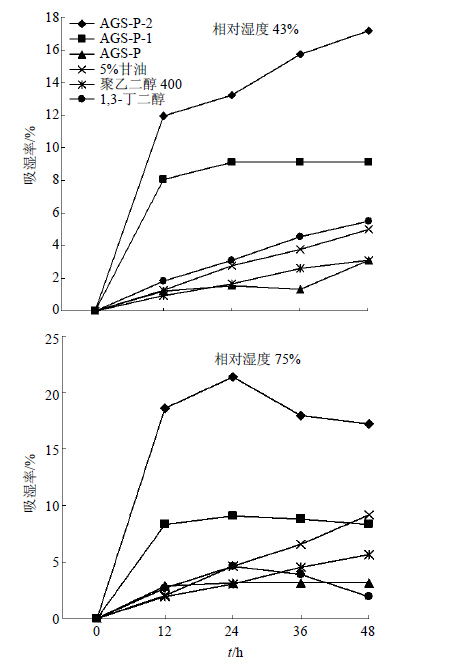 | 图 6 各样品吸湿率随时间变化Fig. 6 Changes of moisture absorption rate for each sample with time changing |
由图 6可以看出,在相对湿度为75%环境下,24 h时吸湿率大小为AGSL-P-2>AGSL-P-1>1,3-丁二醇>5%甘油>聚乙二醇400>AGSL-P;但在48 h时吸湿率大小为AGSL-P-2>5%甘油>AGSL-P-1>聚乙二醇400>AGSL-P>1,3-丁二醇。AGSL-P-2在24 h时达到最大吸湿率,超过24 h&l t;/ span>吸湿率会随着时间的增加而减小。AGSL-P-1的吸湿率在吸湿12 h时基本达到饱和,24 h时达到最大吸湿率,超过24 h吸湿率稍有下降。5%甘油和聚乙二醇400的吸湿率随时间增长而缓缓增大。1,3-丁二醇吸湿率在24 h时达到最大吸湿率,超过24 h,吸湿率略有下降,与在12 h时达到饱和的AGSL-P吸湿率相当。
无论在相对湿度43%环境中还是在75%环境中,AGSL-P-2的吸湿率都高于AGSL-P-1、AGSL-P及其他3种保湿剂。
2.5.2 AGSL-P与保湿剂的保湿性能比较操作同“2.5.1”项,把配制好的样品溶液分别放置在模拟环境相对湿度分别为43%和75%的干燥器中,20 ℃恒温,密封。12 h后称定质量,计算保湿率,连续放置48 h。保湿率=H1/H0,H0、H1为放置前后溶液中水分的质量。超过12 h后5%甘油、1,3-丁二醇、聚乙二醇400的保湿率随时间延长而缓慢降低,AGSL-P-2、AGSL-P-1、AGSL-P随时间延长而快速下降。48 h时保湿率大小为5%甘油>1,3-丁二醇>聚乙二醇400>AGSL-P-2>AGSL-P>AGSL-P-1。AGSL-P-2和AGSL-P保湿率相当。
从图 7可知,在相对湿度为75%环境中,在24 h时保湿率大小为5%甘油>1,3-丁二醇>AGSL-P>聚乙二醇400>AGSL-P-2>AGSL-P-1。在48 h时保湿率大小为5%甘油>聚乙二醇400>AGSL-P>AGSL-P-2>1,3-丁二醇>AGSL-P-1。各样品保湿率随着时间的延长而降低,5%甘油保湿率随时间增长而稍有下降。AGSL-P-2和AGSL-P、聚乙二醇400保湿率相当,比5%甘油略多下降一些。AGSL-P-1在12 h后保湿率快速下降至最低。1,3-丁二醇在24 h后保湿率快速下降,保湿率从仅次于5%甘油到仅高于AGSL-P-1。
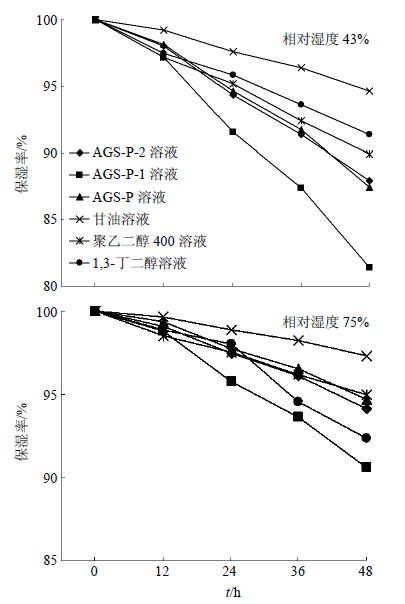 | 图 7 各样品保湿率随时间变化Fig. 7 Changes of moisture retention rate for each sample with time changing |
综合来看,AGSL-P-2不管在相对湿度为43%还是75%的环境中,保湿率都不是最高的,但是与常用保湿剂聚乙二醇400相比保湿率相当,说明AGSL-P-2保湿效果良好。
3 讨论通过球面对称设计优化和验证性试验确定了最佳闪式提取工艺为料液比1∶14.5,提取温度71 ℃,提取时间257 s,在此条件下AGSL-P的提取率为1.67%;另外,通过与传统提取方法比较,表明闪式提取法不仅节约时间和能源,而且在AGSL-P提取率上也优于回流提取法和超声提取法。闪式提取的原理是高速机械剪切力和超速动态分子渗滤作用[13],在一定的温度和溶剂条件下,将药材破碎成微粒,使待提成分迅速达到微粒组织的内外平衡,具有快速高效、操作方便、节能降耗等优点。
用Sevage法除蛋白质、过氧化氢溶液脱色、自来水和蒸馏水依次透析,除去大部分的非糖物质,然后采用DEAE-Sepharose Fast Flow柱色谱和葡聚糖凝胶G-75柱色谱进行纯化,首次从AGSL中分离得到均一单糖AGSL-P-1-1,经过IR和核磁共振检测结果推测,AGSL-P的单糖构型为α构型,可能含有葡萄糖、鼠李糖和半乳糖。
通过对AGSL-P、AGSL-P-1和AGSL-P-2保湿和吸湿性能进行初步研究,并以其与常用保湿剂(聚乙二醇400、1,3-丁二醇和5%甘油)在相对湿度为43%和75%条件下进行对比,表明AGSL-P-1和AGSL-P-2的吸湿能力优于常用保湿剂,AGSL-P-2保湿能力与常用保湿剂聚乙二醇400相当,也是一种优良的保湿剂,可对其进行进一步的开发研究。
| [1] | 刘向前, 陆昌洙, 张承烨. 细柱五加皮化学成分的研究[J]. . 中草药, 2004, 35(3): 250-252 |
| [2] | 涂正伟, 周渭渭, 单 淇, 等. 刺五加的研究进展 [J]. 药物评价研究, 2011, 34(3): 213-216. |
| [3] | 王金鹏, 陈寒青, 邓 力, 等. 刺五加多糖提取过程中不同脱蛋白方法的比较研究 [J]. 天然产物研究与开发, 2009, 21(1): 155-158. |
| [4] | 王松柏. 防风多糖的分离纯化及结构分析 [D]. 太原:山西大学, 2006. |
| [5] | 孟繁磊. 虎眼万年青和刺五加多糖的分离纯化、结构解析及活性研究 [D]. 长春: 长春师范学院, 2011. |
| [6] | 刘 霞, 丁常泽, 申湘忠. 五加皮多糖提取工艺的优化及其性能分析 [J]. 安徽农业科学, 2011, 39(6): 3294-3297. |
| [7] | 孟庆艳, 刘 圆, 彭镰心. 正交试验法筛选藏药红毛五加多糖的提取分离工艺 [J]. 西南大学学报: 自然科学版, 2007, 29(1): 122-125. |
| [8] | 王晶晶, 冯 颖, 孟宪军. 无梗五加多糖ASP-A的分离纯化及清除自由基研究 [J]. 食品科技, 2006, 31(6): 34-37. |
| [9] | 陈 永, 李 强, 谭晓晶, 等. 红毛五加多糖的基本性质研究 [J]. 天然产物研究与开发, 2004, 16(6): 507-510. |
| [10] | Valiyev K F, Kraiko A N. Cylindrically and sphericallysymmetrical rapid intense compression of an ideal perfect gas with adiabatic exponents from 1.001 to 3 [J]. J Appl Math Mech, 2011, 75(2): 218-226. |
| [11] | Gar Y K, Guixin C, Zhijun L. Purification of a water extract of Chinese Sweet Tea (Rubus suavissimus S. Lee) by alcohol precipitation [J]. J Agric Food Chem, 2009, 57(11): 5000-5006. |
| [12] | 马 莉, 唐健元, 李祖伦, 等. 板蓝根多糖分离纯化及其性质的研究 [J]. 中草药, 2007, 38(8): 1143-1146. |
| [13] | 祝士惠, 孙培冬, 李海洋. 画眉草多糖提取及其保湿性能研究 [J]. 天然产物研究与开发, 2013, 25(1): 83-86. |
| [14] | Shi S M, Liu Y Z, Tai W, et al. Smashing tissue extraction and HPLC determination of active saponins from different parts of Panax notoginseng [J]. Chin Herb Med, 2012, 4(4): 341-345. |
 2015, Vol. 46
2015, Vol. 46


