2. 中国科学院兰州化学物理研究所 中科院西北特色植物资源化学重点实验室, 甘肃 兰州 730000
2. Key Laboratory of Chemistry of Northwestern Plant Resources, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
植物在受到外界植食性昆虫等危害时,除了受害叶片会产生防御性物质外,有些植物的其他部位甚至整株都会系统性释放防御物质。植物这种诱导性防御作用的系统性特征已在多种植物-植食性昆虫系统中的不同类型的防御物质(如挥发性物质、烟碱等)上得到了证实[ 1,2 ]。研究显示,与乙烯和水杨酸类似,氧化脂类(oxylipins)亦是植物体内重要的内源性信号物质,在植物防御虫害过程中起关键作用[ 3 ]。豨莶草为多版《中国药典》中的常见中药,菊科植物豨莶Siegesbeckia orientalis L.、腺梗豨莶S. pubescens Makino和毛梗豨莶S. glabrescens Makino的地上部分均可作为中药豨莶草入药[ 4 ];主要分布于湖北、河南、甘肃等地,具有祛风湿、利筋骨、清热解毒、降血压等功能;临床上主要用于治疗四肢麻痹、高血压、风湿性关节炎等。然而,目前相关化学成分及药理活性研究多集中在二萜类和倍半萜类成分[ 5,6,7 ],对于其他活性成分研究少见报道,本研究针对豨莶草药材病虫害较少的特点,采用各种色谱分离方法对其中防御性次生代谢产物进行研究,结果从腺梗豨莶地上部分乙醇提取物的醋酸乙酯萃取部分中分离得到3个氧化脂类成分,分别鉴定为3-豆蔻酰氧基-2-异丁酰氧基-4-甲基戊酸[3-(myristoyloxy)-2-(isobutyloxy)-4-methylpentanoic acid,1]、3-豆蔻酰氧基-2-羟基-4-甲基戊酸 [3- (myristoyloxy)-2-hydroxy-4-methylpentanoic acid,2]、γ-十二烷基-α-羟基-γ-内酯(γ-dodecyl-α-hydroxy- γ-lactone,3)。结构见图 1。其中化合物1和2为新化合物,化合物3为首次从该植物中分离得到。
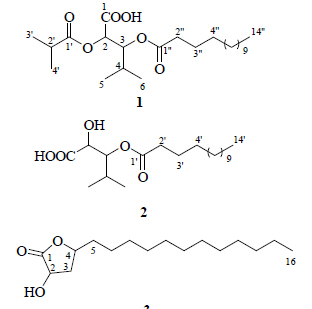 | 图 1 化合物1~3的结构Fig. 1 Structures of compounds 1—3 |
Varian INOVA-400 MHz超导核磁共振波谱仪(美国Varian公司);Bruker APEX II高分辨率电喷雾质谱仪(德国Bruker公司);VG ZABHS电子轰击电离源质谱(英国VG仪器公司);WFH-203(ZF-1)三用紫外分析仪(上海精科实业有限公司);METTLER-AE100电子分析天平(瑞士Mettler公司);柱色谱及薄层色谱硅胶(青岛海洋化工集团有限公司);所用溶剂为分析纯。
药材购买自兰州黄河药材市场,植物样品由中国科学院西北特色植物资源化学重点实验室戚欢阳副研究员鉴定为腺梗豨莶Siegesbeckia pubescens Makino,标本(ZY2007S001)保存于中国科学院兰州化学物理研究所甘肃省天然药物重点实验室。
2 提取与分离将腺梗豨莶地上部分9 kg粉碎后,用95%乙醇热回流提取3次,每次3 h,合并提取液,减压浓缩得总浸膏800 g,以水混悬,依次用石油醚、醋酸乙酯、正丁醇萃取,减压浓缩得各部分浸膏。取醋酸乙酯浸膏(120 g),经硅胶柱色谱分离,以石油醚-丙酮(30∶1→0∶1)进行梯度洗脱,根据薄层检测结果合并相同馏份,共得到7个组分:A(30∶1)、B(15∶1)、C(8∶1)、D(4∶1)、E(2∶1)、F(1∶1)、G(0∶1)。组分B经硅胶柱色谱,以石油醚-醋酸乙酯(30∶1)和石油醚-丙酮(30∶1)作为流动相反复洗脱,得到化合物3(8.2 mg)。组分C经硅胶柱色谱,以石油醚-醋酸乙酯(20∶1)为洗脱剂洗脱,得到3个部分C1~C3。C3部分以石油醚-醋酸乙酯-冰醋酸(30∶1∶0.1)和石油醚-丙酮-冰醋酸(30∶1∶0.1)为洗脱剂,经硅胶柱色谱反复分离,得到化合物1(22.0 mg)和2(16.5 mg)。
3 结构鉴定化合物1:无色油状物,10%磷钼酸-乙醇溶液喷雾加热后显蓝黑色。[α]20D -34° (c 0.4,丙酮),HR-ESI-MSm/z: 446.342 4 [M+NH4]+(C24H48O6N+,理论计算值为446.348 2),结合13C-NMR和DEPT谱可确定其分子式为C24H44O6,不饱和度为3。1H-NMR (400 MHz,CDCl3) δ: 10.92 (1H,s,COOH),5.25 (1H,d,J = 4.0 Hz,H-2),5.10 (1H,m,H-3),2.61 (1H,m,H-2″),2.30 (2H,t,J = 7.6 Hz,H-2′),2.14 (1H,m,H-4),1.59 (2H,m,H-3″),1.17 (3H,d,J = 7.2 Hz,H-3′),1.16 (3H,d,J = 7.2 Hz,H-4′),0.99 (3H,d,J = 6.4 Hz,H-5),0.90 (3H,d,J = 6.4 Hz,H-6),0.84 (3H,t,J = 7.2 Hz,H-14″);13C-NMR (100 MHz,CDCl3) δ: 175.9 (C-1′),173.2 (C-1″),173.1 (C-1),76.1 (C-3),71.3 (C-2),34.2 (C-2″),33.6 (C-2′),31.8 (C-12″),28.8 (C-4),24.8 (C-3″),22.6 (C-13″),18.9 (C-5),18.6 (C-3′),18.5 (C-4″),18.1 (C-6),14.0 (C-14″)。
1H-NMR谱显示有1个羧基活泼氢信号δH10.92 (1H,s)、2个连氧次甲基δH 5.25 (1H,d,J = 4.0 Hz),5.10 (1H,m)、1组长链结构特征信号、2个异丙基结构片段δH 2.61 (1H,m),1.17 (3H,d,J = 7.2 Hz),1.16 (3H,d,J = 6.8 Hz),2.14 (1H,m);0.99 (3H,d,J = 6.4 Hz),0.90 (3H,d,J = 6.4 Hz)。13C-NMR和DEPT谱显示有3个羰基信号δC 175.9,173.2,173.1,2个连氧次甲基信号δC 76.1,71.3,以及1组脂肪酸酯链特征信号δC173.2,34.2,31.8,24.8,22.6,14.0;由以上数据可初步推测其为1个长链脂肪酸酯类化合物。通过1H,1H-COSY相关(图 2)可以将2个连氧次甲基和其中1个异丙基结构片段连接起来。在HMBC谱中(图 2),羰基碳δC 175.9 (C-1′) 与H-2′ (δH 2.30)、H-3′ (δH 1.17) 及H-4′ (δH 1.16) 分别存在相关,证实了异丁酰氧基结构片段的存在;此外,连氧次甲基C-3与H-2 (δH 5.25),H-4 (δH 2.14),H-5 (δH 0.99) 和H-6 (δH 0.90) 之间均存在相关,且羧基碳δC173.1 (C-1) 与H-2 (δH 5.25) 和H-3 (δH 5.10) 之间存在相关,由此可推断该结构中存在1个含有2个连氧次甲基的4-甲基戊酸的结构片段。通过羰基碳δC 175.9 (C-1′) 与H-2之间的远程相关推断 该异丁酰氧基片段连接在C-2位;而δC 173.2 (C-1″) 与H-3之间存在远程相关,表明长链脂肪酸酯应连接于C-3位;结合质谱数据可推测该脂肪酸酯链上的碳原子个数为14。综上所述,该化合物结构被鉴定为3-豆蔻酰氧基-2-异丁酰氧基-4-甲基戊酸,为1个新的氧化脂类化合物,命名为豨莶脂A。
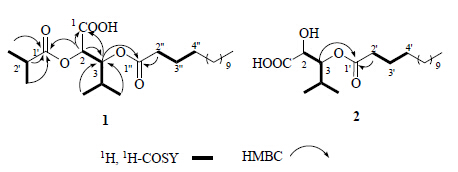 | 图 2 化合物1和2主要的1H,1H-COSY及HMBC相关Fig. 2 Key 1H,1H-COSY and HMBC correlations for 1 and 2 |
化合物2:无色油状物,5% H2SO4-乙醇溶液喷雾加热不显色,10%磷钼酸-乙醇溶液喷雾加热后显蓝黑色;[α]20D -36° (c 0.4,丙酮)。HR-ESI-MS m/z: 376.312 4 [M+NH4]+(C20H42O5N+,理论计算值为376.306 3),结合13C-NMR和DEPT谱可确定其分子式为C20H38O5,不饱和度为2。1H-NMR (400 MHz,CDCl3) δ: 4.89 (1H,m,H-3),4.38 (1H,d,J = 4.0 Hz,H-2),2.34 (2H,t,J = 7.2 Hz,H-2′),2.23 (1H,m,H-4),1.61 (2H,m,H-3′),0.98 (3H,d,J = 6.4 Hz,H-6),0.95 (3H,d,J = 6.8 Hz,H-5);13C-NMR (100 MHz,CDCl3) δ: 175.8 (C-1′),174.7 (C-1),79.6 (C-3),70.8 (C-2),34.3 (C-2′),31.9 (C-12′),28.4 (C-4),24.9 (C-3′),22.6 (C-13′),19.1 (C-6),17.9 (C-5),14.1 (C-14′)。
1H-NMR谱显示有2个连氧次甲基δH4.89 (1H,m),4.38 (1H,d,J = 4.0 Hz)、1组长链结构特征信号以及1个异丙基结构片段δH2.23 (1H,m),0.98 (3H,d,J = 6.4 Hz),0.95 (3H,d,J = 6.8 Hz);13C-NMR和DEPT谱显示有2个连氧亚甲基信号δC 79.6,70.8以及1组脂肪酸酯链的特征信号δC 175.8,34.3,31.9,24.9,22.6,14.1。通过与化合物1对比发现二者的NMR数据非常相似,二者的主要区别在于化合物2的结构中缺少了化合物1中的1个异丁酰基结构片段 δH 1.17,1.16 (6H,s);δH 2.61 (1H,m);δC 175.9,33.6,18.6和18.5。结合HMBC谱中酯羰基碳 (δC 175.8,C-1′) 与H-3 (δH 4.89) 和H-2′ (δH 2.34) 分别存在相关(图 2),推断长链脂肪酸酯形成于C-3位;结合质谱数据可推测该脂肪酸酯链上的碳原子个数为14。综上所述,该化合物的结构被确定为3-豆蔻酰氧基-2-羟基-4-甲基戊酸,命名为豨莶脂B,为1个新的氧化脂类化合物。
新化合物1和2的分子结构中均存在2个手性中心,在其立体构型确定过程中,本实验中未能获得适合单晶衍射实验分析用的单晶固体;并且由于样品量较少,通过化学结构改造的办法亦未能完成其相对构型及绝对构型的鉴定。
化合物3:白色粉末状固体,5% H2SO4-乙醇溶液喷雾加热后显紫色。EI-MS谱给出分子离子峰为m/z 270 [M]+和失水峰252 [M-H2O]+,结合13C-NMR和DEPT谱推测其分子式可能为C16H30O3,不饱和度为2。1H-NMR (400 MHz,CDCl3) δ: 4.65 (1H,m,H-4),4.51 (1H,t,J = 8.0 Hz,H-2),2.31 (2H,m,H-3),1.65 (2H,m,H-5),0.88 (3H,t,J = 6.9 Hz,H-16);13C-NMR (100 MHz,CDCl3) δ: 177.2 (C-1),78.7 (C-4),67.5 (C-2),35.7 (C-3),35.5 (C-5),14.1 (C-16)。1H-NMR谱显示有2个连氧次甲基δH4.65 (1H,m),4.51 (1H,t,J = 8.0 Hz)、1组长链结构特征信号,13C-NMR和DEPT谱显示有1个酯羰基信号δC177.2和2个连氧亚甲基信号δC 78.7,67.5,由此可初步推断该化合物为1个长链脂肪酸酯类化合物。经文献检索,发现其谱图数据与文献报道基本一致[ 8 ],故鉴定化合物3为γ-十二烷基-α-羟基-γ-内酯。该化合物为首次从该植物中分离得到,且作为一类良好的拒食活性成分,该类化合物引起了合成化学家的广泛关注。
| [1] | Kessler A, Baldwin I T. Plant response to insect herbivory: The emerging molecular analysis [J]. Annu Rev Plant Biol, 2002, 53(1): 299-328. |
| [2] | 徐 涛, 王建武, 骆世明. 玉米oxylipins信号途径关键基因的克隆及其在虫害诱导防御中的作用 [J]. 科学通报, 2005, 50(20): 2217-2225. |
| [3] | Li L, Li C Y, Lee G I, et al. Distinct roles for jasmonate synthesis and action in the systemic wound response of tomato [J]. Proc Natl Acad Sci USA, 2002, 99(9): 6416-6421. |
| [4] | 中国药典 [S]. 一部. 2010. |
| [5] | Xiang Y, Zhang H, Yue J M. Novel diterpenoids and diterpenoid glycosides from Siegesbeckia orientalis [J]. J Nat Prod, 2004, 67(9): 1517-1521. |
| [6] | 张 超, 吴素香, 楼招欢, 等. 豨莶草化学成分、药理作用及临床应用研究进展 [J]. 安徽医药, 2011, 15(3): 274-276. |
| [7] | Xiong J, Ma Y B, Xu Y L. Diterpenoids from Siegesbeckia pubescens [J]. Phytochemistry, 1992, 31(7): 917-921. |
| [8] | Nakano T, Ino Y, Nagai Y A. Convenient synthesis of γ-alkyl-α-hydroxy-γ-lactones as a food intake-control substance [J]. Chem Lett, 1989, 18(4): 567-568. |
 2015, Vol. 46
2015, Vol. 46

