2. 中国科学院大连化学物理研究所, 辽宁 大连 116023
2. Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China
葡萄糖醛酸结合反应是一种重要的II相代谢消除途径,负责多种外源和内源性化合物的代谢清除[1, 2, 3, 4]。葡萄糖醛酸结合反应在多种药物及其氧化代谢产物、环境毒物、内源性激素、胆酸和胆红素的代谢清除中发挥着重要作用。此类反应中,葡萄糖醛酸转移酶(UDP-glucuronosylatransferase,UGT,EC2.4.1.17)将葡萄糖醛酸从尿苷二磷酸(UDP)葡萄糖醛酸(UDPGA)转移到底物的亲核基团上,生成相应的葡萄糖醛酸苷产物(图1)[3]。UGT酶介导的葡萄糖醛酸结合反应类型依照葡萄糖醛酸受体的不同可分为O-葡萄糖醛酸化、N-葡萄糖醛酸化、S-葡萄糖醛酸化和C-葡萄糖醛酸化四大类。其中O-葡萄糖醛酸化是 最常见的反应类型,还可依据底物类别的不同分为醇羟基、酚羟基、羧基的O-葡萄糖醛酸化。
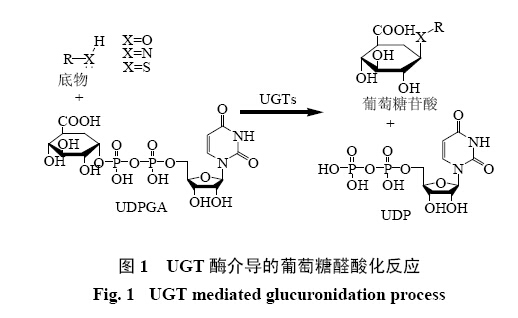 | 图 1 UGT酶介导的葡萄糖醛酸化反应Fig.1 UGT mediated glucuronidation process |
UGT是一个蛋白质超家族,在动物体内主要分布于肝脏、肠道、肾脏等组织的细胞内质网上。人体内的UGT主要包括UGT1和UGT2两大家族,目前已报道的亚型有19个(UGT1A1、1A3、1A4、1A5、1A6、1A7、1A8、1A9、1A10、2A1、2A2、2A3、2B4、2B7、2B10、2B11、2B15、2B17、2B28)[4]。
据统计,UGT参与了40%~70%的临床药物及其I相代谢产物的体内代谢,其中绝大部分临床用药的葡萄糖醛酸结合代谢由UGT1A1、1A4、1A9和2B7参与完成。除此之外,UGT还参与了大量中药活性成分(如黄酮类、香豆素类、儿茶酚类及生物碱类),非药外源性物质(如啤酒中的黄腐酚等食品化学成分、尼古丁等环境毒物),以及内源性物质(如胆红素、胆汁酸、羟甾类激素等)等结构多样性化合物的体内代谢。
多数底物经UGT代谢后,在机体内转变为相应的葡萄糖醛酸结合物(表1),值得注意的是,一些葡萄糖醛酸代谢产物较底物具有更强的药理活性,例如麻醉剂吗啡,在UGT2B7的催化下能够发生6-O-和3-O-葡萄糖醛酸结合代谢,其中6-O-葡萄糖醛酸结合物的麻醉效果是吗啡的100倍[5],而3-O-葡萄糖醛酸结合物却具有中枢兴奋作用。降胆固醇药S-8921,其葡萄糖醛酸结合物的药效活性是原型药物的6 000倍[6]。
| 表 1 具有活性的O-葡萄糖醛酸苷代谢产物 Table 1 Active metabolites of O-glucuronides |
近年来随着对药物代谢及药物代谢产物的深入研究,国内外新药研发人员对O-葡萄糖醛酸苷的药理活性、安全性及成药特征等研究更加重视。但上述研究一直受限于O-葡萄糖醛酸苷的规模化制备,如何高效制备O-葡萄糖醛酸苷已成为新药研发领域面临的一大难题。虽然在特定催化剂的作用下可采用化学合成手段将葡萄糖醛酸供体和不同受体相连接并合成相应的O-葡萄糖醛酸苷,如经典的柯尼希斯-克诺尔反应(Koenigs-Knorr reaction),使用溴苷作为葡萄糖酸的给体,在银盐(Ag2O、AgClO4、Ag2CO3)、Hg(CN)2、CdCO3等催化剂催化下合成O-葡萄糖醛酸苷[12]。然而化学合成通常反应条件较为苛刻,且需要多步保护和脱保护,目标物的总产率普遍不高,中间体和目标物的后处理步骤往往繁琐,在制备成本及合成效率上都无法令人满意[13, 14]。利用生物方法制备O-葡萄糖醛酸苷具有转化效率高、选择性高、工艺条件简单、温和、副产物少、产物后处理易操作等优点,在近年来日益受到青睐。本文就近年来利用不同酶源制备O-葡萄糖醛酸苷的研究进展进行简要综述,原理如图2所示。
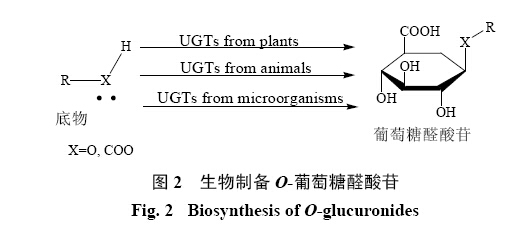 | 图 2 生物制备O-葡萄糖醛酸苷Fig.2 Biosynthesis of O-glucuronides |
许多植物细胞中都分布有UGT,其通常参与催化植物次生代谢的最后一步,即将葡萄糖醛酸糖基从供体UDPGA上转移至底物(如黄酮)的酚羟基上。O-葡萄糖醛酸化使植物的次生代谢产物具有
更好的溶解度和化学稳定性,同时表现出更低的毒性,以便于其在细胞内的储存和累积。植物中的UGT分布广泛,仅拟南芥Arabidopsis thaliana (L.) Heynh. 中就发现了107个UGT的编码基因[15]。植物中广泛存在的UGT也造就了形形色色的天然O-葡萄糖醛酸苷化合物,如黄酮类、三萜类的O-葡萄糖醛酸苷在多种高等植物中大量存在且在植物组织中的量较为丰富。这些O-葡萄糖醛酸苷作为植物体内广泛存在的次生代谢产物(图3和表2),不仅可抵御病原菌对植物的侵入,还参与植物内 源性激素的代谢平衡,进而对植物的生理生态功能发挥着重要调节作用。
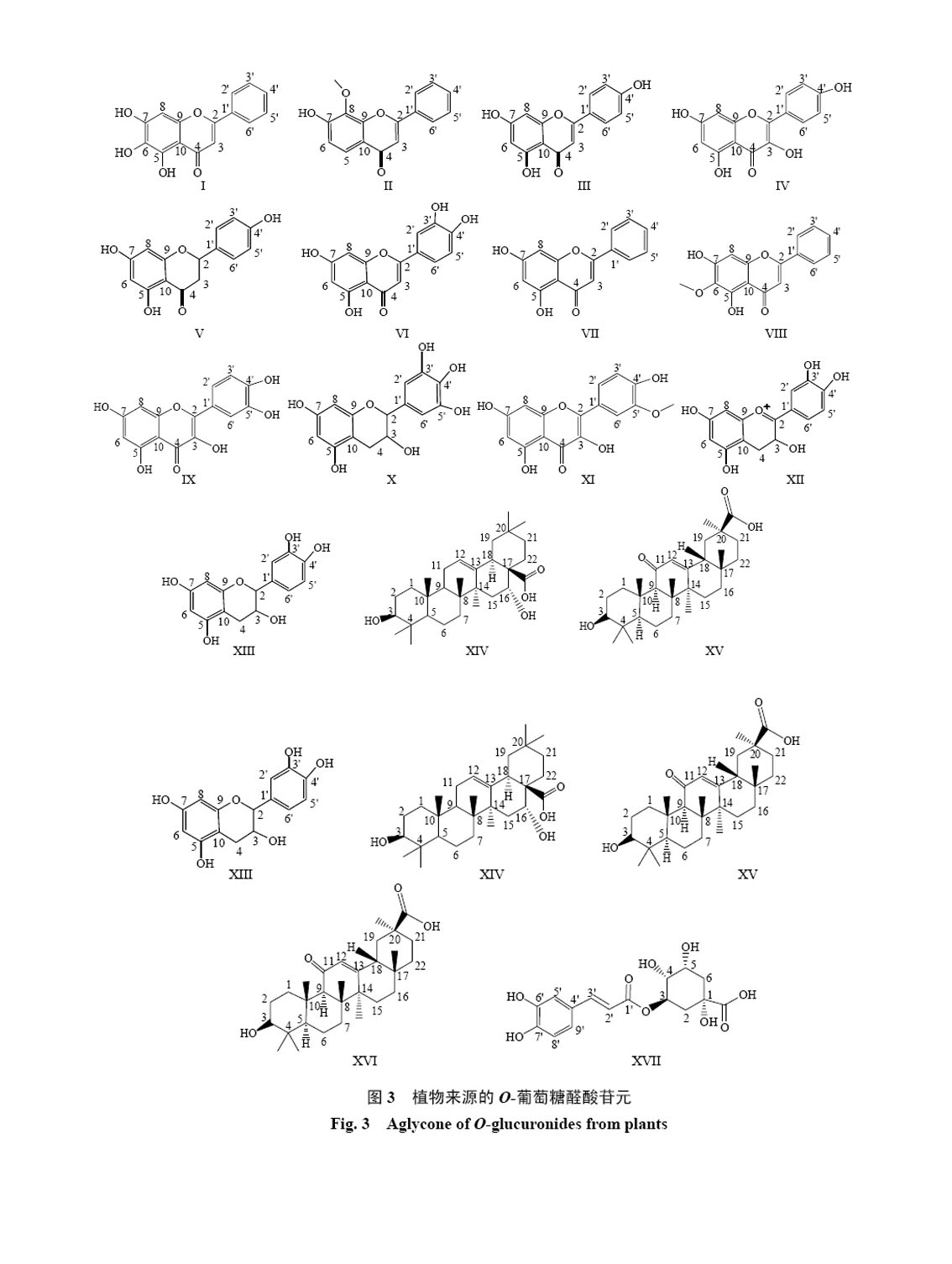 | 图 3 植物来源的O-葡萄糖醛酸苷元Fig.3 Aglycone of O-glucuronides from plants |
| 表 2 植物来源的O-葡萄糖醛酸苷 Table 2 O-Glucuronides from plants |
UGT介导的O-葡萄糖醛酸化使产物的理化性质完全不同于其配基(水溶性及电负性更强),利用理化性质上的差异可较容易地从植物提取物或植物细胞培养液中将O-葡萄糖醛酸苷分离纯化,且收率较高。因此,借助植物次生代谢合成已成为获取目标O-葡萄糖醛酸苷的一种重要方法。近年来,随着分子生物学与结构生物学相关技术的快速发展,许多参与黄酮类及三萜类O-葡萄糖醛酸化代谢的植物UGT得以深入研究,其编码基因、氨基酸序列及其晶体结构、底物选择性和催化活性特征都已被系统研究和报道[41]。例如,拟南芥中的UGT73C6、UGT74F2、UGT75C1及UGT78D1,以及蒺藜苜蓿Medicago truncatula Gaertn中的UGT71G1对槲皮素和山柰酚等黄酮类化合物的O-葡萄糖醛酸化代谢显示了良好的催化活性。此外,UGT74F2参与了水杨酸的O-葡萄糖醛酸化[42],UGT75C1介导了花青素的5-O-葡萄糖醛酸化[43],而苜蓿属植物中的UGT72L1则参与了表儿茶酸3′-O-葡萄糖醛酸化[44]。这些研究不仅对于了解植物体内次生代谢产物的生物合成网络具有重要意义,也对动物和人体UGT的结构特征、底物偏好性和催化属性等研究具有一定指导意义。
2 动物UGT制备O-葡萄糖醛酸苷许多药物及其I相代谢产物的O-葡萄糖醛酸苷是经过人体(动物)UGT催化后产生的代谢产物,可通过动物组织中的UGT催化制备获得[45]。与植物相比,UGT在动物组织中的分布更为广泛,且功能与人体UGT更为接近。部分UGT同工酶在大鼠、小型猪等常用实验动物体内的表达量和功能还高于人体组织,显示出对底物更强的催化能力。许多药物、中药活性成分及食品成分在动物和人体内有相似的代谢产物谱,因此借助动物UGT制备相应的代谢产物对于新药研发意义重大。近年来,随着体外UGT代谢研究的深入,利用动物组织中分布的UGT及重组表达的人源UGT制备O-葡萄糖醛酸苷已成为获取O-葡萄糖醛酸苷最直接的途径。体外模拟葡萄糖醛酸化过程需要UDPGA作为辅因子,同时还需要加入特定的酶源,通过优化反应条件可实现目标代谢物的高效制备,部分底物的转化率和产物的收率可接近100%。依据来源形式的不同动物UGT可分为以下3种:1)动物组织中分离纯化的UGT单酶;2)动物组织制备物(主要是肝脏微粒体);3)重组UGT单酶。
2.1 UGT的分离纯化早期为了方便进行工业化和实验室规模制备O-葡萄糖醛酸苷,利用分离纯化得到的UGT单酶进行O-葡萄糖醛酸反应。从20世纪50年代开始,UGT的分离纯化得到了迅速发展。Isselbacher等[46]报道了从兔肝脏微粒体中将UGT进行部分分离纯化,得到了具有p-硝基苯酚葡萄糖醛酸化的混合酶,但是由于UGT的磷脂依赖性及不稳定性,并未得到纯化的单酶。Falany等[47]从小鼠肝脏中分离得到3种UGT亚型,相对分子质量分别为56 000、50 000及52 000,这3种单酶分别具有对p-硝基苯酚、1-萘醇及4-甲基伞形酮的O-葡萄糖醛酸化能力,睾酮、β-雌二醇的17位羟基的葡萄糖醛酸化能力,以及p-硝基苯酚、1-萘醇、雄酮和苯胆烷醇酮的葡萄糖醛酸化能力,并首次报道分离纯化得到具有3-OH葡萄糖醛酸活性的UGT亚型。Irshaid等[48]将人肝溶于表面活性剂Emulgen 911中,通过UDP-Hexanolamine-Sepharose 4B亲和色谱进行分离,得到相对分子质量分别为53 000及54 000的2个人源化的UGT,其中相对分子质量为53 000的单酶具有p </ i>;-硝基苯酚、4-甲基伞形酮及雌三醇的葡萄糖醛酸化能力;而相对分子质量为54 000的单酶只具有p-硝基苯酚、4-甲基伞形酮的O-葡萄糖醛酸化活性,对雌三醇没有作用。此外,从内质网上分离UGT的过程中需要使用大量表面活性剂,如Burchell等[49]使用非离子型表面活性剂Lubrol PX及Falany等[47]使用Emulgen 911将内质网溶解,然后使用阴离子 交换 色谱去除 酶溶液的表面活性剂,经UDP-Hexanolamine-Sepharose4B亲和色谱分离提高分离效率,进一步使用聚焦色谱或等点聚焦色谱进行纯化,最后用SDS-PAGE进行定性分析。虽然单酶有利于反应产物的后续纯化,但仍然由于UGT的磷脂依赖性等问题,许多UGT在分离纯化后活性难以保障且稳定性较差,后续生物转化应用时也存在诸多问题。
2.2 动物组织制备物 2.2.1 肝脏微粒体 动物组织由于廉价易得,以及UGT的分布和活性较高等特点,在生物制备O-葡萄糖醛酸苷的应用中备受青睐。目前,动物肝脏微粒体是生物制备O-葡萄糖醛酸苷的主要酶源。虽然UGT在组织如肾脏和肠道中也有表达,但是肝脏中许多UGT亚型(1A1、1A3、1A4、1A6、1A9、2B4、2B7、2B10、2B11、2B15和2B17)的表达量更高,因此常选用动物肝脏微粒体作为O-葡萄糖醛酸反应的酶源。值得注意的是,UGT各亚型的表达和功能存在显著的种属差异,针对不同底物需筛选最优酶源并优化其反应条件以实现葡萄糖醛酸代谢物的高效生物合成。例如,不同种属动物肝微粒体对胡黄连的O-葡萄糖醛酸化能力差异表现为小鼠>大鼠>人>狗,而对黄芩素7-O-葡萄糖醛酸化及6-O-葡萄糖醛酸化的能力均表现为小型猪>大鼠>猴>狗>人。动物肝脏微粒体由新鲜肝脏匀浆后离心制得,具有稳定好、与人肝微粒体催化功能(包括代谢位点和催化效率)相似度高、活性好且易于获得等优点。鼠肝微粒体(RLM)及猪肝微粒体(PLM)是常用的酶源。但有时直接使用动物微粒体制备目标产物的收率仍偏低,此时可以考虑使用UGT的诱导剂提高UGT的表达水平,进而提高肝微粒体对底物的转化效率。常用的诱导剂有氯化联苯诱导剂(Aroclor 1254和3-甲基胆蒽)。表3中列举了用动物肝微粒作为酶源生物合成的O-葡萄糖醛酸苷。
2.2.2 固定化酶(微粒体) 酶或微粒体的固定化有利于产物与蛋白的分离,便于后期分离纯化,并且固定化后可以改善酶的稳定性,提高酶的利用效率。固定化酶的载体可选用海藻酸钠、琼脂或者以微粒体固定化人工膜(IAM)作为填料的液相色谱、多孔纤维膜及固相萃取柱(SPE)等[57]。例如,使用固定化狗肝微粒体的SPE柱可用于制备甲芬纳酸和雌二醇的O-葡萄糖醛酸苷产物。使用IAM固定化肝微粒载体时,其带有半透膜的反应室可以截留大于1×104的物质,因此底物可以6 mL/h的速度通过反应室,且反应可持续20 h,转化率可达95%。虽然固定化酶(微粒体)的可重复率优于游离酶(微粒体),然而其活性的重现性较差,因此增加了制备过程中的不稳定因素。 2.3 重组人源UGT虽然动物组织制备物可用于葡萄糖醛酸苷的合成,但需要消耗动物资源,且种属及个体差异常导致反应批次间的稳定性差,极大地阻碍了其规模化制备O-葡萄糖醛酸苷的应用。因此,发展可持续利用的、质量可控的UGT酶源对O-葡萄糖醛酸苷的规模制备极其关键。在细菌或昆虫细胞中重组表达动物UGT是葡萄糖醛酸代谢研究领域的突破性进展。
| 表 3 肝脏微粒体生物制备O-葡萄糖醛酸苷 Table 3 Biosynthesis of O-glucuronides with liver microsomes |
在哺乳动物细胞中异源表达人源UGT时,可以选择如COS、V79、HEK293作为UGT的受体细胞。此外,大肠杆菌E. coli及带有组氨酸标签的杆状病毒感染的昆虫细胞系统均可作为UGT的表达系统[45, 58]。
此外,重组UGT的应用范围取决于其催化底物的特异性。例如,UGT1A1、1A7、1A9和1A10用于催化去甲基萘普生的芳香基或烷基葡萄糖醛酸化反应,而UGT1A3、1A6和2B7只催化烷基葡萄糖醛酸化反应。通过对重组UGT选择性催化生成morphine-3-O-glucuronide(M3G)和morphine-6-O- glucuronide(M6G)的动力学研究表明UGT1A1、1A3、1A6、1A8、1A9、1A10及2B7均可催化形成M3G,但是只有UGT2B7具有M6G的催化活性。用8种重组的人源UGT对13种黄酮类化合物(7个黄酮、6个黄酮醇,均在C-3、C-4′、C-5和C-7位有羟基)进行葡萄糖醛酸化反应的结果表明:UGT1A3和1A7分别对7-O位和3-O位具有葡萄糖醛酸化能力,而UGT1A8和1A9对7-O位的选择性优于3-O位,其他重组UGT没有表现出明显的位置偏好性。胆酸的葡萄糖醛酸化中UGT1A3对羧基有选择性,而UGT1A4对3α-羟基有选择性。UGT2B7的2个等位基因亚型对羧基及羟基具有葡萄糖醛酸化功能,其中3α位更易发生反应。
此外,为了克服传统辅因子UDPGA非常昂贵的问题,近年来,全细胞生物转化系统用于原位催化生成UDPGA[59, 60]。此技术中应用裂殖酵母S. pombe作为重组UGT的宿主菌,共表达人源葡萄糖脱氢酶(UGDH)产生辅因子UDPGA,最终可高效获得O-葡萄糖醛酸苷(图4)[61, 62]。同时,此系统也可用于制备同位素标记的葡萄糖醛酸苷。
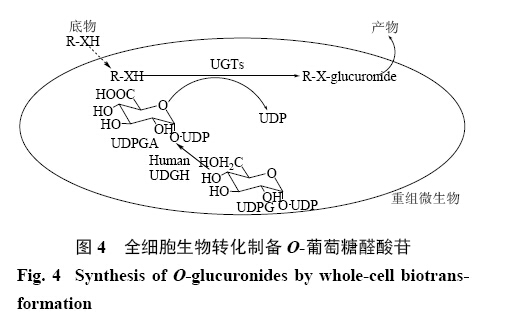 | 图 4 全细胞生物转化制备O-葡萄糖醛酸苷Fig.4 Synthesis of O-glucuronides by whole-cell biotrans- formation |
微生物发酵法是生物制备O-葡萄糖醛酸苷的另一方向。获得可具有葡萄糖醛酸化能力的高产菌株是微生物发酵制备O-葡萄糖醛酸苷的关键因素,然而相关报道并不多。目前主要集中在抗肿瘤药物的O-葡萄糖醛酸苷的微生物发酵制备。例如,Briggs等[61]首次报道了1株具有O-葡萄糖醛酸化雷洛昔芬(raloxifene)能力的链霉菌(Streptomyces sp NRRL 21489),可产生3种O-葡萄糖醛酸化产物(raloxifene-27-glucuronide、raloxifene-6-glucuronide、raloxifene-6,27-glucuronide)。Marvalin等[62]发现了1株链霉菌(Streptomyces sp. strain M52104),可转化普萘洛尔生成β-O-葡萄糖醛酸化产物;Cacsinelli等[63]报道了S. peucetius var vinaceus NRRL 15344和S. peucetius var castaneus NRRL 15345两株菌可分别产生紫红霉酮和阿克拉霉素的O-葡萄糖醛酸化产物。Marvalin等[64]还报道了1株链霉菌可完成咪达唑仑的O-葡萄糖醛酸化,生成1′-羟基咪达唑仑-O-葡萄糖醛酸苷。
另一方面,由于基因工程的迅速发展,基因突变得到的工程菌也越来越得到重视[65, 66]。Wilkinson等[65]将大肠杆菌β-葡萄糖醛酸苷酶(EC 3.2.1.31)基因突变获得糖苷合成酶。糖苷合成酶可在温和条件下一步反应生成O-葡萄糖醛酸苷,过程更为简便,且利于规模化。通过对葡萄糖醛酸苷酶的一个关键残基的突变,即将谷氨酸504(E504)位点突变成非亲核性甘氨酸(E504G)、丙氨酸(E504A)、或者丝氨酸(E504S)残基,使得葡萄糖醛酸苷的糖苷键无法水解,同时,此糖苷合成酶可以催化氟取代的α-葡萄糖醛酸和醇的底物生成系列葡萄糖醛酸苷。尽管目前采用微生物发酵法制备O-葡萄糖醛酸苷研究较少,但由于此方法可获得足量的O-葡萄糖醛酸苷,因此筛选及构建高产微生物菌株将成为生物制备O-葡萄糖醛酸苷的主要方向。
4 结语与展望O-葡萄糖醛酸苷是药物在生物体内代谢的最终产物,近年来在生命过程中的作用越来越受到人们重视,而且对它的制备也日益关注。传统的化学合成普遍收率不高,且过程繁琐,因此生物(酶)法获得O-葡萄糖醛酸苷成为新的研究方向。目前肝微粒体作为主要的酶源用于O-葡萄糖醛酸苷的制备,但只局限于实验室少量规模。随着蛋白重组表达的深入开展,构建高效的重组人源化UGT表达系统及获得UGT的高产菌株,提高生物转化效率及酶的反复利用率,将是今后生物法制备O-葡萄糖醛酸苷的发展趋势。
| [1] | Obach R. Pharmacologically active drug metabolites: impact on drug discovery and pharmacotherapy [J]. Pharmacol Rev, 2013, 65(2): 578-640. |
| [2] | Harbourt D, Fallon J, Ito S, et al. Quantification of human uridine-diphosphate glucuronosyl transferase 1A isoforms in liver, intestine, and kidney using nanobore liquid chromatography-tandem mass spectrometry [J]. Anal Chem, 2012, 84(1): 98-105. |
| [3] | Yang G, Zhu L, Lv X, et al. Highly efficient preparation of bisphenol A glucuronide [J]. Chem J Chin Univ, 2014, 35(2): 314-318. |
| [4] | Zhu L, Ge G, Liu Y, et al. Characterization of UDP-glucuronosyltransferases involved in glucuronidation of diethylstilbestrol in human liver and intestine [J]. Chem Res Toxicol, 2012, 25(12): 2663-2669. |
| [5] | Kilpatrick G, Smith T. Morphine-6-glucuronide: actions and mechanisms [J]. Med Res Rev, 2005, 25(5): 521-544. |
| [6] | Trellu M, Filali-Ansary A, Françon D, et al. New metabolic and pharmacokinetic characteristics of thiocolchicoside and its active metabolite in healthy humans [J]. Fundam Clin Pharmacol, 2004, 18(4): 493-501. |
| [7] | Brown S, Holtzman M, Kharasch E. Buprenorphine metabolites, buprenorphine-3-glucuronide and norbuprenorphine-3-glucuronide, are biologically active [J]. Anethesiology, 2011, 115(6): 1251-1260. |
| [8] | Natsume M, Osakabe N, Yasuda A, et al. In vitro antioxidative activity of (-)-epicatechin glucuronide metabolites present in human and rat plasma [J]. Free Radic Res, 2004, 38(12): 1341-1348. |
| [9] | Yamamoto M, Jokura H, Hashizume K, et al. Hesperidin metabolite hesperetin-7-O-glucuronide, but not hesperetin-3'-O-glucuronide, exerts hypotensive, vasodilatory, and anti-inflammatory activities [J]. Food Funct, 2013, 4(9): 1346-1351. |
| [10] | Shirai M, Moon J H, Tsushida T, et al. Inhibitory effect of a quercetin metabolite, quercetin 3-O-beta-D-glucuronide, on lipid peroxidation in liposomal membranes [J]. J Agric Food Chem, 2001, 49(11): 5602-5608. |
| [11] | Kurata H, Suzuki S, Ohhata Y, et al. A novel class of apical sodium-dependent bile acid transporter inhibitors: the amphiphilic 4-oxo-1-phenyl-1, 4-dihydroquinoline derivatives [J]. Bioorg Med Chem Lett, 2004, 14(5): 1183-1186. |
| [12] | 朱向明, 俞 飙, 惠永正. 葡萄糖醛酸苷的合成研究进展 [J]. 有机化学, 2000, 20(2): 146-454. |
| [13] | Wimmer Z, Pechová L, Ŝaman D. Koenigs-Knorr synthesis of cycloalkyl glycosides [J]. Molecules, 2004, 9(11): 902-912. |
| [14] | Reiss P, Burnett D, Zaks A. An enzymatic synthesis of glucuronides of azetidinone-based cholesterol absorption inhibitors [J]. Bioorg Med Chem, 1999, 7(10): 2199-2202. |
| [15] | Li Y, Baldauf, S, Lim E, et al. Phylogenetic analysis of the UDP-glycosyltransferase multigene family of Arabidopsis thaliana [J]. J Biol Chem, 2001, 276(6): 4338-4343. |
| [16] | Kovács G, Kuzovkina I, Szőke É, et al. HPLC determination of flavonoids in hairy-root cultures of Scutellaria baicalensis Georgi [J]. Chromatographia, 2004, 60(1): S81-S85. |
| [17] | Liu G, Ma J, Chen Y, et al. Investigation of flavonoid profile of Scutellaria bacalensis Georgi by high performance liquid chromatography with diode array detection and electrospray ion trap mass spectrometry [J]. J Chromatogr A, 2009, 1216(23): 4809-4814. |
| [18] | 王 丽, 马 远, 陈随清. 构树叶中牡荆素、芹菜素-7-O-β-D-吡喃葡萄糖醛酸苷的含量测定 [J]. 安徽农业科学, 2011, 39(35): 21647-21649. |
| [19] | Nielsen S, Young J, Daneshvar B, et al. Effect of parsley (Petroselinum crispum) intake on urinary apigenin excretion, blood antioxidant enzymes and biomarkers for oxidative stress in human subjects [J]. Br J Nutr, 1999, 81(6): 447-455. |
| [20] | Calderón-Montaño J, Burgos-Morón E, Pérez-Guerrero C, et al. A review on the dietary flavonoid kaempferol [J]. Mini Rev Med Chem, 2011, 11(4): 298-344. |
| [21] | Chen A, Chen Y. A review of the dietary flavonoid, kaempferol on human health and cancer chemoprevention [J]. Food Chem, 2013, 138(4): 2099-2107. |
| [22] | 孙国玲, 钱大玮, 段金廒, 等. 大鼠灌胃毛橘红醇提物血浆中柚皮苷、柚皮素及其代谢产物液质分析 [J]. 中国中药杂志, 2010, 35(12): 1580-1585. |
| [23] | 袁旭江, 林 励, 陈志霞. 化橘红中酚性成分的研究 [J]. 中草药, 2004, 35(5): 498-500. |
| [24] | O'Leary K, Day A, Needs P, et al. Flavonoid glucuronides are substrates for human liver beta-glucuronidase [J]. FEBS Lett, 2001, 503(1): 103-106. |
| [25] | López-Lázaro M. Distribution and biological activities of the flavonoid luteolin [J]. Mini-rev Med Chem, 2009, 9(1): 31-59. |
| [26] | Horvath C, Martos P, Saxena P. Identification and quantification of eight flavones in root and shoot tissues of the medicinal plant huang-qin (Scutellaria baicalensis Georgi) using high-performance liquid chromatography with diode array and mass spectrometric detection [J]. J Chromatogr A, 2005, 1062(2): 199-207. |
| [27] | Yuldashev M, Batirove É, Malikov V. Flavonoids of the roots of Scutellaria comosa [J]. Chem Nat Compd, 1996, 32(4): 592-593. |
| [28] | Choudhury S, Datta S, Talukdar A, et al. Phytochemistry of the family bignoniaceae-A review [J]. Assam Univ J Sci Technol: Biol Envir Sci, 2011, 7(1): 145-150. |
| [29] | 温华珍, 肖盛元, 王义明, 等. HPLC法测定不同规格并头黄芩的黄芩苷和汉黄芩苷含量 [J]. 中草药, 2005, 36(4): 600-602. |
| [30] | Li T, Peng T. Traditional Chinese herbal medicine as a source of molecules with antiviral activity [J]. Antivir Res, 2013, 97(1): 1-9. |
| [31] | Derlindati E, DallAsta M, Ardigò D, et al. Quercetin-3-O-glucuronide affects the gene expression profile of M1 and M2a human macrophages exhibiting anti-inflammatory effects [J]. Food Funct, 2012, 3(11): 1144-1152. |
| [32] | Granica S, Piwowarski J, Poplawska M, et al. Novel insight into qualitative standardization of Polygoni avicularis herba (Ph. Eur.) [J]. J Pharm Biomed Anal, 2013, 72: 216-222. |
| [33] | Natsume M, Osakabe N, Oyama M, et al. Structures of (-)-epicatechin glucuronide identified from plasma and urine after oral ingestion of (-)-epicatechin: differences between human and rat [J]. Free Radic Biol Med, 2003, 34(7): 840-849. |
| [34] | Yang H, Hwangbo K, Zheng M, et al. Quercetin-3-O-β-D-glucuronide isolated from Polygonum aviculare inhibits cellular senescence in human primary cells [J]. Arch Pharm Res, 2014, doi: 10.1007/s12272-014-0344-2. |
| [35] | Sultana N, Ata A. Oleanolic acid and related derivatives as medicinally important compounds [J]. J Enzym Inhib Med Chem, 2008, 23(6): 739-756. |
| [36] | Eddouks M, Chattopadhyay D. Phytotherapy in the Management of Diabetes and Hypertension [M]. Bentham: Science Publishers, 2012. |
| [37] | Fu B, Liu J, Li H, et al. The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid [J]. J Chromatogr A, 2005, 1089(1/2): 18-24. |
| [38] | Lin J. Mechanism of action of glycyrrhizic acid in inhibition of Epstein-Barr virus replication in vitro [J]. Antiv Res, 2003, 59(1): 41-47. |
| [39] | Huang M, Smart R, Wong C, et al. Inhibitory effect of curcumin, chlorogenic acid, caffeic acid, and ferulic acid on tumor promotion in mouse skin by 12-O-tetradecanoylphorbol-13-acetate [J]. Cancer Res, 1988, 48(21): 5941-5946. |
| [40] | Clifford M. Chlorogenic acids and other cinnamates-nature, occurrence and dietary burden [J]. J Sci Food Agric, 1999, 79(3): 362-372. |
| [41] | Wang X. Structure, mechanism and engineering of plant natural product glycosyltransferases [J]. FEBS Lett, 2009, 583(20): 3303-3309. |
| [42] | Dean J, Delaney S. Metabolism of salicylic acid in wild-type, ugt74f1 and ugt74f2 glucosyltr |
 2015, Vol. 46
2015, Vol. 46


