2. 广西高校生物分子医学研究重点实验室, 广西 南宁 530021
2. Key Laboratory of Biological Molecular Medicine Research of Guangxi High Education, Guangxi Medical University, Nanning 530021, China
三萜皂苷是一类重要的植物次生代谢产物,广泛分布于植物组织中,具有抗菌和抗虫害的作用,可以用作药物,具有重要的商业价值[1]。例如,人参皂苷是人参的主要活性成分之一,其各单体成分普遍具有调节免疫系统、降低血清中胆固醇的量、防治心血管疾病、抗炎、解毒、抗癌等生理功效[2]。研究表明,三萜皂苷合成途径中的一些关键酶对组织中三萜皂苷的量和组成具有重要的调节作用[3]。鲨烯合酶(squalene synthase,EC 2.5.1.21,简称SS)是三萜类化合物生物合成途径中的一个重要调控酶[4]。SS能催化2分子的法呢基焦磷酸(farnesyl pyrophosphate,FPP)缩合生成1分子鲨烯,是三萜、甾醇、胆固醇等萜烯类重要物质生物合成的共同前体[5]。因此,SS的研究对了解三萜皂苷合成途径具有重要的参考价值。目前,三萜生物合成通路关键酶SS的基因克隆、进化分析已有相关报道,如陆生植物SS适应性进化正选择位点分析[6],绞股蓝鲨烯环氧酶基因的克隆与序列分析[7],以及人参、金铁锁、青蒿、丹参[8, 9, 10, 11, 12, 13]等。葫芦科植物三萜生物合成通路关键酶SS基因序列在GenBank中已收录的目前只有罗汉果(HQ128565)和绞股蓝(FJ906799)。
红花栝楼Trichosanthes rubriflos Thoms. ex Cayla为葫芦科(Cucurbitaceae)栝楼属Trichosanthes L. 植物,具有一定的药用价值,国内主要分布在广东、广西、贵州等省区,国外主要分布于印度东北部、缅甸、泰国等地区。根据《中国药典》2010年版所收载,中药瓜蒌的植物基原是葫芦科植物栝楼Trichosanthes kirilowii Maxim.及双边栝楼Trichosanthes rosthornii Harms的干燥成熟果实,而红花栝楼等其他栝楼属植物的果实则是混杂品。但也有一些本草记载,红花栝楼的根部也可药用,其味甘、微苦,性寒,有小毒;主要功能为清肺化痰、解毒散结;主肺热咳嗽、胸闷胸痛、便秘、疟疾、疮疖肿毒[14]。有研究表明,在栝楼属植物中可分离得到葫芦素[15],但有关红花栝楼的研究仍未见报道,亦未知是否含有葫芦素。SS是三萜合成通路关键酶,因此红花栝楼SS基因序列的克隆分析对了解其三萜生物合成通路具有重要意义。
cDNA末端快速扩增技术(rapid amplificatiion of cDNA ends,RACE)是一种始于mRNA的3’或5’端,最终获得目的基因全长cDNA的分子生物学技术[16]。本课题组已运用RACE技术成功克隆出了绞股蓝SS、SE、FPS等基因[7, 17],现继续运用该技术对红花栝楼三萜合成途径关键酶SS基因进行克隆及分析。
1 材料与方法 1.1 材料与试剂样品于2013年9月采集自广西南宁市广西中医药大学药圃。经广西中医药大学朱意麟讲师鉴定为红花栝楼Trichosanthes rubriflos Thoms. ex Cayla,存放于广西医科大学分子医学实验室-80 ℃超低温冰箱。大肠杆菌DH5α感受态细胞、LATaq DNA聚合酶限制性内切酶、3’-Full RACE Core Set Ver 2.0、柱式胶回收试剂盒及质粒小量提取试剂盒等为TaKaRa公司产品;DNA寡核苷酸引物由上海生物工程有限公司合成;PEASY-T1载体为全式金公司产品;RCR仪为Biometra An Analylik Jena Company公司产品;其他试剂均为国产分析纯产品;本研究利用的不同植物SS的相关信息见表 1。
| 表 1 不同植物SS的相关信息 Table 1 Related information of SS gene from different plants |
参照蒋军富等[7]的异硫氰酸胍法,提取红花括楼叶片总RNA。
1.3 3’RACE PCR克隆以绞股蓝和罗汉果的SS基因为基础,经比对分析找同源区,设计出扩增红花栝楼SS cDNA全长所需的5’端简并引物ssjbf2和ssjbf3(表 2),由上海生物工程有限公司合成。以红花栝楼总RNA为模板,加入3’RACE Adaptor等试剂,按试剂盒说明书操作反转录合成第一链cDNA。反应体系包括红花栝楼总RNA 1 μL、3’RACE Adaptor(5 μmol/L)1 μL、5×Prime Script Buffer 2 μL、dNTP Mixture(10 mmol/L each)1 μL、RNase Inhibitor(40 U/μL)0.25 μL、PrimeScript RTase(200 U/μL)0.25 μL,用RNase Free dH2O补至总体积10 μL。42 ℃反转录60 min,70 ℃作用15 min,反应产物用于巢式PCR。以反转录得到的第一链cDNA为模板,分别以ssjbf2、ssjbf3与3’RACE试剂盒中的3’RACE Outer Primer、3’RACE Inner Primer为引物,按照3’-Full RACE Core Set Ver 2.0说明进行3’RACE外侧、内侧2轮巢式PCR扩增反应。第1轮PCR反应条件为94 ℃预变性3 min,然后以94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸100 s运行20个循环,72 ℃延伸10 min。以第1轮PCR产物为模板进行第2轮巢式PCR。第2轮PCR反应条件为94 ℃预变性3 min,然后以94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸100 s运行30个循环,72 ℃延伸10 min。用琼脂糖凝胶电泳判断PCR扩增结果。Inner PCR产物纯化后,与PEASY-T1连接,连接产物转化大肠杆菌DH5α,在X-gal/IPTG/Amp LB琼脂平板上挑取白色菌落摇菌扩增培养,提取质粒并进行PCR鉴定,将阳性克隆送华大基因公司测序。
| 表 2 SS的3’RACE 引物 Table 2 Primers of 3’RACE for SS |
利用Vector NTI Suite 6.0软件对3’RACE所得片段的测序结果进行分析与拼接。利用DNAMAN软件分析红花栝楼SS基因cDNA全长序列性质,序列测定结果采用NCBI Blast进行同源性比对搜索。用Vector NTI Suite 6.0软件对红花栝楼和已报道的植物SS氨基酸序列进行相似性比对,构建SS基因系统进化树,并进行相关生物信息学分析[18, 19, 20]。
2 结果与分析 2.1 红花栝楼SS基因3’RACE通过3’RACE得到1 700 bp左右的特异条带,见图 1。通过菌落PCR得到1 800 bp左右的特异条带,见图 2。
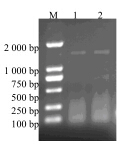 | M-Marker 1、2-3’RACE PCR产物 M-Marker 1,2-PCR result of 3’RACE 图 1 3’RACE产物电泳图Fig.1 Electrophoretogram of 3’RACE product |
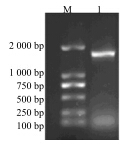 | M-Marker 1-SS PCR产物 M-Marker 1-PCR product of SS 图 2 菌落PCR电泳图Fig.2 Electrophoretogram of colony PCR |
根据3’RACE扩增测序结果,由Vector NTI Suite 6.0软件拼接及人工校对后得到红花栝楼SS基因全长序列。该基因cDNA全长1 466 bp,翻译起始位点为3碱基处,翻译终止点位于1 255碱基处,开放读码框由1 254个碱基组成。
红花栝楼SS基因cDNA核苷酸及推衍的氨基酸序列见图 3。
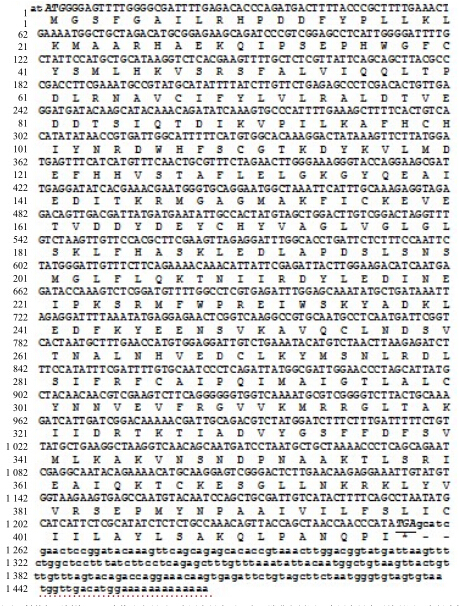 | 斜体ATG为起始密码子,斜体加下划线TGA为终止密码子;小写字母表示5′和3′端非翻译区,大写字母表示编码区;上行为核苷酸序列,下行为氨基酸序列 ATG is initiation codon in bold and italics,TGA is termination codon in bold and indicated by underlined; Lowercase letters represent 5’and 3’untranslation regions,Capital letters represent encoding regions; Up rows indicate nucleotide sequence; Down rows indicate amino acid squence 图 3 红花栝楼SS cDNA序列及推导的氨基酸序列Fig.3 cDNA sequence and deduced amino acid sequence for SS gene from T. rubriflos |
由SWISS-MODEL Workspace在线分析软件建立红花栝楼SS基因编码蛋白三维结构模型如图 4所示。根据Protscale中的Kyte & Doolittle算法对蛋白质疏水性与吸水性预测可知(图 5),MIN:-2.300,MAX:3.344,正值越大表示越疏水,负值越大表示越亲水,介于0.5~-0.5的主要为两性氨基酸,其中Arg有最低的亲水性分值-4.5,即亲水性最强,而Ile疏水性最强,其分值为4.5。根据整体肽链可知,其中在386~408区域的疏水性最强,其次335~337、283~340、175~181、69~76、46~49区域具有较强的疏水性;214~254区域的亲水性最强,其次17~21、25~37、104~115、137~144、161~162、164~166、350~361、367~370、373~383区域具有较强的亲水性。红花栝楼SS多肽链的亲水区域大于疏水区域,预测该蛋白属于亲水性蛋白。用Topcons预测红花栝楼SS跨膜区域,此蛋白含有3个跨膜区,分别位于58~78位、281~301位、386~406位。
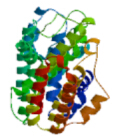 | 图 4 红花栝楼SS基因编码蛋白三维结构模型 Fig.4 3D structure of SS-encoding protein from T. rubriflos |
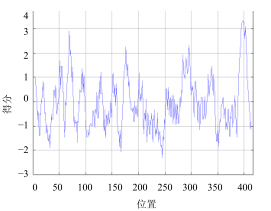 | 图 5 红花栝楼SS的疏水性与亲水性预测Fig.5 Hydrophobicity and hydrophilicity prediction of SS gene from T. rubriflos |
通过与葫芦科植物罗汉果和绞股蓝的SS氨基酸序列比对分析,得到红花栝楼SS基因的开放阅读框编码由417个氨基酸残基构成。通过http://www.expasy.org/网站在线分析,得到红花栝楼SS的氨基酸序列等电点为7.90,相对分子质量为47 594.33,二级结构中含α螺旋(alpha helix)68.82%,β转角(beta turn)2.88%,扩展链(extended strand)4.56%,无规卷曲(random coil)23.74%。
利用PSORT Prediction对红花栝楼SS蛋白的亚细胞定位分析得到SS位于膜结构上。SS定位于质膜上的可能性为0.73,明显大于微粒体、线粒体内膜、内质网膜上的可能性,所以SS定位于质膜上的可能性最大。
2.4 陆生植物SS基因序列比较及进化树分析经NCBI Blast比对,发现本实验克隆得到的红花栝楼SS基因的氨基酸序列与已知植物SS的同源性为78%~94%,核酸序列同源性为74%~93%。其中,氨基酸序列与罗汉果和绞股蓝相似性分别为94%和88%,核苷酸序列与罗汉果和绞股蓝相似性分别为93%和88%。保守序列(conservedsequence)对推测进化结果具有特殊意义,在NCBI的蛋白保
守结构域数据库(conserved domain database,CDD)中对红花栝楼SS进行蛋白保守区预测,结果表明与该基因匹配的蛋白为SS,保守序列在N端和中间(图 6)。用Vector NTI Suite 6.0软件将得到的红花栝楼SS与不同植物的SS的氨基酸序列进行多重比对,构建得到进化树(图 7)。
 | 图 6 红花栝楼SS保守结构区域的预测Fig.6 Prediction of conserved domain of SS protein from T. rubriflos |
 | 图 7 不同植物SS氨基酸序列进化树Fig.7 Phylogenetic tree based on amino acid sequence of SS from different plants |
药用植物的生物合成途径关键酶基因的克隆、表达和调控是近年来的研究热点。植物体内三萜皂
苷主要通过甲羟戊酸(mevalonic acid,MVA)途径合成[5]。MVA途径中,SS处于FPP到其他产物的分支点上,FPP除可以被SS催化产生鲨烯(SQ)外,还可以在其他酶的催化下产生赤霉素、类胡萝卜素等。SQ是所有三萜皂苷、甾醇、胆固醇等萜烯类重要物质的共同前体[21],因此对SS的研究具有重要意义。
通过GenBank序列查询表明,目前尚无关于红花栝楼SS基因序列的报道。本研究首次克隆出了红花栝楼SS cDNA基因并对其进行了相关的生物信息学分析,为进一步研究红花栝楼SS基因结构、基因表达、基因突变提供了基础,并为三萜合成通路关键酶SS的正选择位点与功能的关联性分析提供了数据支持。
根据已知的SS基因设计出红花栝楼SS基因5’端的简并引物,运用3’RACE试剂盒直接扩增出SS基因的全长,省去了5’RACE的步骤,方法简单可行,节省经费开支,为后续研究提供了基础。本研究克隆得到的红花栝楼SS基因与已知的罗汉果SS基因的编码区比较,一致性达到93%,具有较高的同源性。通过NCBI网站和一些生物信息学软件对红花栝楼SS基因的碱基分布、氨基酸组成进行分析,结果发现,该基因中G+C的碱基量约为41.54%,低于50%,表明发生错配的概率较低,核苷酸处于较稳定状态。通过Clustal X等生物信息学软件将红花栝楼SS氨基酸与其他物种氨基酸的序列进行多重比对和进化分析可知,序列之间的同源性较高。例如,红花栝楼氨基酸序列:76~82(LDTVEDD)、209~214(NIIRDY)、216~220(EDINE)等区段同源性达100%,说明其在进化过程中具有高度保守性,对其他物种SS基因的克隆与分离提供重要的数据支持。同时这些保守区基因信息为其他物种中该基因的克隆提供了十分有价值的序列信息,为加快基因克隆及SS基因的分子调控研究奠定基础。从植物SS氨基酸序列的进化树看到,亲缘关系近的科属,其SS的氨基酸序列一致性更高。其中,五加科与伞形科SS的进化关系更密切。葫芦科植物SS的序列尚有待增加。较大差异的基因区段主要集中在C端。今后可通过实验研究进一步验证通过NCBI的蛋白保守结构域数据库(conserved domain database,CDD)中对红花栝楼SS进行蛋白保守区预测的正确性。这些差异性较大的区段可能与基因的进化与变异相关,这些仍待确定。
| [1] | Henry M, Rahier A, Taton M. Effect of gypsogenin 3-O-glucuronide pretreatment of Gypsohila paniculata and Saponaria officinalis cell suspension cultures on the activities of microsomal 2,3-oxidosqualene cycloarten- |
| [2] | 张 丹, 刘耀平, 鱼红闪, 等. 人参皂苷8-葡萄糖苷酶的分离纯化及其酶学特性 [J]. 应用与环境生物学报, 2003, 9(3): 259-262. |
| [3] | Haralampidis K, Trojanowska M, Osbourn A E. Biosynthesis of triterpenoid saponins in plants [J]. Adv Biochem Eng Biotechnol, 2002(75): 31-49. |
| [4] | 卢虹玉, 刘敬梅, 阳文龙, 等. 甘草鲨烯合威酶基因的分离及植物表达栽体的构建 [J]. 药物生物技术, 2007, 14(4): 255-258. |
| [5] | Jennings S M, Tsay Y H, Fisch T M, et al. Molecular cloning and characterization of the yeast gene for squalene synthetase [J]. Proc Natl Acad Sci USA, 1991, 88(14): 6038-6042. |
| [6] | 刘 镛, 吴耀生, 胡艳玲, 等. 陆生植物鲨烯合酶适应性进化正选择位点分析 [J]. 中国生物化学与分子生物学报, 2013, 29(1): 91-97. |
| [7] | 蒋军富, 李雄英, 吴耀生, 等. 绞股蓝鲨烯环氧酶基因的克隆与序列分析 [J]. 西北植物学报, 2010, 30(8): 1520-1526. |
| [8] | 毛乐心, 赵昶灵, 支伟特, 等. 人参属植物鲨烯合酶编码基因及其氨基酸序列的生物信息学分析 [J]. 中国农学通报, 2012, 28(31): 220-226. |
| [9] | 戴住波, 钱子刚, 胡运乾, 等. 金铁锁鲨烯合酶cDNA的克隆和功能鉴定 [J]. 药学学报, 2008, 43(12): 1245-1250. |
| [10] | 常 晶, 郭春华, 尹永志, 等. 青蒿鲨烯合酶cDNA的克隆与序列分析 [J]. 安徽农业科学, 2010, 38(10): 4996-4998. |
| [11] | 张 毅, 刘 彦, 王 红. 转青蒿反义鲨烯合酶基因对烟草鲨烯合酶基因表达的影响 [J]. 农业生物技术学报, 2005, 13(4): 416-422. |
| [12] | 马艺沔, 袁丽钗, 张林甦, 等. 2个丹参鲨烯合酶基因的克隆和鉴定 [J]. 中草药, 2014, 45(9): 1307-1312. |
| [13] | 卢虹玉, 刘敬梅, 阳文龙. 甘草鲨烯合成酶基因的分离及植物表达载体的构建 [J]. 药物生物技术, 2007, 14(4): 255-258. |
| [14] | 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1986. |
| [15] | Takahashi N, Yoshida Y, Sugiura T, et al. Cucurbitacin D isolated from Trichosanthes kirilowii induces apoptosis in human hepatocellular carcinoma cells in vitro [J]. Int Immunopharmacol, 2009, 9(4): 508-513. |
| [16] | Scotto-Lavino E, Du G, Frohman M A. Amplification of 5'end cDNA with ‘new RACE’[J]. Nat Protoc, 2006, 1(6): 3056-61. |
| [17] | 蒋 东, 唐银琳, 陶晨陈, 等. 绞股蓝法呢基焦磷酸合酶基因的克隆及其序列分析 [J]. 生物技术通讯, 2014, 25(2): 198-202. |
| [18] | 张 萍, 刘迪秋, 葛 锋, 等. 三七3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因的克隆和生物信息学分析 [J]. 中草药, 2014, 45(18): 2684-2690. |
| [19] | 陈 莉, 蓝秀万, 李 珅, 等. 三七法呢基焦磷酸合酶的基因克隆及序列分析 [J]. 中草药, 2006, 37(7): 1080-1083. |
| [20] | Mount D W. 序列与基因组分析 [M]. 北京: 高等教育出版社, 2003. |
| [21] | 张风侠, 梁新华, 王 俊. 植物三萜皂苷生物合成及关键酶鲨烯合酶的研究进展 [J]. 农业科学研究, 2009, 30(3): 64-68. |
 2015, Vol. 46
2015, Vol. 46


