2. 青岛市胶州中心医院 产科, 山东 青岛 266300;
3. 济南市第二人民医院 病理科, 山东 济南 250062
2. Department of Obstetrics, Jiaozhou Central Hospital of Qingdao, Qingdao 266300, China;
3. Department of Pathology, Jinan Second People's Hospital, Ji'nan 250062, China
磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(PKB/ Akt)通路是一个经典的抗凋亡、促存活的信号转导途径,在肿瘤发生、增殖、侵袭、转移及放化疗抵抗中发挥重要作用。PI3K/Akt通路异常与卵巢癌的发生、发展有关。人体多种肿瘤中已发现张力蛋白同源的第10染色体丢失的磷酸酶基因(phosphatase and tensin homologue deleted onchromosome 10,PTEN)的突变,野生型PTEN通过PI3K/PIP3/Akt通路抑制细胞增殖,促进其凋亡。近年来的研究已经证明,蝎毒多肽(polypeptide extract from scorpion venom,PESV)在体内外具有显著的抗肿瘤作用[1, 2],但其防治肿瘤的机制还未完全阐明。本研究检测蝎毒多肽干预后卵巢癌组织中PI3K、p-Akt和PTEN蛋白表达的变化,探讨蝎毒多肽抑制卵巢癌生长的机制。
1 材料 1.1 细胞株人卵巢癌SKOV3细胞株,山东省医学科学院基础医学研究所冻存,常规复苏放入含10%小牛血清的RPMI 1640培养液中,置于37 ℃、5% CO2饱和湿度培养箱培养,用0.25%胰蛋白酶消化、传代。
1.2 药品、试剂与仪器蝎毒多肽按照文献方法[1]提取,蛋白质量分数≥80%,水分2.0%~2.5%,聚丙烯酰胺电泳呈现17条蛋白条带,HPLC法检测可见30多个分离峰。PI3K、p-Akt一抗及β-actin单克隆抗体,美国Cell Signaling公司。PTEN一抗,北京博奥森生物技术有限公司。山羊抗兔IgG/辣根酶标记二抗和DAB二氨基联苯胺显色试剂盒购自北京中杉金桥生物技术有限公司。ELISA试剂盒购自上海蓝基生物科技有限公司。美国Specltramax酶标仪,德国Leica倒置显微镜,德国Leica DM4000B光学显微镜。
1.3 实验动物Balb/c(nu/nu)裸鼠,雌性,6~8周龄,体质量20~22 g,购自北京维通利华实验动物技术有限公司,实验动物合格证号为SCXK(京)20120001,在恒温(24~26 ℃)IVC笼具内饲养。
2 方法 2.1 动物模型的制备、分组及给药取对数生长期的SKOV3细胞,经消化、离心收集后,重悬于无血清RPMI 1640培养基,调整细胞密度为2×107/mL,取2只裸鼠于腋部皮下接种,每侧0.2 mL,4 d后,剥离肿瘤组织,切成约1.5 mm3的瘤块,转种于30只裸鼠左侧腋下。当肿瘤生长至约80 mm3时,按瘤体积均衡的原则将裸鼠随机分为对照组、蝎毒多肽低剂量组(10 mg/kg)、蝎毒多肽高剂量组(20 mg/kg)[3],每组10只。各组均ig给药,给药体积0.5 mL/20 g,1次/d,对照组给予等量生理盐水,连续给药2周。
2.2 描绘肿瘤体积增长曲线并计算抑瘤率从用药当天开始,隔日用游标卡尺测量肿瘤长径(A)和垂直短径(B),按照公式计算肿瘤体积(V=A×B2/2),描绘肿瘤体积增长曲线。末次给药24 h后,脱臼处死裸鼠,完整剥离肿瘤组织,称质量,并计算抑瘤率。将剥取的移植瘤浸泡在中性福尔马林溶液中,用于免疫组化法检测。
抑瘤率=(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量
2.3 HE染色法观察卵巢癌组织形态学改变肿瘤组织置于中性甲醛中固定24 h,石蜡包埋切片,脱蜡至水,HE染色5 min,盐酸酒精分化,反蓝,然后伊红染色5 min,脱水,透明,中性树胶封片。
2.4 免疫组化法检测卵巢癌组织中PTEN、PI3K和p-Akt的变化肿瘤组织以中性福尔马林固定,石蜡包埋切片,采用免疫组化SP法检测。严格按照试剂盒说明书操作,DAB显色。显微镜下观察结果。PTEN、PI3K、p-Akt 阳性结果均为细胞质或细胞膜着色,胞浆内出现明显的棕褐色或棕黄色颗粒。用显微镜图像采集系统采集图像,利用双盲法检测PTEN、PI3K和p-Akt的染色强度,每张切片随机选取5个视野(×200)阳性着色区域,并用LeicaQwinV3图像分析软件进行灰度值的半定量分析,数值范围:0~255,取其平均值即为该例灰度值。蛋白表达量与灰度值呈负相关,即灰度值越高,蛋白表达越低。
2.5 ELISA法检测荷瘤裸鼠血清中PTEN、PI3K和p-Akt水平采用ELISA双抗体夹心法检测各组裸鼠血清中PTEN、p-Akt水平,采用竞争法检测各组小鼠血清中PI3K水平。严格按照ELISA试剂盒说明书操作,待显色终止后立即测量吸光度(A)值,绘制标准曲线,计算各指标血清浓度。
2.6 统计学处理采用SPSS 17.0软件进行数据处理。所有计量数据均以x±s表示,组间数据的比较采用单因素方差分析(One-way ANOVA)。
3 结果 3.1 对肿瘤生长的影响与对照组比较,蝎毒多肽高、低剂量组裸鼠瘤质量明显减轻(P<0.05、0.01),且蝎毒多肽高剂量组抑瘤率显著高于其低剂量组抑瘤率(P<0.01),结果见表 1。肿瘤体积增长曲线看出,随着时间的延长,肿瘤体积逐渐增加,与对照组比较,蝎毒多肽高、低剂量组裸鼠肿瘤体积显著减小(P<0.05、0.01),见图 1。
| 表 1 蝎毒多肽对SKOV3荷瘤裸鼠肿瘤质量的影响(x±s,n = 10) Table 1 Effect of PESV on tumor weight of SKOV3-bearing nude mice (x±s,n = 10) |
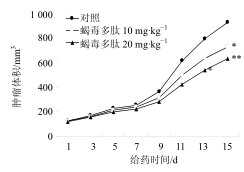 | 图 1 各组裸鼠肿瘤体积增长曲线 ( x±s,n = 10) Fig.1 Tumor growth curve of nude mice in each group( x±s,n = 10) |
HE染色后光镜下观察,可见肿瘤组织呈片状不规则生长。对照组肿瘤细胞核大深染浸润到肌层;蝎毒多肽低剂量组肿瘤组织内可见小片状坏死,仅残存部分肿瘤细胞;蝎毒多肽高剂量组肿瘤组织内可见片状坏死,残存小巢状肿瘤细胞。见图 2。
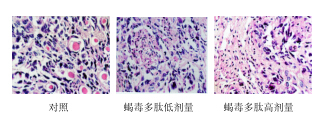 | 图 2 蝎毒多肽对裸鼠卵巢癌组织的影响Fig.2 Effect of PESV on ovarian cancer tissue in nude mice |
免疫组化结果(图 3和表 2)显示,蝎毒多肽高剂量组PTEN蛋白表达明显高于对照组(P<0.01),PI3K、p-Akt蛋白表达明显低于对照组(P<0.01);与对照组比较,蝎毒多肽低剂量组PTEN蛋白表达升高(P<0.05),PI3K、p-Akt蛋白表达降低(P<0.05)。
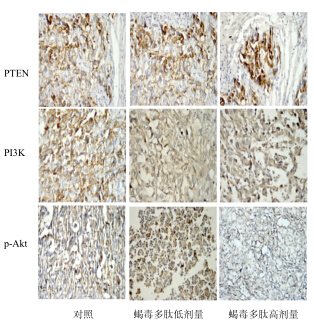 | 图 3 蝎毒多肽对SKOV3荷瘤裸鼠卵巢癌组织PTEN、PI3K和p-Akt蛋白表达的影响Fig.3 Effect of PESV on protein expression of PTEN,PI3K,and p-Akt in ovarian tissue of SKOV3-bearing nude mice |
| 表 2 各组卵巢癌肿瘤组织PTEN、PI3K、p-Akt表达的灰度值分析 (x±s,n = 10) Table 2 SGrey value analysis on expression of PTEN,PI3K,and P-Akt in tissue of ovarian cancer in each group (x±s,n = 10) |
蝎毒多肽干预后,蝎毒多肽低、高剂量组裸鼠血清中PTEN的量均明显高于对照组(P<0.05、0.01),蝎毒多肽低、高剂量组裸鼠血清中PI3K、p-Akt的量均明显低于对照组(P<0.05、0.01),见表 3。结果与免疫组化检测结果一致。
| 表 3 蝎毒多肽对SKOV3荷瘤裸鼠血清中PTEN、PI3K和p-Akt水平的影响 (x±s,n = 10) Table 3 Effect of PESV on levels of PTEN,PI3K,and p-Akt in serum of SKOV3-bearing nude mice (x±s,n = 10) |
卵巢癌(ovarian cancer,OC)是致死率最高的妇科恶性肿瘤,严重威胁着女性健康和生活质量,其早期诊断率低、转移率高、预后最差,且缺乏有效治疗手段,对化疗易产生耐药。因此寻找安全有效的抗卵巢癌药物成为临床上迫切需要解决的问题。蝎毒多肽是从东亚钳蝎蝎毒中提取的多肽混合物,前期研究已证实蝎毒多肽对Lewis肺癌、肝癌、前列腺癌及S180肉瘤等肿瘤生长有明显抑制作用,并可以显著抑制肿瘤化疗期间再增殖[4, 5, 6, 7, 8]。本研究显示蝎毒多肽在体内能明显抑制卵巢癌的生长,蝎毒多肽高、低剂量组的的抑瘤率分别为50.8%和31.5%。
PI3K/AKT信号传导通路参与多种肿瘤的发生发展[9]。AKT是位于PI3K下游的一个重要激酶,二者均是促进细胞生存和维持细胞正常功能关键的信息分子,并且构成细胞对外应激反应过程中促进细胞生长、抑制细胞凋亡和维持细胞重要功能的信号传递链。研究显示PI3K和p-Akt与卵巢癌细胞的增生、转移、浸润及预后有关,且临床期别越晚、病理分级越高,蛋白阳性表达率越高[10, 11]。研究提示,抑制PI3K/AKT信号传导通路可能对肿瘤患者具有治疗价值[12, 13, 14]。本研究利用免疫组化法检测肿瘤组织中PI3K、p-Akt的表达,结果表明与对照组比较,蝎毒多肽高、低剂量组均能降低卵巢癌肿瘤组织中PI3K、p-Akt的表达。说明蝎毒多肽较好地抑制了PI3K/AKT信号转导途径中PI3K、p-Akt信号蛋白的表达,进而抑制肿瘤生长。
PTEN是迄今发现的唯一具有脂质磷酸酶和蛋白磷酸酶双重磷酸酶活性的抑癌基因,其表达缺失可使PI3K/AKT信号途径异常活化,从而促进恶性肿瘤的发生[15]。研究发现,PTEN功能缺失可导致PI3K途径的成分如AKT活性增加,而PTEN高表达可通过抑制AKT活性使细胞产生调亡[16]。本研究发现,蝎毒多肽高、低剂量组PTEN表达均升高,提示蝎毒多肽可能是通过调控PTEN的表达来抑制卵巢癌肿瘤生长。
综上所述,蝎毒多肽对裸鼠卵巢癌生长有抑制作用,能通过减少PI3K、p-Akt信号蛋白的产生,增强PTEN蛋白的产生进而抑制肿瘤生长,这可能是蝎毒多肽抑制肿瘤生长的机制,为蝎毒多肽防治肿瘤提供了新的实验依据,并为开发新的抗肿瘤药物提供了新思路。
| [1] | 张维东, 崔亚洲, 姚成芳, 等. 蝎毒多肽提取物抗肿瘤血管生成作用的试验研究 [J]. 中国药理学通报, 2005, 21(6): 708-711. |
| [2] | 张维东, 张月英, 王朝霞, 等. 蝎毒多肽提取物对肿瘤生长和细胞免疫功能的影响 [J]. 山东大学学报: 医学版, 2007, 45(3): 286-289. |
| [3] | 郑安红, 张维东, 王兆朋, 等. 蝎毒多肽增强5-氟尿嘧啶对H22肝癌抑制作用的机制研究 [J]. 中草药, 2013, 44(11): 1465-1469. |
| [4] | 张维东, 崔亚洲, 贾 青, 等. 蝎毒多肽提取物对小鼠S180肉瘤和H22肝癌血管生成抑制作用的实验研究 [J]. 山东中医药大学学报, 2005, 29(2): 152-155. |
| [5] | 王兆朋, 张维东, 张 捷, 等. 蝎毒多肽提取物对非激素依赖性前列腺癌细胞增殖抑制作用的实验研究 [J]. 中国药理学通报, 2006, 22(8): 938-942. |
| [6] | 隋文文, 张维东, 武利存, 等. 蝎毒多肽促进5-氟尿嘧啶抑制H22肝癌血管生成的作用机制研究 [J]. 中草药, 2014, 45(3): 392-397. |
| [7] | 王兆朋, 张维东, 武利存, 等. 蝎毒多肽提取物抑制肝癌H22细胞化疗期间再增殖实验研究 [J]. 中国中药杂志, 2010, 35(1): 108-113. |
| [8] | 张维东, 崔亚洲, 武利存, 等. 蝎毒多肽提取物的抗血管生成作用 [J]. 细胞生物学杂志, 2005, 27(3): 343-346. |
| [9] | 郭瑞霞, 魏丽惠. 磷脂酰肌醇3激酶/蛋白激酶B信号传导通路与妇科恶性肿瘤的研究进展 [J]. 中华妇产科杂志, 2005, 40(5): 358-360. |
| [10] | 李巧云, 闻立红, 颜秋梅, 等. 卵巢上皮性肿瘤组织中PI3K和p-AKT蛋白的表达 [J]. 第四军医大学学报, 2007, 28(10): 910-912. |
| [11] | 李新文, 陈胜民, 王 昆, 等. 卵巢浆液性癌中p-Akt473Ser、p53及Ki-67的表达与临床意义 [J]. 现代肿瘤医学, 2011, 19(9): 1839-1840. |
| [12] | Korkaya H, Paulson A, Charafe-Jauffret E, et al. Regulation of mammary stem/progenitor cells by PTEN/Akt/beta-catenin signaling [J]. PLoS Biol, 2009, 7(6): 121-126. |
| [13] | Chen X, Stoeck A, Lee S J, et al. Jagged1 expression regulated by Notch3 and Wnt/β-catenin signaling pathways in ovarian cancer [J]. Oncotarget, 2010, 1(3): 210-218. |
| [14] | Uddin S, Ahmed M, Hussain A, et al. Cyclooxygenase-2 inhibition inhibits PI3K/AKT kinase activity in epithelial ovarian cancer [J]. Int J Cancer, 2010, 126(2): 382-394. |
| [15] | Sarbassov D D, Guertin D A, Ali S M, et al. Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex [J]. Science, 2005, 307(5712): 1098-1101. |
| [16] | Obata K, Morland S J, Watson R H, et al. Frequent PTEN/MMAC mutations in endometrioid but not serous or mucinous epithelial ovarian tumors [J]. Cancer Res, 1998, 58(10): 2095-2097. |
 2015, Vol. 46
2015, Vol. 46


