三氧化二砷(arsenic trioxide,ATO)是中药砒霜的有效活性成分,临床上主要用于急性早幼粒细胞白血病的治疗[1, 2]。有学者发现,ATO对多种实体瘤细胞也具有抑制生长和诱导凋亡作用[3, 4, 5],但由于ATO在体内分布缺乏特异性,达到有效浓度时对其他正常组织往往会产生严重的毒副作用[6];此外,ATO半衰期短,给药后消除迅速[7],因此,限制了其在实体瘤治疗中的应用。有学者尝试将ATO制备成脂质体制剂,以改善其安全性,获得了较好的结果[8]。介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSNs)是一种新型的无机介孔材料,具有比表面积和孔容大,介孔结构高度有序,内外表面存在大量易于修饰的硅羟基,生物相容性好等优点[9, 10]。具有环境响应性(包括光敏、酶敏、温敏和pH敏等)的MSNs可以通过病灶微环境刺激药物载体而实现药物靶向释放,考虑到肿瘤部位的酸性(pH 5.5~6.5)比正常组织(pH 7.4)强[11],构建ATO pH响应递药系统对于提高药物肿瘤靶向性具有重要意义。
聚丙烯酸(polyacrylic acid,PAA)是一种无毒、可降解、带有负电荷、溶解度随pH值减小而变差的pH敏感材料[12]。本实验拟将MSNs内外表面氨基改性以期通过酸碱之间的静电作用包载弱酸性的ATO,再利用PAA对MSNs外表面进行酸碱共轭修饰,以封堵介孔,将ATO包封于MSNs内孔道;在酸性肿瘤部位,由于PAA溶解度减小质子化后从载体脱落打开介孔而释放药物,达到pH响应释药目的。本实验制备了聚丙烯酸修饰氨基改性介孔二氧化硅载三氧化二砷纳米粒(polyacrylic acid grafted arsenic trioxide amino-functioned mesoporous silica nanoparticles,PAA-ATO-MSNs),并考察其理化性质、体外释药特性及大鼠体内药动学行为,为ATO新型递药系统的构建及其在肿瘤治疗中的应用提供参考。
1 仪器与材料ICAP 6300等离子体发射光谱仪,美国Thermo公司;7500ce电感耦合等离子体质谱仪,美国Agilent公司;H-7650透射电子显微镜,日本日立公司;Bruker D8 Advance X射线衍射仪,德国布鲁克公司;TriStar II 3020多通道全自动比表面和孔隙分析仪,美国麦克公司;傅里叶变换显微红外光谱仪,美国Thermo公司;Pyris 1 TGA热重分析仪,美国珀金埃尔默仪器公司;380 ZLS激光粒度测定仪,美国Nicomp公司;Labconco冷冻干燥机,美国Labconco公司;Mill-Q超纯水器,美国Millpore公司;Optima Max超速低温离心机,美国Beckman公司;CP225D电子天平,北京赛多利斯科学仪器有限公司;HZ-9212S水浴恒温振荡器,江苏太仓市华利达实验设备公司;透析袋,上海绿鸟科技发展有限公司,截留相对分子质量3 500。
四乙氧基硅烷(TEOS)、十六烷基三甲基溴化铵(CTAB)、氨丙基三乙氧基硅烷(APTES)、聚丙烯酸(PAA,MW=1 800)、N,N-二甲基甲酰胺(DMF),美国Sigma公司;ATO,质量分数99.9%,苏州诺德派森公司;砷标准溶液,1.000 g/L,北京世纪奥科生物技术有限公司;其他试剂均为分析纯。
清洁级SD大鼠,雌雄兼用,体质量(240±10)g,浙江中医药大学实验动物中心,合格证号SCXK沪2013-0016;所有动物实验均按照浙江大学动物饲养和使用指南进行。
2 方法与结果 2.1 纳米粒的制备 2.1.1 氨基化介孔二氧化硅纳米粒(NH2-MSNs)的制备采用共沉淀法一步制备NH2-MSNs。0.3 g CTAB溶于超纯水中,加入适量2 mol/L NaOH溶液调节pH至11.5。80 ℃下磁力搅拌0.5 h后,将含4.46 mol/L TEOS 1 mL和4.27 mol/L APTES 0.5 mL的混合液逐滴加到CTAB溶液中,反应2 h,静置熟化6 h,20 000 r/min离心30 min,酸性乙醇(无水乙醇与12 mol/L浓盐酸体积比10∶1)洗涤3次以除去模板剂CTAB。超纯水洗3次,离心,冷冻干燥,即得NH2-MSNs。
2.1.2 PAA-ATO-MSNs的制备精密称取NH2- MSNs冻干粉末40 mg,加至1 mg/mL ATO溶液10 mL中,搅拌24 h。20 000 r/min高速离心30 min,除去游离ATO,超纯水洗3次,离心,冷冻干燥,即得ATO-MSNs。精密称取ATO-MSNs冻干粉20 mg溶于20 mL DMF中,加入20 mg PAA,100 ℃下搅拌反应2 h,20 000 r/min离心30 min,产物用无水乙醇洗涤3次,超纯水洗涤3次,离心,冷冻干燥,即得PAA-ATO-MSNs。
2.2 纳米粒的表征 2.2.1 形态、粒径和Zeta电位采用高倍透射电子显微镜观察制备的3种纳米粒的形貌,NH2-MSNs、ATO-MSNs、PAA-ATO-MSNs形态见图 1;室温下采用激光粒度仪测定各纳米粒的粒径、粒径分布、Zeta电位及多分散指数(PDI),结果见表 1和图 2。NH2-MSNs、ATO-MSNs、PAA-ATO-MSNs外观呈圆形或类圆形,粒径均一;由透射电镜放大图中可以看到,NH2-MSNs具有介孔网格结构而ATO- MSNs和PAA-ATO-MSNs中则不明显。由图 1-C放大图中还可看到,PAA-ATO-MSNs粒子表面光滑且具有“壳”层,即为修饰在MSNs表面的PAA层。NH2-MSNs载药后Zeta电位由(43.60±0.61)mV减小为(19.97±0.33)mV,PAA修饰后Zeta电位变为负值(-28.40±0.34)mV。
 | 大图:×60 000;插图:×100 000
the large image: × 60 000; illustration: × 100 000 图 1 NH2-MSNs (A)、ATO-MSNs (B) 和PAA-ATO-MSNs (C) 透射电镜图Fig.1 TEM Photograph of NH2-MSNs (A),ATO-MSNs (B),and PAA-ATO-MSNs (C) |
| 表 1 NH2-MSNs、ATO-MSNs和PAA-ATO-MSNs粒径、PDI、Zeta电位 Table 1 Particle size,PDI,Zeta potential of NH2-MSNs,ATO-MSNs,and PAA-ATO-MSNs |
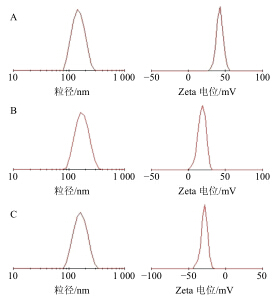 | 图 2 NH2-MSNs (A)、ATO-MSNs (B) 和PAA-ATO-MSNs (C) 透射电镜图Fig.2 TEM Photograph of NH2-MSNs (A),ATO-MSNs (B),and PAA-ATO-MSNs (C) |
小角粉末衍射是介孔二氧化硅纳米粒表征过程中最常用的手段之一,主要用来判断是否有有序介孔结构的存在,出现的衍射峰是确认有序介孔结构存在的依据。本实验采用X射线衍射仪观察粒子的小角度X射线衍射行为,衍射角为1°~8°,扫描速度为1°/min,工作电压为40 kV,工作电流为200 mA,小角X射线衍射谱图见图 3。在2°~3°出现明显的衍射峰,表明NH2-MSNs具有有序介孔结构,当载药且PAA修饰包裹后衍射峰几乎消失。
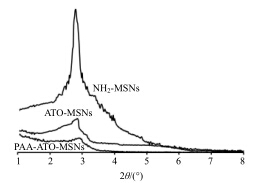 | 图 3 NH2-MSNs、ATO-MSNs和PAA-ATO-MSNs的小角粉末衍射图Fig.3 Powder diffraction pattern of NH2-MSNs,ATO- MSNs,and PAA-ATO-MSNs |
采用红外光谱仪测定样品的红外吸收光谱,用溴化钾压片,4 000~400 cm-1内扫描,红外光谱图见图 4。在MSNs的红外图谱中,1 083.82 cm-1处出现最大吸收峰,为Si-O-Si键的反对称伸缩振动;在800.33、462.84 cm-1处分别为Si-O-Si键的对称伸缩振动和弯曲振动;在956.54、3 446.23 cm-1附近出现吸收峰分别为Si-OH的弯曲振动吸收峰和反对称伸缩振动峰,可以看到氨基化后峰强度均减弱。氨基化后1 508.09 cm-1处出现吸收峰为N-H的弯曲振动峰,说明介孔二氧化硅被氨基改性;由PAA-MSNs红外图可知,1 652.72、1 720.22 cm-1分别为酰胺和羧基中C=O的伸缩振动峰。
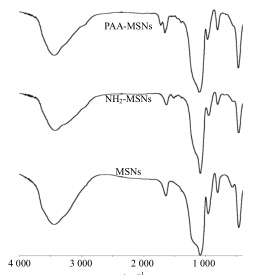 | 图 4 MSNs、NH2-MSNs和PAA-MSNs红外光谱Fig.4 FTIR spectra of MSNs,NH2-MSNs,and PAA-MSNs |
采用氮气吸附仪绘制样品的氮气吸附-脱附等温线,计算样品的比表面积、孔径。样品测定前150 ℃真空脱附6 h,吸附-脱附等温线和孔径分布见图 5。使用软件计算得NH2-MSNs的比表面积、孔径、孔容分别为(997.33±30.67)m2/g、(3.71±0.54)nm、(1.02±0.11)cm3/g(n=3)。样品具有介孔材料典型的IV型吸附等温线,吸附-脱附等温线几乎平行,属于H1型滞后环,说明介孔形状规则且孔径均一[13]。当NH2-MSNs载ATO且表面修饰PAA后,比表面积、孔径、孔容分别减小为(512.28±26.53)m2/g、(2.56±0.49)nm、(0.23±0.09)cm3/g(n=3),这是由于ATO和PAA链占据了部分NH2-MSNs内外孔道表面所致。
2.2.5 热重分析利用热重分析仪测定PAA的接枝率,氮气保护下加热速率为10 ℃/min。如图 6所示,由100 ℃加热到800 ℃时,NH2-MSNs、ATO- MSNs和PAA-ATO-MSNs的质量损失分别为(18.50±1.14)%、(29.56±2.01)%和(39.76±2.87)%(n=3)。因此,PAA的接枝率为(10.20±3.39)%,ATO的载药量为(11.07±3.00)%(n=3)。
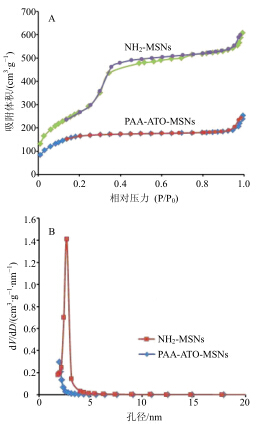 | 图 5 NH2-MSNs和PAA-ATO-MSNs氮气吸附-脱附等温线(A) 和孔径分布 (B)Fig.5 adsorptionn-desorption isotherm (A) and pore diameter distribution (B) of NH2-MSNs and PAA-ATO- MSNs |
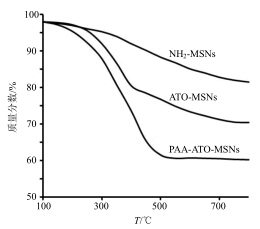 | 图 6 NH2-MSNs、ATO-MSNs和PAA-ATO-MSNs热重分析图Fig.6 Thermogravimetric analysis of NH2-MSNs,ATO- MSNs,and PAA-ATO-MSNs |
RF功率1 150 W;等离子体流量50 L/min;辅助气流量0.5 L/min;雾化器流量0.3 L/min;泵速50 r/min;仪器稳定延时5 s;清洗时间30 s;载气为氩气(纯度99.99%);分析谱线189 nm。
2.3.2 线性关系考察精密移取砷标准溶液适量至100 mL量瓶中,用稀硝酸稀释至刻度,得质量浓度为0、0.25、0.5、1.0、2.0、4.0、8.0 mg/L系列砷标准溶液。按“2.3.1”项下工作条件测定标准空白溶液和各标准溶液中各元素在189 nm处的发射强度,以发射强度为纵坐标(Y),质量浓度为横坐标(C),由软件iTAVA绘制出标准曲线并计算得相关系数:Y=1 847.2 C+19.606,r=0.999 9,表明砷质量浓度在0.25~8.0 mg/L内线性关系良好。
2.3.3 精密度试验取低、中、高(0.25、2.0、8.0 mg/L)质量浓度的砷标准溶液,按“2.3.1”项下工作条件进行测定,分别于1 d内测定5次,连续测定5 d,计算日内和日间精密度,日内RSD分别为1.54%、0.73%、0.91%;日间RSD分别为1.97%、1.68%、1.45%,符合方法学要求。
2.3.4 重复性试验取同一批次制备的PAA-ATO- MSNs混悬液6份,20 000 r/min离心取上清液用稀硝酸稀释后经0.22 μm微孔滤膜滤过,取续滤液按“2.3.1”项下工作条件测定,结果RSD为1.62%,符合方法学要求。
2.3.5 回收率试验取“2.3.4”项下制备的上清液,精密加入砷标准液适量,稀硝酸稀释为低、中、高(0.25、2.0、8.0 mg/L)3个质量浓度的样品溶液,20 000 r/min离心取上清液经0.22 μm微孔滤膜滤过,取续滤液按“2.3.1”项下工作条件测定,计算得平均回收率分别为(95.34±2.09)%、(98.21±1.64)%、(98.79±1.33)%(n=3),符合方法学要求。
2.3.6 稳定性试验取“2.3.4”项下制备的上清液适量经0.22 μm微孔滤膜滤过,取续滤液分别于0、2、4、6、8、12、24 h按“2.3.1”项下工作条件进样测定,结果RSD为1.98%,符合方法学要求。
2.3.7 包封率和载药量测定量取PAA-ATO-MSNs混悬液适量,置于具塞离心管中,室温下20 000 r/min离心40 min,精密量取上清液100 μL于10 mL量瓶中,用稀硝酸稀释至刻度,经0.22 μm微孔滤膜滤过,取续滤液按“2.3.1”项下工作条件测定游离ATO的量,按公式分别计算MSNs中ATO的包封率和载药量。经计算,PAA-ATO-MSNs的包封率和载药量分别为(40.95±3.21)%和(11.42±1.75)%;该方法计算的载药量与热重分析法计算的载药量相近。
包封率=(W0-W1)/W0
载药量=(W0-W1)/Wt
其中,W0为总投药量,W1为PAA-ATO-MSNs中的游离药物量,Wt为PAA-ATO-MSNs的总质量
2.4 体外释药研究选用不同pH值的磷酸盐缓冲液(PBS,pH 5.0、6.0、7.4)为释放介质,考察PAA-ATO-MSNs中ATO的释放特征,精密称取适量ATO原料药、ATO-MSNs及PAA-ATO-MSNs冻干粉(含ATO 0.5 mg)用2 mL释放介质溶解或分散,置于预先处理过的透析袋内,排除气泡后密封,置于100 mL释放介质中,于(37±0.5)℃恒温水浴振荡(75 r/min),分别于0.1、0.25、0.5、0.75、1、1.5、2、4、6、8、12、24 h准确取样2 mL,并立即补加等量同温同pH值新鲜释放介质,样品经0.22 μm微孔滤膜滤过,取续滤液稀释后按“2.3.1”项下工作条件测定释放介质中药物的量,计算累积释药率(Q),绘制释药曲线,见图 7。由图 7可知,ATO原料药在不同pH值条件下释药情况无显著性差异,在2 h内几乎可达90%。ATO-MSNs的释药曲线表现出较弱的pH值响应性,而PAA-ATO-MSNs则具有显著的pH值响应性,随pH值降低,ATO的释放量有所增加,在pH 5.0、6.0下24 h累积释药量可达76.15%、59.80%,而pH 7.4下仅为40.52%。与ATO原料药相比,ATO-MSNs和PAA-ATO-MSNs的体外释药均具有一定的缓释特征,而后者缓释特征更明显。
2.5 大鼠体内药动学研究 2.5.1 给药方案及血样采集精密称取ATO原料药、ATO-MSNs、PAA-ATO-MSNs适量,于10 mL量瓶中用0.9%生理盐水溶解并稀释至刻度,得ATO溶液(ATO-Sol)、ATO-MSNs混悬液、PAA-ATO- MSNs混悬液。取健康SD大鼠18只,禁食12 h,自由饮水,随机分为3组,每组6只。按ATO 1 mg/kg单剂量尾iv分别给予ATO-Sol、ATO-MSNs和PAA-ATO-MSNs混悬液。给药后分别于0.08、0.25、0.5、1、1.5、2、3、4、6、8、12、24 h经股动脉插管取血0.3 mL,置肝素钠预处理的2 mL具塞离心管中,3 000 r/min离心10 min,分离血浆后,置-80 ℃低温冰箱保存待测。将离心后血细胞用与血清体积等量的0.9%生理盐水溶解,每次取血后立即由颈静脉插管补回。
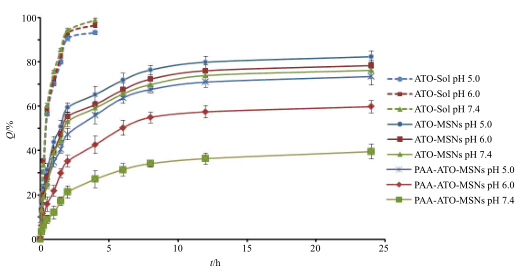 | 图 7 ATO不同制剂体外释药曲线 (x±s,n = 3)Fig.7 In vitro release profiles of ATO (x±s,n = 3) |
精密移取血浆样品100 μL置2 mL具塞离心管中,加入高氯酸40 μL,涡旋混合3 min,于12 000 r/min离心10 min,取上清液100 μL用稀硝酸稀释至5 mL,充分涡旋振荡后进样分析。
2.5.3 血浆中ATO测定方法的建立(1)仪器工作条件:RF功率1 500 W;冷却气流量15 L/min;等离子气流量15 L/min;载气流量0.81 L/min;辅助气流量0.22 L/min;采样深度8.1 mm;采样锥孔径1.0 mm;截取锥孔径0.4 mm;扫描次数3;重复次数3;雾化器100 μL石英同心微流雾化器。
(2)线性关系考察:精密移取砷标准溶液适量,至50 mL量瓶中,用稀硝酸稀释至刻度,配成质量浓度为20 mg/L的砷标准溶液,临用前稀释为系列浓度。精密吸取空白血浆100 μL 7份,分别加入系列质量浓度的标准溶液100 μL,得质量浓度分别为0、0.05、0.10、0.25、0.50、1.00、2.50 mg/L系列砷血浆溶液,按“2.5.2”项下方法处理后稀释进样。以分析峰的响应值为纵坐标(Y),质量浓度为横坐标(C)绘制出标准曲线并计算得到相关系数:Y=2 045.6 C+1 001.2,r=0.999 7,表明砷质量浓度在0.05~2.50 mg/L内线性关系良好。
(3)回收率和精密度试验:精密移取砷标准溶液适量,配制低、中、高3个质量浓度(0.05、0.5、2.5 mg/L)的血浆样品溶液,按“2.5.2”项下方法处理后进样测定,每个质量浓度平行测定3次,计算回收率。分别于日内测定5次,计算日内精密度。连续测定5 d,计算日间精密度。结果显示,低、中、高3个质量浓度血浆样品的回收率分别为(90.17±4.38)%、(91.65±5.12)%、(90.34±4.57)%;日内精密度分别为4.68%、4.25%、3.41%;日间精密度分别为9.77%、6.23%、5.46%。
(4)重复性试验:取同一血浆样品溶液6份,按“2.5.2”项下方法处理后进样测定,结果RSD为2.65%,符合方法学要求。
(5)稳定性试验:取低、中、高3个质量浓度(0.05、0.5、2.5 mg/L)的血浆样品溶液,室温放置,分别于 0、2、4、6、8、12、24 h按“2.5.2”项下方法处理后进样分析,结果RSD为2.78%(n=6),符合方法学要求。
2.5.4 数据处理采用PK Solver药动学程序分析数据,并计算药动学参数。采用SPSS 17.0软件对同类参数间进行t检验。
2.5.5 药动学结果大鼠尾iv ATO-Sol、ATO-MSNs混悬液、PAA-ATO-MSNs混悬液后,平均血药浓度-时间(C-t)曲线见图 8。药动学数据经拟合后符合开放式二室模型,所得主要药动学参数见表 2,并对其进行统计学分析。由图 8可以看出,PAA- ATO-MSNs组前5 h较ATO-Sol组和ATO-MSNs混悬液组药物浓度下降缓慢,5 h后各组血药浓度下降趋势相似。由表 2可知,与ATO-Sol组和ATO-MSNs混悬液组相比,PAA-ATO-MSNs混悬液组ATO的t1/2β延长,体内清除率(CL)减小,AUC显著提高(P<0.01),说明ATO制成PAA-ATO-MSNs后在大鼠体内具有缓释特点,PAA-MSNs改变了ATO在大鼠体内的药动学行为。
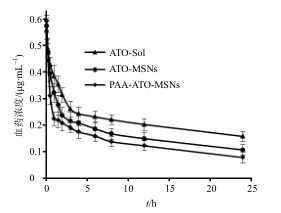 | 图 8 大鼠尾iv给药后ATO血浆药时曲线Fig.8 Profiles of mean drug concentration-timeof rats after iv injection ( x±s,n = 6) |
表 2 大鼠尾iv给药后ATO药动学参数 ( x±s, n = 6)
Table 2 Main pharmacokinetic parameters of ATO after tail vein injection in rats ( x±s,n = 6)|
| | |||||
本实验利用共沉淀法一步合成NH2-MSNs,此方法制备的MSNs内外表面兼有氨基,介孔有序,具有较大的比表面积和孔容,Zeta电位大于40 mV,为载酸性ATO提供了良好条件。实验结果表明,NH2-MSNs载药后,其Zeta电位明显下降,但仍带正电荷,可通过静电作用吸附带负电荷的PAA。红外光谱图中在1 652.72、1 720.22 cm-1处出现酰胺和羧基中C=O的伸缩振动峰,证明了PAA的存在,与文献报道一致[14, 15]。PAA的成功修饰依赖于与ATO-MSNs表面氨基及硅羟基的共价结合和静电吸
附双重作用。此外,通过小角粉末衍射、氮气吸脱附等表征可以发现载药和PAA包裹后MSNs介孔结构有序性降低,比表面积、孔容和孔径均减小,这些归因于静电吸附作用使ATO占据了NH2-MSNs内部孔道且PAA修饰后封堵了部分介孔。文献表明,粒径在100~200 nm内的纳米粒因其可增强EPR效应更易于在肿瘤部位蓄积[16]。本实验制备的PAA-ATO-MSNs粒径大小在158.6 nm左右,为PAA-ATO-MSNs向肿瘤组织富集提供了可能。
ATO为水溶性药物,为考察PAA-ATO-MSNs体外释药特性,选取不同pH值(5.0、6.0、7.4)的PBS溶液作为释放介质。PAA-ATO-MSNs的体外释药行为表现出明显的pH响应性,在pH 7.4条件下,ATO释放缓慢,24 h仅释放40.52%;随pH值减小释放量有所增大,在pH 5.0条件下24 h Q可达76.15%。主要由于在酸性条件下PAA质子化,溶解度变差易从载体上脱落,从而封堵的介孔被打开,释放出ATO;在中性或较高pH值条件下ATO则不易释放[17]。不同pH值条件下,ATO-MSNs的释药也表现出微弱的pH响应性,可能是由于随着pH值降低,MSNs内表面氨基质子化[18]且酸性药物ATO带电性下降,导致MSNs与ATO吸附能力减弱,从而有利于药物释放。由释放曲线还可看出,酸性条件下,PAA-ATO-MSNs中药物在2 h内存在一定的突释现象,而在pH 7.4下则很难释放,此结果提示了PAA-ATO-MSNs中ATO较适合肿瘤递药,在正常生理条件下不释药,从而更好地蓄积于肿瘤组织后快速释药,从而发挥增加对肿瘤抑制作用,减小对正常组织细胞毒性作用。
相关研究表明,MSNs是一种生物相容性好、可降解的无机材料,其在体内的代谢主要经过硅骨架的溶蚀降解和扩散过程,降解为游离硅离子后经肾脏滤过由尿液排出[11, 19, 20]。本实验以ATO-Sol为对照组,研究了大鼠尾iv PAA-ATO-MSNs后体内药动学行为。药动学结果表明,将ATO制备成PAA- ATO-MSNs后,CL降低约为ATO-Sol、ATO-MSNs的1/3、1/2,t1/2β延长为ATO-Sol、ATO-MSNs的2.3、1.7倍,可能是因为PAA在pH近中性的血液中溶解度较大,去质子化后与MSNs表面氨基酸碱共轭结合,ATO不易释放,与体外释药研究结果相符。因此,PAA-ATO-MSNs在大鼠体内释药具有缓释特性,可延长药物在血液循环中的滞留时间,有望促进药物向肿瘤靶部位分布。
| [1] | Iland H J, Seymour J F. Role of arsenic trioxide in acute promyelocytic leukemia [J]. Curr Treat Options Oncol, 2013, 14(2): 170-184. |
| [2] | 石瑞平, 郭树霞. 三氧化二砷治疗急性早幼粒性白血病患者骨髓和血液中砷分布的临床检测 [J]. 现代药物与临床, 2012, 27(3): 242-244. |
| [3] | 蔡 宝, 魏为添, 刘 岸, 等. 三氧化二砷对胰腺癌BXPC-3细胞移植瘤的体内抑制作用 [J]. 中草药, 2010, 41(1): 90-93. |
| [4] | Murgo A J. Clinical trials of arsenic trioxide in hematologic and solid tumors: overview of the national cancer institute cooperative research and development studies [J]. Oncologist, 2001, 6(Supplement 2): 22-28. |
| [5] | Kritharis A, Bradley T P, Budman D R. The evolving use of arsenic in pharmacotherapy of malignant disease [J]. Ann Hematol, 2013, 92(6): 719-730. |
| [6] | Liu B, Pan S, Dong X, et al. Opposing effects of arsenic trioxide on hepatocellular carcinomas in mice [J]. Cancer Sci, 2006, 97(7): 675-681. |
| [7] | Evens A M, Tallman M S, Gartenhaus R B. The potential of arsenic trioxide in the treatment of malignant disease: past, present, and future [J]. Leukemia Res, 2004, 28(9): 891-900. |
| [8] | 王晓瑜, 马满玲. 主动载药法制备三氧化二砷脂质体[J]. 中草药, 2014, 45(5): 648-651. |
| [9] | Thomas M J K, Slipper I, Walunj A, et al. Inclusion of poorly soluble drugs in highly ordered mesoporous silica nanoparticles [J]. Int J Pharm, 2010, 387(1): 272-277. |
| [10] | Lu J, Liong M, Li Z, et al. Biocompatibility, biodistribution, and drug-delivery efficiency of mesoporous silica nanoparticles for cancer therapy in animals [J]. Small, 2010, 6(16): 1794-1805. |
| [11] | Gao Q, Xu Y, Wu D, et al. pH-responsive drug release from polymer-coated mesoporous silica spheres [J]. J Phys Chem C, 2009, 113(29): 12753-12758. |
| [12] | Peng H, Dong R, Wang S, et al. A pH-responsive nano-carrier with mesoporous silica nanoparticles cores and poly(acrylic acid) shell-layers: Fabrication, characterization and properties for controlled release of salidroside [J]. Int J Pharm, 2013, 446(1): 153-159. |
| [13] | Kruk M, Jaroniec M. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials [J]. Chem Mater, 2001, 13(10): 3169-3183. |
| [14] | Yuan L, Tang Q, Yang D, et al. Preparation of pH-responsive mesoporous silica nanoparticles and their application in controlled drug delivery [J]. J Phys Chem C, 2011, 115(20): 9926-9932. |
| [15] | Li H W, Zhang J Z, Tang Q Q, et al. Reduction-responsive drug delivery based on mesoporous silica nanoparticle core with crosslinked poly(acrylic acid) shell [J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(6): 3426-3431. |
| [16] | Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs [J]. Cancer Res, 1986, 46(12): 6387-6392. |
| [17] | 曹 杰, 何定庚, 何晓晓, 等. pH响应的介孔二氧化硅纳米颗粒的制备及可控释放 [J]. 高等学校化学学报, 2012, 33(5): 914-918. |
| [18] | Liu J, Huang Y, Kumar A, et al. pH-Sensitive nano-systems for drug delivery in cancer therapy [J]. Biotechnol Adv, 2014, 32(4): 693-710. |
| [19] | He Q J, Shi J L, Zhu M, et al. The three-stage in vitro degradation behavior of mesoporous silica in simulated body fluid [J]. Micropor Mesopor Mat, 2010, 131(3): 314-320. |
| [20] | He X, Nie H, Wang K, et al. In vivo study of biodistribution and urinary excretion of surface-modified silica nanoparticles [J]. Anal Chem, 2008, 80(24): 9597-9603. |
 2015, Vol. 46
2015, Vol. 46


