傣药香面叶Lindera caudata (Nees) Hook. f.,别名毛叶三条筋、黄脉山胡椒、朴香根、芽三英(傣名),为樟科(Lauraeeae)山胡椒属Lindera Thunb.植物,是云南西双版纳州傣族常用的植物药。据《中药大辞典》报道,该植物具有止血生肌、理气止痛的作用,可用于治疗跌打扭伤、外伤瘀肿、出血、胸痛咳嗽[1]。目前对该植物化学成分的研究报道较少;目前仅Ye等[2]报道该植物中有异香豆素类化合物,以及彭霞等[3]从中分离到十八烷醇和4,5- dihydroblumenol A。为了深入了解香面叶茎皮化学成分,从中发现药用价值的先导性化合物,本实验对采于云南德宏的香面叶茎皮化学成分进行了研究,并从中分离到1个新8-O-4′-木脂素类化合物,为一新化合物,命名为香面叶木脂素A;MTT测试显示该化合物对NB4和SHSY5Y细胞具有明显的细胞毒活性。
1 材料和仪器Horiba SEPA-300型数字式旋光仪(日本Hofiba公司);UV-2401A紫外光谱仪(日本岛津公司);JASCO J-810圆二色光谱仪(日本分光公司);Bio-Rad FTS-185傅里叶变换红外光谱仪(美国伯乐BIO-RAD公司公司);DRX-500核磁共振仪(瑞士布鲁克公司);半制备HPLC分析仪器为岛津LC-8A型高效液相色谱仪,色谱柱为安捷伦公司Zorbax PrepHT GF(250 mm×21.2 mm,7 µm);80~100、200~300目硅胶均为青岛海洋化工厂产品;反相填充材料RP-18(40~63 μm),Merk公司产品;MCI填充材料为MCI-gel CHP-20P(75~150 μm,日本三棱公司生产);凝胶为Sephadex LH-20,美国CE公司产品。
本实验样品于2011年9月采自德宏傣族景颇族自治州梁河县,标本经云南傣药研究所黄青芳医师鉴定为樟科山胡椒属植物香面叶Lindera caudata (Nees) Hook. f. 的茎皮。
2 提取与分离香面叶茎皮干燥品2.5 kg,粉碎,过30目筛,用90%乙醇水溶液超声提取3次(每次加入溶剂5 L,提取时间4 h),合并提取液并减压浓缩到小体积,浓缩液用醋酸乙酯萃取2次(每次用醋酸乙酯2 L),回收醋酸乙酯得到萃取物85.2 g。萃取产物用MCI脱色,然后经硅胶柱色谱分离,以氯仿-丙酮(1∶0、9∶1、8∶2、7∶3、6∶4、1∶1、4∶6)洗脱机分为7个部位。其中三氯甲烷-丙酮6∶4部分(11.2 g)再次经硅胶柱色谱分离,以石油醚-醋酸乙酯(5∶1、2∶1、1∶1、1∶2、0∶1)梯度洗脱。石油醚-醋酸乙酯(1∶2)洗脱部分(1.26 g),以38%甲醇为流动相(体积流量12 mL/min),用Zorbax PrepHT GF制备柱分离,收集tR=36.5 min的组分,得到化合物1粗品;该粗品再次用甲醇溶解,经Sephadex LH-20凝胶柱色谱纯化(甲醇为流动相)得到化合物1(11.8 mg)。
3 结构鉴定化合物1:白色无定形固体。HR-ESI-MS m/z: 447.126 1 [M+Na]+(计算值447.126 7,C20H24NaO10),确定分子式为C20H24O10。[α]24.6D +35.6° (c 0.25,MeOH);CD (c 0.05,MeOH): Δε218 nm -2.25,Δε240 nm +18.2,Δε255 nm -7.63,Δε272 nm -5.87;${\rm{UV \lambda }}_{\max }^{{\rm{MeOH}}}$(nm): 330 (3.26),285 (3.68),215 (4.08),紫外光谱在330、285 nm有强吸收峰,说明化合物中有芳环结构;${\rm{IR }}\nu _{\max }^{{\rm{KBr}}}$(cm-1): 3 476,2 968,2 852,1 716,1 612,1 547,1 473,1 463,1 256,1 174,987,863,红外光谱显示化合物中具有羟基(3 476 cm-1)、羰基(1 716 cm-1)和芳环信号(1 612,1 547,1 473 cm-1)。由1H- NMR (500 MHz,C5D5N)、13C-NMR (125 MHz,C5D5N) 和DEPT数据(表 1)可知,化合物中有
| 表 1 化合物1的氢谱和碳谱数据 Table 1 1H-NMR and 13C-NMR data of compound 1> |
20个碳(9个季碳、6个叔碳、3个仲碳和2个伯碳)和24个氢信号,包括1个1,3,4,5-四取代苯环 [δC 133.1,106.9,151.6,137.6,153.2,104.1;δH6.83 (1H,s),6.71 (1H,s)]、1个对称的1′,3′,4′,5′-四取代苯环 [δC 131.9,108.3,148.2,139.3;δH 6.94 (2H,s)]、1个1,2-二芳基甘油结构片段[4] [δC 73.5,86.0,62.1;δH5.62 (1H,d,J = 7.2 Hz),5.30 (1H,m),4.19 (1H,m),4.50 (1H,d,J = 11.4 Hz)]、1个3-羟基-1-苯基-1-丙酮结构片段 [δC 198.5,41.8,59.0;δH3.41 (2H,t,J = 6.2 Hz),4.39 (2H,t,J = 6.2 Hz)][4]、2个甲氧基 [δC 60.9,55.9;δH3.84 (3H,s),3.80 (3H,s)] 以及3个酚羟基 [δH 11.33 (1H,brs),10.72 (2H,brs)]。同时,H-7/H-8、H-8/H-9和H-8′/H-9′存在1H-1H COSY相关,进一步证实了1,2-二芳基甘油和3-羟基-1-苯基- 1-丙酮结构片段的存在。在HMBC图谱中,H-7 (δH 5.62) 与C-1 (δC 133.1)、C-2 (δC 106.9)、C-6 (δC 104.1),H-8 (δH 5.30) 与C-1 (δC 133.1) 的HMBC相关(图 1)可推测甘油片段连接在C-1位;H-8′ (δH 3.41) 与C-1′ (δC 131.9) 的HMBC相关证实3-羟基- 1-丙酮结构片段连接在C-1′位;根据H-8 (δH 5.30) 与C-4′ (δC 139.3) 的HMBC相关,推测C-8通过氧原子和C-4′相连接。根据上述核磁共振信号和文献
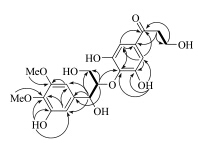 |
图 1 化合物1的1H-1H COSY ( |
报道[4]对比,证实了化合物1为8-O-4′-新异木脂素类化合物。根据2个甲氧基信号 (δH 3.84,3.80) 分别与C-4 (δC 137.6)、C-5 (δC 153.2) 有HMBC相关,证实2个甲氧基分别取代在C-4和C-5位;1个酚羟基信号 (δH 11.33) 与C-2 (δC 106.9)、C-3 (δC 151.6)、C-4 (δC 137.6) 有HMBC相关,证实该酚羟基取代在C-3位,另外2个酚羟基信号 (δH 10.72) 与C-4′ (δC 139.3)、C-3′,5′ (δC 148.2)、C-2′,6′ (δC 108.3) 有HMBC相关,证实这二个酚羟基分别取代在C-3′,5′位,至此化合物1的平面结构得到确认(图 2)。
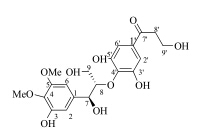 | 图 2 化合物1的结构Fig.2 Structure of compound 1 |
化合物1中有2个手性碳C-7和C-8,而H-7和H-8的耦合常数为J = 7.1 Hz,其耦合常数值和报道过的同类thro式化合物[5]一致,但和erythro异构体[6, 7]差别很大,由此确定其相对构型为thro式。化合物1的CD谱信号在240 nm处有正的Cotton效应,并且H-7和H-8,H-8和H-2,H-8和H-6之间存在明显的ROESY相关,证实化合物的绝对构型为7S,8S。至此,化合物1的结构得到确认,为1-(4-((1S,2S)-1,3-二羟基-1-(3-羟基-4,5-二甲氧基苯 基)丙烷-2-基氧基)-3,5-二羟基苯基)-3-羟基丙酮,并命名为香面叶木脂素A(caudatalignan A)。根据美国化学文摘(CA)光盘检索,该化合物为香面叶中首次报道的新异木脂素类化合物,命名为香面叶木脂素A。
4 细胞毒活性研究参照文献报道[8],采用MTT法测定细胞毒活性,以紫杉醇为阳性对照,所测试细胞株为急性早幼粒细胞白血病细胞(NB4)、人肺腺癌细胞(A549)、人神经母细胞瘤细胞(SHSY5Y)、人前列腺癌细胞(PC3)和人乳腺癌细胞(MCF7),均购于上海拜力生物科技有限公司。结果表明,化合物1对所选的5株细胞的IC50值均小于10 μmol/L,其中对NB4和SHSY5Y细胞具有较高的细胞毒活性,其IC50值分别为4.2、5.0 μmol/L。
| [1] | 江苏新医学院. 中药大辞典 (上册) [M]. 上海: 科学技术出版社, 1986. |
| [2] | Ye Y Q, Xia C F, Yang J X, et al. Isocoumarins from the bark of Lindera caudata [J]. Heterocycles, 2014, 89(10): 2369-2374. |
| [3] | 彭 霞, 姜明辉, 台海川. 傣药毛叶三条筋化学成分研究 [J]. 民族医药杂志, 2011(11): 36-37. |
| [4] | Chen Y K, Li X S, Yang G Y, et al. Phenolic compounds from Nicotiana tabacum and their biological activities [J]. J Asian Nat Prod Res, 2012, 14(5): 450-456. |
| [5] | Cavalcante S H, Yoshida M, Gottlieb O R. Neolignans from Virola carinata fruit [J]. Phytochemistry, 1985, 24(5): 1051-1055. |
| [6] | Fukagawa N, Ishizu A. Photoreaction of phenacyl aryl ether type lignols [J]. J Wood Chem Technol, 1991, 11(2): 263-289. |
| [7] | Yoshikawa M, Morikawa T, Xu F, et al. (7R,8S) and (7S,8R) 8-5' linked neolignans from Egyptian herbal medicine Anastatica Hierochuntica and inhibitory activities of lignans on nitric oxide production [J]. Heterocycles, 2003, 60(8): 787-1792. |
| [8] | Gao X M, Wang R R, Niu D Y, et al. Bioactive dibenzocyclooctadiene dibenzocyclooctadiene lignans from the stems of Schisandra neglecta [J]. J Nat Prod, 2013, 76(6): 1052-1057. |
 2015, Vol. 46
2015, Vol. 46

 ,
, 