2. 海南经贸职业技术学院, 海南 海口 571158
2. Hainan College of Economics and Business, Haikou 571158, China
根据《中国植物志》记载,凤梨科(Bromeliaceae)有45属,我国引种栽培2属,其中凤梨属Ananas Tourm. ex Linn. 有3种,我国栽培1种菠萝Ananas comosus (Linn.) Merr.[1],主要分布在海南、广东、广西、台湾、福建、云南等省区。菠萝叶是菠萝果实收获后的农业废弃物,据《中华本草》记载,菠萝叶具有消食合胃、止泻功能,主治夏日暑泻、消化不良、胃脘胀痛等[2]。目前,国内外学者已从菠萝叶中分离得到苯丙素类、酰胺类、三萜类化合物[3, 4]。Kataki等[5]对菠萝叶的乙醇提取物进行的活性研究表明其具有较好的抗氧化、抗菌和驱虫活性。在此基础上,本课题组前期对菠萝叶乙醇提取物及不同萃取部位进行抗菌活性筛选,发现醋酸乙酯部位对金黄色葡萄球菌和蜡状芽孢杆菌具有良好的抑制活性。为深入寻找菠萝叶中具有良好抗菌活性的化学成分,本实验对醋酸乙酯部位的化学成分进行了系统的研究,从中分离得到8个化合物,分别鉴定为tricin-4′-O-[10″-O-(8″-hydroxyl) feruloyl-(9′′′-O-p- coumaroyl) glyceryl] ether(1)、2,4-二氯苯甲酸(2,4- dichlorobenzoic acid,2)、小麦黄素(tricin,3)、金圣草黄素(chrysoeriol,4)、1-O-对羟基肉桂酰单甘油酯(1-O-p-coumaroylglycerol,5)、1-O-阿魏酰单甘油酯(1-O-feruloylglycerol,6)、1-O-阿魏酸-3-O-对羟基肉桂酰甘油酯(1-O-feruloyl-3-O-p-coumaroyl- glycerol,7)、1,3-二氧阿魏酰甘油酯(1,3-O- diferuloylglycerol,8)。其中化合物1为新化合物,目前仅在赤竹属山白竹Sasa veitchii (Carr.) Rehd.[6]和苞茅属红鞘草Hyparrhenia hirta L. Stapf.[7]中分离得到的一系列的结构类似的黄酮木脂素类化合物,其主要差异在于这些化合物中木脂素部分均通过醚键与黄酮连接,而1则是苯丙素部分与甘油成酯键,再通过醚键与黄酮连接,且未见对此类化合物进行进一步的药理活性测试。化合物2~4、6~8为首次从该植物中分离得到。化合物1~8的结构见图 1。
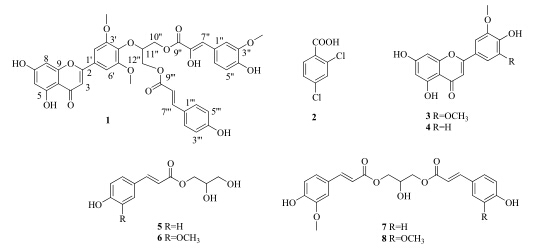 | 图 1 化合物1~8的结构Fig.1 Structures of compounds 1—8 |
Bruker AV-400 MHz型核磁共振仪(瑞士布鲁克公司);EYELA N-1001旋转蒸发仪(日本东京理化有限公司);EYELA COOLACE CA-IIII冷却水循环装置(日本东京理化有限公司);Sephadex LH-20凝胶(Amersham Blosclences公司);薄层硅胶GF254、柱色谱硅胶(200~300目)均为青岛海洋化工厂产品;所用试剂均为分析纯,购于西陇化工股份有限公司。
菠萝叶2012年9月采自海南万宁,经海南师范大学生命科学院钟琼芯副教授鉴定为凤梨科凤梨属植物菠萝Ananas comosus (Linn.) Merr. 的叶子,样本(编号:2012011)保存在海南师范大学省部共建教育部热带药用植物化学重点实验室。
供试细菌:金黄色葡萄球菌Staphylococcus aureus、大肠杆菌Escherichia coli、白色葡萄球菌Staphylococcus albus、蜡状芽孢杆菌Bacillus cereus、枯草芽孢杆菌Bacillus subtilis、藤黄八叠球菌Micrococcus luteus和四联球菌Micrococcus tetragenus,由海南师范大学生命科学学院微生物教研室提供。卤虫Artemia salina卵购于海风集团有限公司。
2 实验方法 2.1 提取与分离干燥菠萝叶20 kg,粉碎后用95%乙醇(5 L)室温下浸泡提取3次,浸泡时间分别为5、7、7 d,合并提取液减压浓缩得乙醇提取物1.0 kg,将乙醇提取物溶于水后,依次用石油醚、醋酸乙酯萃取。将得到的醋酸乙酯萃取物(约300 g)进行硅胶柱色谱,石油醚-醋酸乙酯(10∶0、9∶1、8∶2、7∶3、6∶4、1∶1、4∶6、3∶7、2∶8、1∶9、0∶10)梯度洗脱,TLC检测合并,得到20个组分Fr. A~T。Fr. B(85 mg)经硅胶柱色谱,石油醚-醋酸乙酯(10∶1→4∶1)洗脱纯化得化合物2(6.5 mg),Fr. D(150 mg)经硅胶柱色谱,石油醚-醋酸乙酯(4∶1→1∶1)洗脱纯化得化合物3(32.3 mg)、4(5.2 mg),Fr. M(132 mg)经反复硅胶柱色谱(氯仿-丙酮10∶1→4∶1)及Sephadex LH-20柱色谱(氯仿-甲醇2∶3)纯化得到化合物5(14.4 mg)、6(23.1 mg)、7(14.6 mg)、8(9.0 mg)。Fr. N(86 mg)经反复硅胶柱色谱(氯仿-丙酮4∶1→1∶1)、反相硅胶柱色谱(甲醇-水1∶1→4∶1)、Sephadex LH-20柱色谱(氯仿-甲醇2∶3)纯化得到化合物1(10.0 mg)。
2.2 活性测试 2.2.1 抑菌活性测试采用微量稀释法[8],测定化合物1~8的最小抑菌浓度(MIC)。
以胰蛋白胨(25 g)、酵母提取物(12.5 g)、NaCl(25 g)和蒸馏水(2 500 mL)配制2 500 mL的液体培养基。然后液体培养基接种各种菌种,将液体培养的枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、白色葡萄球菌、蜡状芽孢杆菌、四联球菌、藤黄八叠球菌用培养液按1∶1 000比例进行稀释。
分别配制1mg/mL的化合物1~8的DMSO溶液,用上述含菌的稀释培养液进行稀释配制成质量浓度为10.00、5.00、2.50、1.25、0.62、0.31、0.15、0.15 μg/mL的溶液,以相应浓度的不加样品的DMSO溶液为空白和相应浓度的环丙沙星为对照进行实验,分别加入96孔板中,用微量搅拌器震荡混匀后,置37 ℃恒温培养24 h,用酶标仪630 nm测吸光度(A)值。抑制试验菌生长的最低质量浓度即为MIC。
2.2.2 卤虫致死活性测试幼体培养:取卤虫Artemia salina卵120 mg置于2 000 mL锥形瓶中,加入处理过的海水1 200 mL,控制充气泵使缓缓充气,在光照条件下,在25 ℃水浴中孵化48 h后,除去卵壳及未孵化的卵,获得卤虫幼体备用。
测试方法:将海水煮沸,棉花滤过后备用。依照Solis改良法[9],取24孔培养板,每孔加入1 mL含卤虫幼体的溶液(每孔约20个卤虫),制成测试培养板。将化合物1~8分别用DMSO配制成1 mg/mL的溶液,加入至培养板孔中,每个化合物设置50、25、10 μg/mL 3个质量浓度梯度。每个质量浓度梯度的样品各设3个平行孔。培养24 h后,记录卤虫死亡个体数目。空白对照组加处理过的海水(1 mL),DMSO对照组含与测试样品相当浓度的DMSO(1 mL),同样品的测试条件培养计数。
评价方法:校正死亡率=(DMSO对照组存活率-样品组存活率)/DMSO对照组存活率。
3 结果与讨论 3.1 结构鉴定化合物1:黄色无定型粉末,HR-ESI-MS显示该化合物分子式为C39H34O15(m/z 741.182 5 [M-H]-;计算值741.181 9),不饱和度为23,[α]24D +12.5° (c 0.1,DMSO)。IR光谱显示:3 436 cm-1(羟基),1 649 cm-1(α,β-不饱和羰基)和1 649,1 512 cm-1(芳香环)。13C-NMR谱(表 1)显示化合物1中有39个碳,结合DEPT谱分析可知,其中18个季碳、15个叔碳、1个次甲基碳 (δC 66.1)、2个亚甲基碳 (δC64.8,65.4) 和3个甲基碳。由1H-NMR和13C-NMR谱(表 1):δH6.50 (1H,s),6.16 (1H,s) 和δC162.1,161.3,157.4,104.7,99.1,94.4为典型的黄酮A环5,7-二取代;δH7.35 (2H,s) 和δC 150.4×2,137.4,104.7×2表明B环为1,3,4,5-四取代,上述信号与化合物3谱图信息基本一致。差别在于该化合物1H-NMR低场区还多了1组AA′BB′系统氢的信号δH6.74 (2H,d,J = 8.4 Hz,H-3′′′,5′′′),7.46 (2H,d,J = 8.4 Hz,H-2′′′,6′′′) 以及1对反式双键氢信号δC 6.33 (1H,d,J = 16.0 Hz,H-8′′′),7.52 (1H,d,J = 16.0 Hz,H-7′′′),为典型反式-对香豆酰基的特征信号[6]。此外,芳香区还存在1组AMX系统氢信号 δH 7.39 (1H,d,J = 1.6 Hz,H-2″),6.79 (1H,d,J = 8.4 Hz,H-5″),7.25 (1H,dd,J = 1.6,8.4 Hz,H-6″),以及1个三取代双键质子的信号δH 6.92 (s,1H),δC 119.5,140.3,且HMBC谱图中该氢信号与C-9″ (δC 162.1),C-2″ (δC 114.1),C-6″ (δC 124.1) 相关,说明该片段为羟基连接在C-8″位上的阿魏酰基,组成8″-羟基-阿魏酰基[10]。饱和区还存在2个连氧的亚甲基信号δH 4.09 (2H,dd,J = 5.2,12.4 Hz,H-10″),3.96 (2H,dd,J = 5.2,12.4 Hz,H-12″) 和δC65.4,64.8,1个连氧的次甲基信号 δH 3.88 (1H,m,H-11″) 和δC 66.1,为典型丙三醇信号;此外,分子中还存在3个甲氧基信号δH3.83 (6H,s),3.71 (3H,s)。
| 表 1 化合物1的NMR数据 (400/100 MHz,DMSO-d6) Table 1 NMR spectral data (400/100 MHz,DMSO-d6) of compound 1 |
HMBC谱(图 2)显示,δH 3.71处甲氧基与δC 147.3 (C-3″) 相关,δH3.83处甲氧基与δC 147.3 (C-3′),147.3 (C-5′) 相关,说明3个甲氧基分别连在C-3″,3′,5′上;H2-10″ (δH 4.09) 与C-12″ (δC 64.8),C-9″ (δC 162.1) 相关,H2-12″ (δH 3.96)与C-10″ (δC 65.4),C-9′′′ (δC 166.3) 相关,说明8″-羟基-阿魏酰基连在C-10″上。而反式-对香豆酰基连在C-12″上。
NOESY谱(图 3)中,3′-OCH3 (δH 3.83),5′-OCH3 (δH 3.83) 分别与H-10″ (δH 4.09),H-12″ (δH 3.96) 有
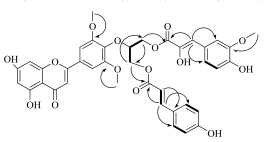 |
图 2 化合物1的1H-1H COSY ( |
相关点;另外,甘油的C-10″及C-12″的羟基已被酯化;因此结合质谱可以推断出C-11″ (δC 66.1) 与C-5′ (δc 137.4) 通过一个氧桥相连[10]。而H-7″ (δH 6.92) 与H-2″ (δH 7.39) 有相关点,说明Δ7″为cis式[11]。再结合由1H-1H COSY和HSQC相关谱数据对化合物中碳信号进行一一归属,进一步确定化合物1的结构为tricin-4′-O-[10″-O-(8″-hydroxyl) feruloyl- (9′′′-O-p-coumaroyl) glyceryl] ether(图 2)。化合物1在C-11″位存在1个手性中心,因此多次尝试对该化合物进行单晶培养,通过单晶衍射来确定其构型,但发现其很难结晶。由于实验室条件限制以及化合物量不多从而未确定该化合物的绝对构型。
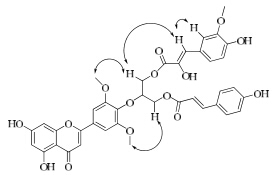 |
图 3 化合物1的NOESY ( |
经1H-NMR、13C-NMR、质谱等波谱学方法分析,并与文献对照,确定化合物2~8的结构分别为2,4-二氯苯甲酸(2)[12]、小麦黄素(3)[13]、金圣草黄素(4)[14]、1-O-对羟基肉桂酰单甘油酯(5)[3]、1-O-阿魏酰单甘油酯(6)[15]、1-O-阿魏酸-3-O-对羟基肉桂酰甘油酯(7)[16]、1,3-二氧阿魏酰甘油酯(8)[17]。其中化合物2为首次从植物中分离得到,文献报道仅通过合成[18]或从微生物中分离得到[12]。
3.2 抗菌活性测试结果采用微量稀释法评价化合物1~8对7种细菌的抑制活性。抗菌结果显示(表 2),化合物1对金黄色葡萄球菌和大肠杆菌表现出与阳性对照环丙沙星相当的抑制活性,MIC达到0.156 μg/mL。化合物5对金黄色葡萄球菌、白色葡萄球菌、大肠杆菌表现出与阳性对照环丙沙星相当的抑制活性,MIC达到0.156、0.313、0.156 μg/mL。而化合物3对白色葡萄球菌和大肠杆菌表现出与阳性对照环丙沙星相当的抑制活性,MIC分别为0.313、0.156 μg/mL。
3.3 卤虫致死活性测试结果卤虫致死活性测试结果显示,在所测试的质量浓度范围(50、25、10 μg/mL)内,化合物1和4有较好的活性,其IC50值分别为21.4和25.0 μg/mL。
| 表 2 化合物1~8抑菌活性测试结果 Table 2 Antibacterial activity of compounds 1—8 |
本实验从菠萝叶中分离得到8个单体化合物,包括1个新的黄酮木脂素类化合物;除化合物5外,其余化合物均首次从该植物中分离得到,具有重要的化学分类学意义。同时部分化合物表现出优良抑菌活性和卤虫致死活性,为菠萝叶这一废弃物的综合开发利用奠定理论基础。
| [1] | 钱崇澍, 陈焕镛. 中国植物志 (第13卷) [M]. 北京: 科学出版社, 1991. |
| [2] | 胡熙明, 张文康. 中华本草 (第8卷) [M]. 上海: 上海科学技术出版社, 1999. |
| [3] | 王 伟, 丁 怡, 邢东明, 等. 菠萝叶酚类成分研究 [J]. 中国中药杂志, 2006, 31(15): 1242-1244. |
| [4] | 王金萍, 王宏英, 杜力军, 等. 菠萝叶中新的酰胺类成分 [J]. 中国中药杂志, 2007, 32(5): 401-403. |
| [5] | Kataki M S. Antibacterial activity, in vitro antioxidant activity and anthelmintic activity of ethanolic extract of Ananas comousus L. tender leaves [J]Pharmacologyonline, 2010, 2(8): 308-319. |
| [6] | Yuki N J, Young S Y, Akira K. Six new flavonolignans from Sasa veitchii (Carr. ) Rehder [J]. Tetrahedron, 2003, 59(40): 8011-8015. |
| [7] | Mohamed B, Nigel C V, Renee J G, et al. Flavonolignans from Hyparrhenia hirta [J]. Phytochemistry, 2002, 60(5): 515-520. |
| [8] | 强 毅, 王政军, 陈克克, 等. 费菜多酚含量的测定及体外抗菌活性研究 [J]. 食品工业科技, 2013, 34(5): 53-56. |
| [9] | Solis P N, Wright C W, Anderson M M, et al. A microwell cytotoxicity assay using Artemia salina (brine shrimp) [J]. Planta Med, 1993, 59(3): 250-252. |
| [10] | Hitomi B, Yasunori Y, Masao K K. Constituents of the roots of Ligularia dentata Hara [J]. J Nat Med, 2007, 61(4): 472-473. |
| [11] | 朱德荣, 祝 丹, 陈 玉, 等. 野花椒中2个新苯丙素成分的研究 [J]. 有机化学, 2013, 33(3): 1345-1348. |
| [12] | Anthony D W, Gabriele M K. Ambigol C and 2,4-dichlorobenzoic acid, natural products produced by the terrestrial cyanobacterium Fischerella ambigua [J]. J Nat Prod, 2005, 68(4): 459-461. |
| [13] | Li H B, Zhou C X, Pan Y X, et al. Evaluation of antiviral activity of compounds isolated from Ranunculus sieboldii and Ranunculus sceleratus [J]. Planta Med, 2005, 71(12): 1128-1131. |
| [14] | Hiroshi N, Naoyuki K, Mitsuru Y. Isolation and identification of flavonoids accumulated in proanthocyanidin-free barley [J]. J Agric Food Chem, 2011, 59(17): 9581-9587. |
| [15] | Luo J G, Li L, Kong L Y, et al. Preparative separation of phenylpropenoid glycerides from the bulbs of Lilium lancifolium by high-speed counter-current chromatography and evaluation of their antioxidant activities [J]. Food Chem, 2012, 131(3): 1056-1062. |
| [16] | 陶华明, 王隶书, 赵大庆, 等. 羊齿天门冬根中酚酸类化学成分研究 [J]. 中草药, 2011, 42(11): 2181-2185. |
| [17] | Shimomura H K, Sashida Y K, Mimaki Y R. Phenolic glycerides from Lilium auratum [J]. Phytochemistry, 1987, 26(3): 844-845. |
| [18] | 张永华, 张 敏. 2,4-二氯苯甲酸的制备 [J]. 精细石油化工, 2002(4): 11-13.[29] 七十六种药材商品规格标准 [S]. 1984. |
 2015, Vol. 46
2015, Vol. 46


