蓝桉Eucalyptus globulus Labill. 是桃金娘科(Myrtaceae)桉属植物,又名灰杨柳、玉树、小球桉树、蓝油木等。蓝桉原产于澳大利亚,19世纪末引种到中国,多分布于福建、广东、广西、云南、贵州、四川、江西等地[1]。蓝桉的全草均可入药,但临床多用其果实。其果实民间俗称红喇叭花、扣子七、胜利果等,因其形状酷似倒挂的小钟,俗称“一口盅”,属我国西南民间常用中药。民间多用来治疗感冒、痢疾、肠炎、关节痛、济癣、丹毒、湿疫及痈疫肿毒等[2]。
1 化学成分蓝桉中的化学成分主要有挥发油类、间苯三酚衍生物、黄酮类、三萜类、鞣质酸类以及其他化合物。
1.1 挥发油类挥发油是蓝桉中主要成分,其种类和数量比较多,并且具有一定的抗菌、抗氧化等活性,国内外学者对蓝桉中的挥发油类成分研究也较为深入。1985年,孙汉董等[3]对蓝桉中的桉叶油进行了成分分析,通过气质联用(GC-MS)技术鉴定了其中17个挥发油类成分。1990年,肖顺昌等[4]对一口盅的挥发油成分进行了研究,利用气相色谱分离65个成分,鉴定36个挥发油类成分。1991年,罗嘉梁等[5]对3种桉叶油的化学成分进行了分析,测定了其中26种挥发油类成分的量。1997年,Silvestre等[6]利用GC-MS技术分析蓝桉树叶中挥发油类成分,鉴定其中25个成分并进行了测定。2004年,刘玉明[7]对蓝桉果实中的挥发油类成分进行了分析,鉴定了其中31个挥发油类成分。2005年,杨洪波等[8]对黔产蓝桉果实中的挥发油类成分进行了GC-MS分析,确定其中26个挥发油类成分并进行定量。2008年,王颖等[9]对蓝桉叶中的挥发油类成分进行了成分分析,确定了54个组分,并对这些组分的量进行了测定。2009年,宋爱华等[10]利用GC-MS技术,对云南产蓝桉叶中的挥发油类成分进行了成分分析,确定了47个组分,采用面积归一化法对这些组分的量进行了测定。
1.2 间苯三酚衍生物间苯三酚衍生物是桉属植物中特有的一类化合物,它常与单萜及倍半萜结合,形成一种结构新颖的化合物。因为所结合的单萜及倍半萜类化合物结构多变,种类也比较多,因此,所形成的间苯三酚衍生物种类较多。1980—1982年,Kozuka课题组[11, 12, 13, 14]从蓝桉中分离得到11个该类化合物euglobal-Ia1(1)、euglobal-Ia2(2)、euglobal-Ib(3)、euglobal-Ic(4)、euglobal-IIa(5)、euglobal-IIb(6)、euglobal-IIc(7)、euglobal-III(8)、euglobal-IVb(9)、euglobal-V(10)、euglobal-VII(11),拉开了从蓝桉中分离间苯三酚类化合物的序幕。1992年,Nishizawa等[15]从蓝桉中分离得到了5个间苯三酚类化合物macrocarpal A(12)、macrocarpal B(13)、macrocarpal C(14)、macrocarpal D(15)、macrocarpal E(16)。1995年,Osawa等[16]从蓝桉树叶中分离得到1个该类化合物eucalyptone(17)。1996年,Osawa等[17]从蓝桉叶中分离得到3个该类化合物,分别为macrocarpal H(18)、macrocarpal I(19)、macrocarpal J(20)。2007年,Yin等[18]从蓝桉的果实中分离得到3个该类化合物,分别为eucalyptal A(21)、eucalyptal B(22)和eucalyptal C(23)。2012年,Wang等[19, 20]报道从蓝桉果实中分离得到4个该类化合物eucalyptals D(24)、eucalyptals E(25)、euglobal-In-1(26)和euglobal-In-3(27)。从蓝桉中分离得到的间苯三酚类化合物的结构见图 1。
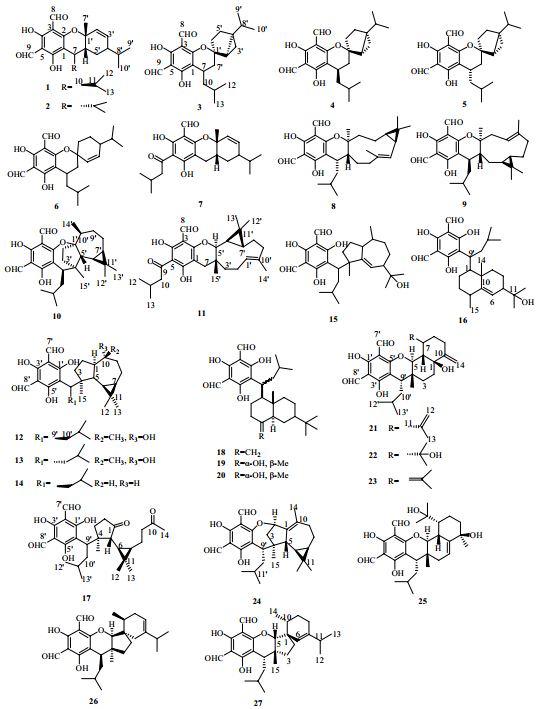 | 图 1 蓝桉中分离得到的间苯三酚类化合物Fig. 1 Phloroglucinols isolated from E. globulus |
2000年,Yun等[21]从蓝桉中分离得到7种黄酮类物质,分别为鼠李秦素(rhamnazin,28)、鼠李素(rhamnetin,29)、圣草酚(eriodictyo,30)、槲皮素(quercetin,31)、花旗松素(taxifolin,32)、黄杞苷(engelitin,33)和儿茶素(catechin,34)。2004年,刘玉明[7]从蓝桉果实中分离得到1个该类化合物山柰酚(kaempferol,35)。2006年,谈满良等[22]从蓝桉果实中分离得到1个该类成分,为5-羟基-4′,7-二甲氧基-6-甲基黄酮(5-hydroxyl-4′,7- dimethoxy-6-methyflavone,36)。2011年,隋晓丽[23]从蓝桉的果实中分离得到1个该类化合物5-羟基- 4′,7-二甲氧基-6,8-二甲基黄酮(5-hydroxyl-4′,7- dimethoxy-6,8-dimethyflavone,37)。2012年,Santos等[24]报道,运用超临界萃取技术,从蓝桉树皮提取物中分得黄酮类物质异鼠李素-7-O-β-D-葡萄糖苷(isorhamnetin-7-O-β-D-glucoside,38)、异鼠李素- 7-O-β-D-葡萄糖苷(isorhamnetin-7-O-β-D-rhamnoside,39)、mearnsetin(40)、mearnsetin-7-O-β-D-rhamnoside(41)、毛地黄黄酮(luteolin,42)、异鼠李素(isorhamnetin,43)、柚皮素(naringenin,44)。2014年,Chen等[25]从蓝桉叶中分离得到1个该类化合物槲皮素-3-O-β-D-葡萄糖醛酸(quercetin-3-O-β-D- glucuronide,45)。从蓝桉中分离得到的黄酮类化合物结构见图 2。
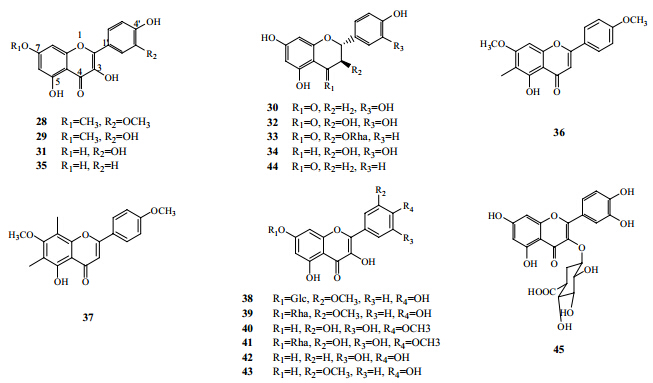 | 图 2 蓝桉中分离得到的黄酮类化合物Fig. 2 New components isolated from mistletoe medium for PSB biotransforming |
蓝桉中的三萜类化合物主要是五环三萜,分为乌苏烷型、齐墩果烷型和羽扇豆烷型三萜皂苷元,目前分离得到的三萜类化合物以乌苏烷型居多。1997年,Santos等[26]报道,从蓝桉树皮中分离得到了一系列的三萜类化合物,其中包括:β-香树素(β- amyrin,46)、乙酰熊果酸(acetylursolic acid,47)、乙酰齐墩果酸(acetyloleanolic acid,48)、乙酰白桦脂酸(acetylbetulinic acid,49)、高根二醇(erythrodiol,50)、熊果醇(uvaol,51)、11α-甲氧基乙酰熊果酸甲酯(11α-methoxyacetylursolic acid methyl ester,52)、白桦酯酸甲酯(betulinic acid methyl ester,53)、cis-p-methoxy-cinnamoyloxyursolic acid methyl ester(54)、cis-p-methoxy-cinnamoyl- oxyoleanolic acid methyl ester(55)、trans-p- methoxycinnamoyl-oxyursolic acid methyl ester(56)、熊果酸甲酯(ursolic acid methyl ester,57)、methyl 3β,23-diacetoxy-12-ursen-28-oate(58)。2002年,陈斌等[27, 28]报道,从蓝桉果实中分离得到5个该类化合物,分别为桦木酮酸(betulonic acid,59)、白桦脂酸(betulinic acid,60)、熊果酸(ursolic acid,61)、2α-羟基白桦脂酸(alphitolic acid,62)、2-羟基熊果酸(colosolic acid,63)。2005年,Freire等[29]从蓝桉树皮中分离得到1个该类化合物齐墩果酸(oleanolic acids,64)。2007年,杨秀伟等[30]从蓝桉果实中分离得到该类化合物2α,3α,19α-三羟基乌苏- 12-烯-28-酸(65)。2007年,谈满良等[31]从蓝桉果实中分离得到该类物质,分别为3β-乙酰氧基-乌索-11,12-烯-28,13β-内酯(66)、3β-羟基-乌索-11,12-烯-28,13β-内酯(67)。2010年,Domingues等[32]报道从蓝桉树皮中分离得到白桦脂醇(betulin,68)、2α,3α-氧-异丙叉基-羽扇豆-20(29)-烯-28-酸 [2α,3α-isopropylidenedioxy-lup-20(29)-en-28-oieaeid,69] 和3β-甲酰氧基-乌索-11,12-烯-28,13β-内酯(3β- formyloxyurs-11-en-28,13-olide,70)。2012年,王冀[20]从蓝桉果实中分离得到ursonic acid(71)、ilelatifol D(72)和山楂酸(maslinic acid,73)。从蓝桉中分离得到的三萜类化合物的结构见图 3。
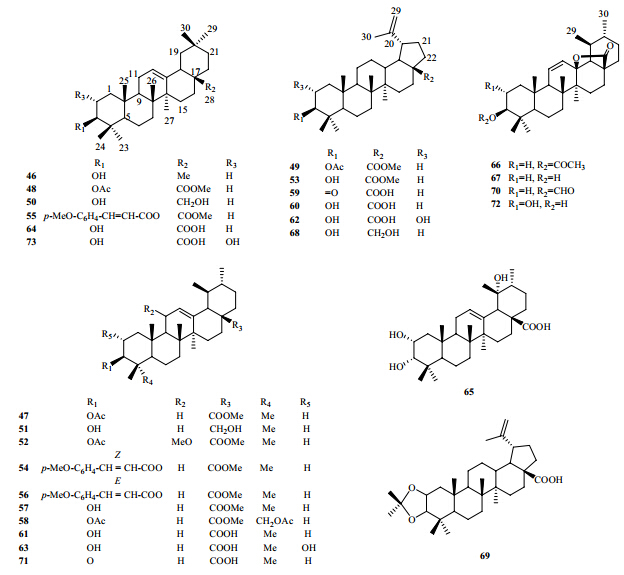 | 图 3 蓝桉中分离得到的三萜类化合物Fig. 3 Triterpenoids isolated from E. globulus |
1976年,Yazaki等[33]从蓝桉树皮中鉴定了5个该类化合物鞣花酸(ellagic acids,74)、3-O- methylellagic acid-4′-rhamnoside(75)、3,4,3′-O- trimethylellagic acid(76)、3,3′-O-dimethylellagic acid(77)、3,4,3′,4′-O-tetramethylellagic acid(78)。2001年,Kim等[34]从蓝桉树皮中分离得到4个该类化合物,分别为3-O-methylellagic acid 3′-O-α-rhamno- pyranoside(79)、3-O-methylellagic acid 3′-O-α-3″-O- acetylrhamnopyranoside(80)、3-O-methylellagic acid 3′- O-α-2″-O-acetylrhamnopyranoside(81)、3-O-methylellagic acid 3′-O-α-4″-O-acetylrhamnopyranoside(82)。2007年,杨秀伟等[30]从蓝桉果实中分离得到3个该类化合物,分别为3-甲氧基鞣花酸-4′-O-2″-O-乙酰基- α-L-吡喃鼠李糖苷(83)、3-甲氧基鞣花酸(84)。2012年,Santos等[24]采用超临界萃取技术,从蓝桉树皮中分离得到该类化合物4-甲氧基鞣花酸(85)。从蓝桉中分离得到的鞣花酸类化合物的结构见图 4。
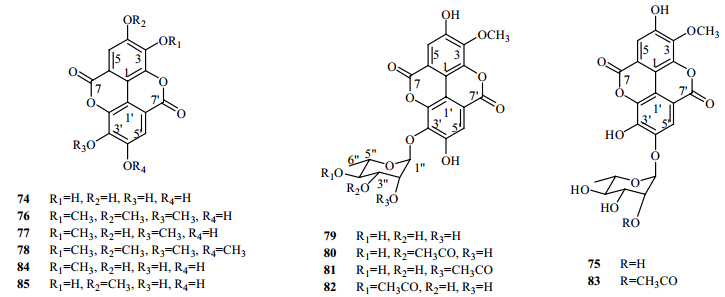 | 图 4 蓝桉中分离得到的鞣花酸类化合物Fig. 4 Ellagic acids isolated from E. globulus |
1997年,Santos等[26]从蓝桉树皮中分离得到了1个甾体类化合物tetra-acetyldaucosterol。2002年,陈斌[28]从蓝桉果实中分离得到β-谷甾醇、胡萝卜苷。2009年,Vanka等[35]从蓝桉树皮中分离得到2个甾酮类化合物(+)-6α,7α-epoxy-5a-hydroxy-1- oxowitha-2,24-dienolide和withanolide A。王冀[20]从蓝桉果实中分离得到1个过氧化甾醇5α,8α- epidioxy-24(R)-methylcholesta-6,22-dien-3β-ol。
1.7 其他化合物除了以上几类化合物之外,蓝桉中还含有倍半萜类、二萜类、酚酸类等化合物。蓝桉中的其他化合物包括:gallic acids[33]、vomifoliol、2,6-二甲氧基对苯醌、3,4,5-三甲氧基乙酰苯酚、2,4,6-三甲氧基乙酰苯酚[26]、eucaglobulin 1[36]、tellimagrandin I、eucalbanin C、2-O-digalloyl-1,3,4-tri-O-galloyl-β-D- glucose、6-O-digalloyl-1,2,3-tri-O-galloyl-β-D-glucose[37]、3,4,5-trimethoxyphenol 1-O-β-D-(6′-O-galloyl) gluco- pyranoside、methyl gallate[21]、8,8′-dimethoxy-[4,4′] bi [dibenzpfuranyl]-3,6,7,3′,6′,7′-2,2′-di-[O-α-Rha]、[4,4′] bi[dibenzofuranyl]-3,6,7,8,3′,6′,7′,8′-decaol-2,2′-di-[O- α-Glu]、桉油精、α-愈创木烯[28]、阿魏酸酯、β-amirin palmitic、linoleic、oleic acids[29]、blumenol A、蓝桉醇、绿花白千层醇、二十二烷酸[22]、pinoresinol、桉叶苷[30]、云杉靴酚、十八烷酸、丁香脂素[23]、原儿茶酸(protocatechuic acid)、digalloylglucose[24]、oleuropeic acid[20]、ethyl gallate、tellimagrandin II、chlorogenic acid、3-O-galloyl-4,6-O-[(S)-hexahydroxy- diphenoyl]-D-glucose、pedunculagin、1,2,3,4,6-penta-O- galloyl-β-D-glucose[25]。
刘玉明等[38]研究表明,蓝桉果实中含有多种氨基酸,其中人体必需氨基酸有7种。
2 药理作用蓝桉的叶和果实均可入药,具有疏风散热、抑菌消炎、防腐止痒的功能,用于预防流行性感冒、流行性脑脊髓膜炎,治疗上呼吸道感染、咽喉炎、支气管炎、肺炎;外用治疗烧烫伤、蜂窝组织炎,是中国传统民间中草药,临床多用其果实。
现代药理学研究表明,蓝桉具有抗菌、抗病毒、抗肿瘤、抗氧化及其他作用。
2.1 抗菌和抗病毒作用抗菌和抗病毒活性是蓝桉及其所含成分的主要活性,国内外学者对其这方面活性研究比较多。
Takasaki等[39]对蓝桉树皮及花芽中分离得到的12个间苯三酚类化合物及其类似物进行了抗人类疱疹病毒(epstein-barr virus,EB)研究。实验结果表明,euglobal-III(8)表现出较强的抑制EB活性,euglobal-Ib(3)和euglobal-IIa(5)显示出显著的活性。1995年,Osawa等[16]对蓝桉叶中分离得到的间苯三酚类化合物eucalyptone(17)进行了抗致龋菌实验,研究结果表明,eucalyptone对变形链球菌和茸毛链球菌都有较好的抑制作用。Osawa等[17]对蓝桉所含间苯三酚类物质抑制革兰阴性菌活性进行了研究。研究结果表明,macrocarpal A(12)、B(13)、C(14)、D(15)和H(16)对革兰阴性菌具有显著的抑制活性。Nishizawa等[15]对间苯三酚类化合物抑制HIV活性进行了研究,结果表明,macrocarpal A~E(12~16)对HIV转录酶具有抑制活性。Hou等[37]研究了蓝桉叶提取物的抗菌活性,研究表明分离得到的化合物eucaglobulin 1、telliniagrandin I和cucalbanin C对多种病菌均具有抑制活性。陈斌[28]对蓝桉果实中的化合物进行了抗菌活性筛选,结果显示,桉油精、白桦脂酸、熊果酸、2-羟基白桦脂酸、2-羟基熊果酸、β-谷甾醇具有较强的抗菌活性。对化合物白桦脂酸、熊果酸、2-羟基白桦脂酸、2-羟基熊果酸、β-谷甾醇进行抗乙肝病毒体外筛选实验,结果显示,熊果酸和2-羟基白桦脂酸对HBsAg有较好的抑制作用,浓度为0.012 5 μmol/mL时抑制率分别为47.0%和39.9%;白桦脂酸、熊果酸、2-羟基白桦脂酸和β-谷甾醇浓度为12.5 μmol/L时对HBeAg的抑制作用分别为3.4%、12.3%、23.6%和13.6%。吴磊等[40]研究了蓝桉叶提取物对植物病原菌的生长抑制作用,实验结果表明,蓝桉叶片的石油醚和氯仿提取物对5种植物病原菌的菌丝生长均有不同程度的抑制作用,其中,氯仿提取物的活性高于石油醚提取物。在供试的5种病原菌中,氯仿提取物对水稻稻瘟病的抑制作用最强,其半数有效浓度(EC50)值为58.75 μg/mL。
Vilela等[41]研究发现,蓝桉精油对黄曲霉和寄生曲霉具有抑制活性。Tyagi等[42]发现蓝桉提取物中的水溶性成分和脂溶性成分均具有显著的抗菌活性,对细菌和真菌的最低抑制浓度(MIC)2.25~9 mg/mL,对酵母菌的MIC 1.13~2.25 mg/mL。Obiorah等[43]对蓝桉叶提取物的抗菌活性进行了研究,实验结果表明,蓝桉叶提取物对金黄色葡萄球菌和枯草芽孢杆菌均有较强的抑制活性。Bachir等[44]对桉树精油抑菌活性进行了测试,结果表明,桉树叶精油对大肠埃希氏菌(革兰阴性菌)和金黄色葡萄球菌(革兰阳性菌)均具有显著的抑制活性。
2.2 抗肿瘤作用蓝桉的抗肿瘤活性研究主要集中在其中的间苯三酚类化合物和三萜类化合物。
Yin等[18]对蓝桉中的间苯三酚类物质的抗肿瘤活性进行了研究,研究结果表明,eucalyptal A~C(21~23)对HL-60和A-549肿瘤细胞都具有较好的抑制活性。陈斌[28]对蓝桉果实中的化合物进行了抗肝癌活性筛选,对白桦脂酸、熊果酸、2-羟基白桦脂酸和β-谷甾醇进行抗肝癌生物活性体外筛选,结果表明,白桦脂酸、熊果酸、2-羟基白桦脂酸和β-谷甾醇浓度为1 μmol/L时抑制率分别为53.7%、56.2%、65.5%和51.3%。刘玉明[7]对蓝桉果实中分离得到的化合物进行了抗肿瘤活性筛选,实验结果表明,macrocarpal B(13)对人肝癌细胞(Huh-7)、人胃癌细胞(AGS)、人食管癌细胞(Eca-109)、人肾癌细胞(786-0)、人肺癌细胞(A549)、人结肠癌细胞(CS-174-7)的抑制率分别为91.75%、91.6%、89.46%、90%、92%、89%;对人口腔癌细胞(KB)、人白血病细胞(K562)抑制率较低,分别为81.9%、82.8%。Wang等[19, 20]研究了蓝桉所含成分的抗肿瘤活性,实验结果显示,eucalyptal D(24)、eucalyptal E(25)和euglobal-In-3(27)对Huh-7、Jurkat、BGC- 823和KE-97均具有显著的细胞毒活性。
2.3 抗氧化作用蓝桉中含有较多的酚类物质,此类化合物往往具有还原性,从而表现出一定的抗氧化作用。
Yun等[21]对蓝桉根皮中分离得到的黄酮及酚酸类物质的抗氧化活性进行了研究,结果显示,这些化合物均具有显著抗氧化活性(活性强于维生素E),其中黄酮类活性较高。Kim等[34]对蓝桉根皮中的鞣花酸类化合物进行了研究,研究结果显示,分离得到的鞣花酸类物质均具有较好的抗氧化活性。Amakura等[45]研究发现,蓝桉叶提取物具有抗氧化活性,其抗氧化活性主要来源于提取物中多酚类物质。González等[46]研究发现蓝桉提取物具有较强的抗氧化活性,其活性是2,6-二叔丁基对甲酚(BHT)的12倍。Chen等[25]研究了蓝桉叶中分离得到的化合物的抗氧化活性,研究结果表明,分离得到的化合物均具有显著的抗氧化活性,其中1,2,3,4,6- penta-O-galloyl-β-D-glucose的抗氧化活性最强。
2.4 其他作用焦淑萍等[47]对蓝桉的抗炎镇痛作用进行了研究,表明蓝桉果实的乙醇浸膏,可显著减轻小鼠耳廓肿胀和提高毛细血管通透性,明显抑制大鼠棉球肉芽肿,有明显的抗炎镇痛作用。Zhao等[48]研究了蓝桉精油对大鼠急性和慢性肺炎的作用,研究结果表明,蓝桉精油对肺炎具有显著的抑制作用,其作用机制是通过抑制氧化应激反应和调节抗氧化转录因子Nrf2表达。同时也有可能是通过抑制核因子-κB(NF-κB)而表现出抗肺炎活性。
Gray等[49]研究发现,在食物和饮水中分别以62.5、2.5 g/kg的剂量加入桉叶提取物,能控制小鼠模型的高血糖症和与之相关的体质量,结果显示,蓝桉叶提取物对高血糖小鼠具有降血糖作用。
Ikawati等[50]研究了蓝桉叶和果实提取物抑制组胺释放的活性,研究结果表明,在0.5 mg/mL时,提取物能够很好地抑制组胺的释放。
陈昭等[51]对一口盅提取液保护心肌缺血及耐缺氧作用进行研究,实验结果表明,一口盅提取液能明显提高小鼠耐缺氧能力,预防由垂体后叶素所诱发的急性心肌缺血性心电图的变化,说明一口盅提取液能对实验性心肌缺血及耐缺氧有明显的保护作用。
周建娅等[52]研究发现,蓝桉油预处理可抑制脂多糖(LPS)诱导的NF-κB/p65核转位,从而抑制了其活性功能的发挥。研究表明,蓝桉油可抑制LPS刺激引起的NF-JB核转位活化。
3 结语近些年来,国内外学者从蓝桉中分离得到了多种化合物,对这些化合物的生物活性也进行了研究。现代研究表明,蓝桉具有多种生物活性,如抗肿瘤、抗菌、抗病毒、降血糖、消炎镇痛等作用,但目前对蓝桉的研究还不够深入,如对蓝桉中抗菌、抗病毒作用成分众说纷纭,国内外学者说法不一;蓝桉降血糖作用的物质基础尚不明确;蓝桉中某些间苯三酚类物质抗肿瘤活性显著,是否存在毒性;蓝桉提取物具有抗氧化作用的是哪种酚酸类成分,其具体的作用机制等都有待进一步研究。
同时,我国是世界上人工种植蓝桉最多的国家之一,也是世界上桉树油的最大出口国,而对蓝桉的研究还相对比较薄弱,对我国产蓝桉进行系统研究将有利于蓝桉资源的综合利用。
| [1] | 中国医学科学院药用植物资源开发研究所. 中药志 [M]. 北京: 人民卫生出版社, 1994. |
| [2] | 江苏新医学院. 中药大辞典 [M]. 上海: 科学技术出版社, 1985. |
| [3] | 孙汉董, 丁靖垲, 丁立生, 等. 桉叶油的化学成分 [J]. 云南植物研究, 1985, 7(3): 351-354. |
| [4] | 肖顺昌, 温鸣章, 伍岳宗, 等. 中草药"一口钟"的原植物鉴定及其精油的化学成分 [J]. 天然产物研究与开发, 1990, 12(2): 51-54. |
| [5] | 罗嘉梁, 宋永芳. 三种桉叶油化学成分研究 [J]. 天然产物研究与开发, 1991, 3(3): 79-83. |
| [6] | Silvestre A J D, Cavaleiro J A S, Delmond B, et al. Analysis of the variation of the essential oil composition of Eucalyptus globulus Labill. from Portugal using multivariate statistical analysis [J]. Ind Crop Prod, 1997, 6(1): 27-33. |
| [7] | 刘玉明. 蓝按果实化学成分及质量控制研究 [D]. 上海: 第二军医大学, 2004. |
| [8] | 汤洪波, 周欣, 雷培海, 等. 黔产蓝桉果实挥发油化学成份的GC-MS分析 [J]. 分析测试学报, 2005, 24(增刊): 97-98. |
| [9] | 王颖, 宋爱华, 刘艳梅, 等. 蓝桉叶挥发油化学成分分析研究 [J]. 精细化工中间体, 2008, 38(2): 70-72. |
| [10] | 宋爱华, 王颖, 刘艳梅. 蓝桉叶挥发油化学成分的气相色谱-质谱分析研究 [J]. 食品与药品, 2009, 11(1): 30-32. |
| [11] | Sawada T, Kozuka M, Komiya T, et al. Euglobal-III, a novel granulation inhibiting agent from Eucalyptus globulus Labill [J]. Chem Pharm Bull, 1980, 28(8): 2546-2548. |
| [12] | Amano T, Komiya T, Hori M, et al. Isolation and characterization of euglobals from Eucalyptus globulus Labill. by preparative reversed-phase liquid chromato- graphy [J]. J Chromatogr A, 1981, 208(2): 347-355. |
| [13] | Kozuka M, Sawada T, Kasahara F, et al. The granulation-inhibiting principles from Eucalyptus globulus Labill. II. The structures of euglobal-Ia1, -Ia2, -Ib, -Ic, -IIa, -IIb and-IIc [J]. Chem Pharm Bull, 1982, 30(6): 1952-1963. |
| [14] | Kozuka M, Sawada T, Mizuta E, et al. The granulation-Inhibiting principles from Eucalyptus globulus Labill. III. The structures of euglobal-III, -IVb and -VII [J]. Chem Pharm Bull, 1982, 30(6): 1964-1973. |
| [15] | Nishizawa M, Emura M, Kan Y, et al. Macrocarpals: HIV-RTase inhibitors of Eucalyptus globulus [J]. Tetrahedron Lett, 1992, 33(21): 2983-2986. |
| [16] | Osawa K, Yasuda H, Morita H, et al. Eucalyptone from Eucalyptus globulus [J]. Phytochemistry, 1995, 40(1): 183-184. |
| [17] | Osawa K, Yasuda H, Morita H, et al. Macrocarpals H, I, and J from the leaves of Eucalyptus globulus [J]. J Nat Prod, 1996, 59(9): 823-827. |
| [18] | Yin S, Xue J J, Fan C Q, et al. Eucalyptals A-C with a new skeleton isolated from Eucalyptus globulus [J]. Org Lett, 2007, 9(26): 5549-5552. |
| [19] | Wang J, Zhai W Z, Zou Y K, et al. Eucalyptals D and E, new cytotoxic phloroglucinols from the fruits of Eucalyptus globulus and assignment of absolute configuration [J]. Tetrahedron Lett, 2012, 53(21): 2654-2658. |
| [20] | 王冀. 中药蓝桉果实 (一口盅) 化学成分及其生物活性研究 [D]. 上海: 华东师范大学, 2012. |
| [21] | Yun B S, Lee I K, Kim J P, et al. Lipid peroxidation inhibitory activity of some constituents isolated from the stem bark of Eucalyptus globulus [J]. Arch Pharm Res, 2000, 23(2): 147-150. |
| [22] | 谈满良, 汪冶, 周立刚, 等. 蓝桉果实中的脂溶性成分 [J]. 西北植物学报, 2006, 26(10): 2146-2149. |
| [23] | 隋晓丽. 蓝桉果实化学成分的研究 [D]. 济南: 山东大学, 2011. |
| [24] | Santos S A O, Villaverde J J, Silva C M, et al. Supercritical fluid extraction of phenolic compounds from Eucalyptus globulus Labill. bark [J]. J Supercrit Fluid, 2012, 71: 71-79. |
| [25] | Chen Y J, Wang J J, Ou Y W, et al. Cellular antioxidant activities of polyphenols isolated from Eucalyptus leaves (Eucalyptus grandis·Eucalyptus urophylla GL9) [J]. J Funct Foods, 2014, 7: 737-745. |
| [26] | Santos G G, Alves J C N, Rodilla J M L, et al. Terpenoids and other constituents of Eucalyptus globulus [J]. Phytochemistry, 1997, 44(7): 1309-1312. |
| [27] | 陈斌, 朱梅, 邢旺兴, 等. 蓝桉果实化学成分的研究 [J]. 中国中药杂志, 2002, 27(8): 596-597. |
| [28] | 陈斌. 蓝桉果实活性成分的研究 [D]. 上海: 第二军医大学, 2002. |
| [29] | Freire C S R, Silvestre A J D, Neto C P, et al. Lipophilic extractives of the inner and outer barks of Eucalyptus globulus [J]. Holzforschung, 2005, 56(4): 372-379. |
| [30] | 杨秀伟, 郭庆梅. 蓝桉果实化学成分的研究 [J]. 中国中药杂志, 2007, 32(6): 496-500. |
| [31] | 谈满良, 汪冶, 周立刚, 等. 蓝桉果实中的五环三萜化学成分 [J]. 天然产物研究与开发, 2007, 19(2): 232-23. |
| [32] | Domingues R M A, Sousa G D A, Freire C S R, et al. Eucalyptus globulus biomass residues from pulping industry as a source of high value triterpenic compounds [J]. Ind Crop Prod, 2010, 31(1): 65-70. |
| [33] | Yazaki Y, Hillis W E. Polyphenols of Eucalyptus globulus, E. regnans and E. deglupta [J]. Phytochemistry, 1976, 15(7): 1180-1182. |
| [34] | Kim J P, Lee I K, Yun B S, et al. Ellagic acid rhamnosides from the stem bark of Eucalyptus globulus [J]. Phytochemistry, 2001, 57(4): 587-591. |
| [35] | Vankar P S, Srivastava J, Molčanov K, et al. Withanolide A series steroidal lactones from Eucalyptus globulus bark [J]. Phytochem Lett, 2009, 2(2): 67-71. |
| [36] | Hou A J, Liu Y Z, Lin Z W, et al. Eucaglobulin, A new complex of gallotannin and monoterpene from Eucalyptus globulus [J]. Chin Chem Lett, 1998, 9(6): 541-543. |
| [37] | Hou A J, Liu Y Z, Yang H, et al. Hydrolyzable tannins and related polyphenols from Eucalyptus globulus [J]. J Asian Nat Prod Res, 2000, 2(3): 205-212. |
| [38] | 刘玉明, 吴玉田. 蓝桉果实中氨基酸成分的含量测定 [J]. 中国药房, 2007, 18(12): 915-916. |
| [39] | Takasaki M, Konoshima T, Fujitani K, et al. Inhibitors of skin-tumor promotion. VIII: Inhibitory effects of euglobals and their related compounds on epstein-barr virus activation [J]. Chem Pharm Bull, 1990, 38(10): 2737-2739. |
| [40] | 吴磊, 李成云, 蔡婷婷, 等. 蓝桉叶提取物对植物病原菌化感作用初步研究 [J]. 云南大学学报: 自然科学版, 2008, 30(S1): 196-199. |
| [41] | Vilela G R, Almeida G S, D'Arce M A B R, et al. Activity of essential oil and its major compound, 1, 8-cineole, from Eucalyptus globulus Labill, against the storage fungi Aspergillus flavusLink and Aspergillus parasiticus Speare [J]. J Stored Prod Res, 2009, 45(2): 108-111. |
| [42] | Tyagi A K, Malik A. Antimicrobial potential and chemical composition of Eucalyptus globulus oil in liquid and vapour phase against food spoilage microorganisms [J]. Food Chem, 2011, 126(1): 228-235. |
| [43] | Obiorah S, Eze E, Obiorah D, et al. Phytochemical and antimicrobial studies on the Extracts from leaves of Cajanus cajan and Eucalyptus globulus [A] // 2012 International Conference on Environment, Chemistry and Biology [C]. Bangkok: Asia-Pacific Chemical, Biological & Environmental Engineering Society, 2012. |
| [44] | Bachir R G, Benali M. Antibacterial activity of the essential oils from the leaves of Eucalyptus globulus against Escherichia coli and Staphylococcus aureus [J]. Asian Pac J Trop Biomed, 2012, 2(9): 739-742. |
| [45] | Amakura Y, Umino Y, Tsuji S, et al. Constituents and their antioxidative effects in eucalyptus leaf extract used as a natural food additive [J]. Food Chem, 2002, 77(1): 47-56. |
| [46] | González J, Cruz J M, Domínguez H, et al. Production of antioxidants from Eucalyptus globulus wood by solvent extraction of hemicellulose hydrolysates [J]. Food Chem, 2004, 84(2): 243-251. |
| [47] | 焦淑萍, 陈彪. 蓝桉的抗炎镇痛作用研究 [J]. 中草药, 1996, 27(4): 223-226. |
| [48] | Zhao C Z, Zhou J Y, Zhao W, et al. Protective effect of Euealy Ptusgtobulus oil on acute and chronic lung inflammation in rats [J]. 中国药理学与毒理学杂志, 2012, 26(5): 730-731. |
| [49] | Gray A M, Flatt P R. Antihyperglycemic actions of Eucalyptus globulus (Eucalyptus) are associated with pancreatic and extra-pancreatic effects in mice [J]. J Nutr, 1998, 128(12): 2319-2323. |
| [50] | Ikawati Z, Wahyuono S, Maeyama K. Screening of several indonesian medicinal plants for their inhibitory effect on histamine release from RBL-2H3 cells [J]. J Ethnopharmacol, 2001, 75(2/3): 249-256. |
| [51] | 陈昭, 徐勇, 张新刚, 等. 一口钟液保护实验性心肌缺血及耐缺氧作用的研究 [J]. 北华大学学报: 自然科学版, 2005, 6(4): 317-318. |
| [52] | 周建娅, 唐法娣, 毛国根, 等. 蓝桉油对单核细胞THP-1核因子-JB核转位活化的影响 [J]. 浙江大学学报: 医学版, 2003, 32(4): 315-319. |
 2015, Vol. 46
2015, Vol. 46


