2. 石河子大学化学化工学院, 新疆 石河子 832002
2. College of Chemistry and Chemical Engineerig, Shihezi University, Shihezi 832002, China
溃疡性结肠炎(ulcerative colitis,UC)是一种原因不明的慢性结肠炎,病变主要限于结肠的黏膜,表现为炎症或溃疡,多累及直肠和远端结肠,但可向近端扩展,以至遍及整个结肠。此疾病病程长, 病变范围广,可反复恶化,易发生癌变[1]。
新疆维吾尔医常用西帕依溃结安灌肠液(简称溃结安)治疗UC,疗效显著[2],其系单味维药没食子的水提物。从维药和中药汉方典籍中可以看出两种医学理论均肯定过没食子治疗溃疡的作用[3, 4]。目前,关于维药溃结安的报道集中在抗UC方面[5, 6],新疆医科大学哈木拉提•吾甫尔科研组实验发现维药溃结安可以调节诱导型NO合酶(iNOS)和c-jun基因的表达[5, 6],并建立了溃结安的质量标准[7]。
本实验是将溃结安灌肠液改造成反向温敏凝胶,以液体的形式进入,暴露于机体生理状态后,发生相转变,成为半固体的凝胶状态,受热固化贴于肠壁,这样既可以有效减少药物灌肠后的排出,又可以在溃疡表面形成药物储库,凝胶的特殊结构赋予了药物缓释性能,从而提高药物的疗效,增加患者的依从性。
1 仪器和材料Shimadzu LC-25C高效液相色谱,色谱柱为Waters Symmetry C18柱(150 mm×4.6 mm,5 μm),日本岛津株式会社;BP211D型电子天平,德国Sartorius公司;SPD-15C型高效液相色谱检测器、FTIR-8400S型傅里叶红外光谱仪,日本岛津株式会社;LVDV-C型数显转子黏度计,Brookfield Inc USA;PHS-3C型精密pH计,上海精密科学仪器有限公司;JSM-6490LV型扫描电子显微镜,日本电子公司;ALPHA 1-2LD PLUS型真空冷冻干燥机,德国Christ公司;透析袋,进口分装,MD25,截留相对分子质量8 000~14 000,北京索莱宝生物科技有限公司。
壳聚糖(CS,脱乙酰度>92.0%,黏度55 mPa∙s)、β-甘油磷酸钠(β-GP,质量分数≥99.0%,进口分装),北京拜尔迪生物技术有限公司;没食子酸对照品,批号110831-200803,质量分数>98.0%,中国食品药品检定研究院;没食子药材购于河北安国中药材市场,经石河子大学成玉怀高级实验师鉴定为没食子Cynips gallae-tinctoriae Oliv.,样品保存于新疆石河子大学药学院标本室;甲醇、乙腈,色谱纯,美国Tedia试剂公司;0.45 μm微孔滤膜,天津市化学试剂二厂。
2 方法和结果 2.1 CS/β-GP温敏凝胶的制备 2.1.1 溃结安的制备参考文献方法[8],取过20目筛的没食子粉碎药材约40 g,准确称定,加8倍量水浸泡1 h后,煎煮3次,每次0.5 h,合并煎液,滤过。减压浓缩制成生药质量浓度2.5 g/mL的没食子储备液[9],备用。
2.1.2 凝胶的制备取CS约0.1 g,精密称定,加入0.1 mol/L的盐酸5.00 mL,溶解,滤过,备用。精密量取0.96 mL没食子储备液,加入0.04 mL去离子水,分别称取β-GP 0.4~0.9 g(每2个值间隔0.1 g)溶于该溶液。CS溶液与含β-GP的没食子溶液体积比5∶1。将上述混合液逐滴加入CS溶液中,磁力搅拌(500 r/min)30.0 min[10]。用饱和磷酸氢二钠溶液分别调节pH值至6.90~7.20(每2个值间隔0.05),得一系列溶胶样品;分别在25.0~42.0 ℃(每2温度间隔1.0 ℃)的温度下形成凝胶,用于实验。空白凝胶的做法同上,不加药液即可。采用冷冻干燥法[10]将5.0 ℃和37.0 ℃的凝胶置于-54.0 ℃、25 Pa下冷冻干燥72 h,粉碎,过60目筛,收集细粉,即得凝胶粉末。
2.2 温敏凝胶的表征 2.2.1 胶凝前后外观及触觉观察室温(10.0~30.0 ℃):空白溶胶为液态、澄清、无色透明溶液,流动性好;载药溶胶为棕褐色均匀分散的溶液,流动性好;37.0 ℃:空白凝胶为乳白色半固体,形态良好,透明度均匀,有一定弹性,不能流动;载药凝胶为棕褐色的半固体,形态良好,透明度均匀,有一定弹性,不能流动。
2.2.2 温敏凝胶的扫描电镜(SEM)表征取适量凝胶粉末,喷金,加速电压25 kV,采用场发射SEM观察凝胶表面的微观结构形态及其孔径大小。如图 1所示,凝胶中分布着很多圆形孔洞,是由于凝胶聚合物在升温过程中,与水分子形成氢键逐渐断裂而失水。图 1-A中片层结构较松散,有贯穿的空洞,内部结构质地均匀,呈多孔相连的网架状;图 1-B中没食子均匀分散于凝胶片层结构中,凝胶孔隙变少,无明显的团聚体,说明药物加到凝胶后填补了
 | 图 1 空白 (A) 和载药 (B) CS/β-GP温敏凝胶SEM图Fig. 1 SEM images of blank (A) and drug loading (B) of thermosensitive CS/β-GP hydrogel |
凝胶中的孔隙,这种改变还可能使凝胶的强度增加。
2.2.3 温敏凝胶的傅里叶红外光谱(FTIR)表征用FTIR表征5.0 ℃和37.0 ℃时CS/β-GP凝胶胶凝前后的结构变化。取适量凝胶冻干粉末,与KBr混匀、压片,将样品置于红外激光束照射的样品槽中,分别扫描,分辨率为4 cm-1,扫描范围4 000~500 cm-1。
如图 2所示,随温度升高,非质子化的磷酸基团(-PO42-),经磷酸根的质子化作用在978 cm-1处的伸缩振动吸收峰降低。在37.0 ℃,1 146~1 159 cm-1内,双质子化磷酸基团(-H2PO4-)的吸收峰表明非质子化的磷酸基团(-PO42-)接受了质子(H+)。在1 206~1 222 cm-1内,5.0 ℃和37.0 ℃的凝胶溶液都出现了POH的弯曲振动吸收峰。在1 620~1 722 cm-1内,吸收峰强度改变,酰胺I带(amide I)的碳氧双键伸缩振动吸收峰νC=O发生改变;1 554、1 512和1 427 cm-1处的峰型发生了改变,说明壳聚糖的酰胺II带(amide II)的氮氢弯曲振动峰δN-H也发生了改变。
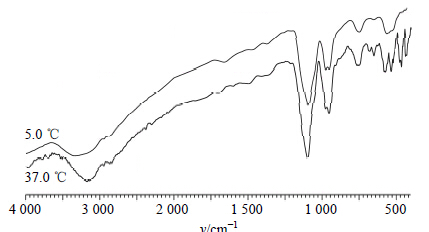 | 图 2 5.0 ℃ (A, 溶胶) 和37.0 ℃ (B, 凝胶) 时CS/β-GP温敏凝胶的FTIR图Fig. 2 FTIR spectra of thermosensitive chitosan hydrogel at 5.0 ℃ (A,sol) and 37.0 ℃ (B,gel) |
溶胶的质子化作用随温度升高而增强,说明在凝胶形成过程中发生了质子的转移。37.0 ℃时,非质子化的磷酸基团(-PO42-)接受了质子(H+),生成了(-H2PO4-)。壳聚糖分子质子化作用减弱会使溶解性降低。低温时,水分子吸附在壳聚糖糖链上,加热使壳聚糖溶液的熵值增加,促使其释放质子,壳聚糖中水分子的挤出也会增强壳聚糖分子的相互作用。若有足够的磷酸基团接受了质子,两组分形成氢键配合物,则能够实现溶胶到凝胶的转变,由此推测温敏凝胶网络结构已形成。
2.3 温敏凝胶的胶凝温度和胶凝时间的考察 2.3.1 温敏凝胶的胶凝温度考察采用流变学法测定胶凝温度[10]。取30.0 mL溶胶样品置于一定温度水浴的烧杯中,用数显转子黏度计测定,选用LV1号转子,以50 r/min转速测定每个温度下的黏度值,每升高1.0 ℃平衡20.0 min,绘制黏度随温度的变化曲线,如图 3所示,胶凝温度在37.0 ℃左右,符合人体正常体温给药时凝胶相变的要求。在较小温度范围内溶胶的黏度发生了较大变化,凝胶体系具有较显著的温度敏感性。
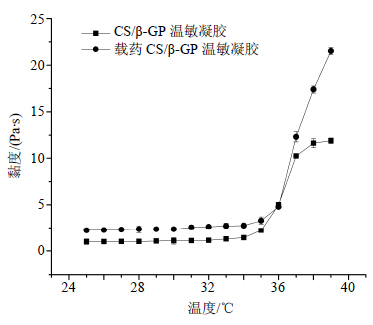 | 图 3 CS/β-GP温敏凝胶黏度随温度变化曲线 Fig. 3 Viscosity curves of thermosensitive CS/β-GP hydrogel with temperature changing |
用试管倒置法考察胶凝时间[11],量取溶胶样品适量,注入1.5 mL离心管中,置于37.0 ℃水浴中,每隔1.0 min观察1次,取溶胶倒置30.0 s不流动的时间为胶凝时间,β-GP质量浓度对胶凝时间的影响如图 4所示,在37.0 ℃下,β-GP质量浓度小于0.4 g/mL时,难以形成凝胶。β-GP质量浓度介于0.4~0.9 g/mL时,可以形成凝胶,胶凝时间随着β-GP质量浓度的增加而缩短。但由于CS表面裸露的静电荷数目是一定的,当β-GP质量浓度达0.9 g/mL时,β-GP与CS上的-NH3+已基本中和,胶凝时间不再随β-GP质量浓度的增加而缩短[12]。β-GP质量浓度大于0.9 g/mL时,CS/β-GP溶胶会产生大量絮状沉淀,以致无法进行胶凝时间的测定。用pH计测定溶液pH值,β-GP介于0.4~0.9 g/mL时,随其质量浓度增大,溶液的pH值升高。β-GP小于0.4 g/mL或者大于0.9 g/mL均无法测定溶液pH值。
温度对胶凝时间的影响如图 5所示,随着温度升高,胶凝时间呈指数下降。这是因为温度升高后,由于疏水键和氢键的引力大于链间的静电排斥力,CS链间的部分片段发生物理结合,从而出现凝胶化[13]。当达到39.0 ℃时胶凝时间基本保持不变。
pH值对胶凝时间的影响如图 6所示,在37.0 ℃下,pH值升高使CS链上游离氨基增多,CS链间 的静电斥力减小,链间氢键作用增强,最终使凝胶具有较短的胶凝时间。但是,pH值较低时,CS链上的氨基质子化程度较高,CS糖链之间存在较大的静电斥力而阻碍了链间氢键的形成,使胶凝时间增长。pH 7.2时,溶胶在室温下会产生大量絮状沉淀,因而37.0 ℃下得不到均相溶液,这是因为pH值过高使CS链上的电荷密度进一步减少,链间的静电斥力进一步降低,CS疏水作用和氢键引力相对提高,β-GP从CS链间被挤出而出现沉淀[12, 13]。
 | 图 4 β-GP溶液的质量浓度对凝胶胶凝时间和pH值的影响Fig. 4 Effect of β-GP concentration on gelling time and pH value of |
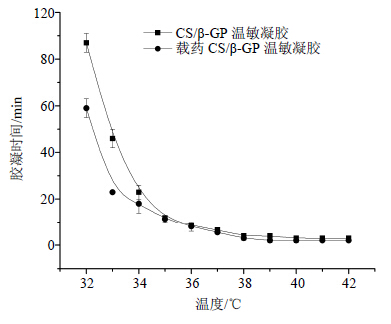 | 图 5 β-GP 温度对CS/β-GP温敏凝胶胶凝时间的影响pH值的影响Fig. 5 Effect of temperature on gelling time of thermosensitive chitosanhydrogel |
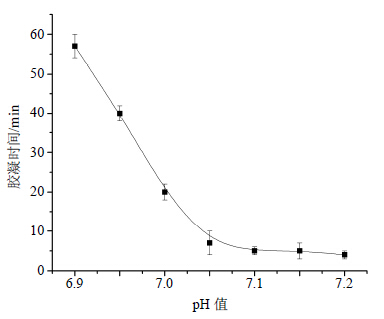 | 图 6 pH值对CS/β-GP温敏凝胶胶凝时间的影响Fig. 6 Effect of pH value on gelling time of thermosensitive chitosan hydrogel |
载药温敏凝胶供试品溶液配制:精密量取凝胶体外释放液适量,置于25 mL棕色量瓶中,加甲醇稀释至刻度,摇匀,精密量取1.25 mL,置于50 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,备用。参考文献方法测定没食子酸的量[14]。
将没食子酸质量浓度对峰面积进行线性回归得标准曲线,方程为A=4.562×107 C+1.305×105,r2=0.999 4,没食子酸在5.1~40.8 mg/L具有良好的线性关系。没食子酸峰分离度良好,理论塔板数符合质量标准规定,方法专属性良好,供试品溶液在12 h内稳定性良好,仪器精密度、重复性和加样回收率均良好。结果表明载药温敏凝胶中没食子酸平均质量分数为49.33 mg/g,RSD为1.95%(n=3)。
2.5 体外药物释放实验[15]参考《中国药典》2010年版二部[16]桨法测定。转速100 r/min,温度(37.0±0.5)℃,以模拟人工肠液pH 6.8的磷酸盐缓冲液200 mL作为溶出介质。将2 mL载药温敏凝胶和含等量生药的没食子提取液(简称原料药)各3份置透析袋中,用塑料夹封口,凝胶于水浴中放置20 min,使体系充分胶凝后,置于溶出介质中。分别于0、2、4、8、16、24、36、48、60 h取样2 mL,同时补加2 mL等温的新鲜介质,0.45 μm微孔滤膜滤过。按照“2.4”项下方法测定药物的量,计算累积释放率并进行释药模型拟合。
如图 7所示,载药凝胶体系释放初期,药物释放速度较快,可能是由于体系在凝胶化过程中,CS的集聚挤出少量水分。随时间推移,药物释放主要来自凝胶体内部,释放速度减慢。载药凝胶体系24 h内药物累积释放达68%,可持续释放药物48 h以上,而等量的原料药24 h内释放90%以上,由结果推测载药温敏凝胶对药物有较好的缓释作用。
对载药温敏凝胶释药分别采用零级动力学方程、一级动力学方程、Higuchi方程、Weibull方程及Hixson-Crowell方程进行模型拟合,并以相关系数(r)作为拟合相似度的判据,寻找描述药物释放的最佳模型,探讨温敏凝胶的释药机制,结果见图 8和表 1。采用Higuchi模型拟合呈现良好的线性关系。不同时间段内分别与Higuchi模型拟合较好,只是不同阶段其斜率不同,即释放速率不同。由拟合方程的r2值可知,Weibull方程对释药曲线拟合较好,方程为最优模型,该载药CS/β-GP温敏凝胶的释药机制为非Fick扩散,即药物扩散和凝胶溶蚀协同作用。
 | 图 7 37.0 ℃载药CS/β-GP温敏凝胶体外累积释放曲线Fig. 7 Cumulative drug-releasing curves in vitro at 37.0 ℃ |
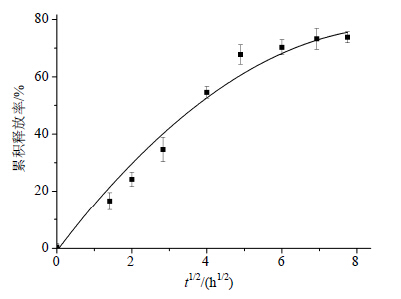 | 图 8 载药CS/β-GP温敏凝胶药物累积释放率与t1/2的关系曲线Fig. 8 Relationship curve of thermosensitive CS/β-GP hydrogel drug release rate to t1/2 |
| 表 1 载药CS/β-GP温敏凝胶体外释药的拟合模型 (Q为累积释放度) Table 1 Fitted model for in vitro release of thermosensitive hydrogel loading gallic extract (Q is cumulative release degrees) Dactylicapnos Wall. |
当CS稀盐酸溶液质量浓度为20 mg/mL、β-GP溶液质量浓度介于0.4~0.9 g/mL,pH值介于6.9~7.2,在人体正常体温37.0 ℃左右,增大β-GP质量浓度、提高溶液pH值、升高温度都会缩短胶凝时间,在6 min内可以形成载药温敏凝胶。考察载药温敏凝胶体外药物累积释放情况:根据释药模型拟合方程,线性关系均表现良好,释药行为最接近Weibull释放,确定该载药温敏凝胶对药物具有较好的缓释作用。
传统溃结安灌肠剂使用过程中,给患者带来痛苦,不便于使用。为了发挥溃结安在治疗溃疡性结肠炎疗效显著的优势[17, 18],参考Yuan等[19]和Elhady等[20]关于直肠给药凝胶制剂的研究,本实验利用CS/β-GP温敏凝胶的缓释性能,将溃结安的灌肠剂改造成反向CS/β-GP温敏凝胶,改善了传统的灌肠液患者用药时药物被迫大量排出的缺点。
| [1] | Ekmektzoglou K A, Samelis G, Karagiannis S, et al. Genomic instability in ulcerative colitis: a prerequisite for cancer in the inflammatory colon [J]. Acta Gastroenterol Belg, 2012, 75(3): 293-299. |
| [2] | Aivazi A A, Vijayan V A. Larvicidal activity of oak Quercus infectoria Oliv. (Fagaceae) gall extracts against Anopheles stephensi Liston [J]. Parasitol Res, 2009, 104(6): 1289-1293. |
| [3] | 中国医学百科全书编辑委员会, 易沙克江·马合穆德. 中国医学百科全书·维吾尔医学 [M]. 上海: 上海科学技术出版社, 2005. |
| [4] | 南京中医药大学. 中药大辞典 [M]. 上海: 上海科学技术出版社, 2006. |
| [5] | 黄静静, 库热西·玉努斯, 贺捷, 等. 维药西帕依溃结安在大鼠溃疡性结肠炎模型中对iNOS基因表达的影响 [J]. 世界华人消化杂志, 2010, 18(4): 350-354. |
| [6] | 贺捷, 哈木拉提·吾甫尔, 黄静静, 等. 维药西帕依溃结安对大鼠溃疡性结肠炎模型组织中c-jun表达的影响 [J]. 世界华人消化杂志, 2009, 17(33): 3441-3445. |
| [7] | 木巴拉克·伊明江, 迪力努尔·艾合买提, 曾灿丽, 等. 维药西帕依溃结安灌肠剂质量考察 [J]. 中国医院药学杂志, 2012, 32(17): 1397-1399. |
| [8] | 任源. 没食子化学成分及溃结安灌肠剂的研究 [D]. 乌鲁木齐: 新疆医科大学, 2005. |
| [9] | 斯拉甫·艾白, 努尔买买提·艾买提, 肖开提, 等. 维药西帕依溃结灌肠液一般毒理学研究 [J]. 中国民族医药杂志, 2008, 8(8): 28-30. |
| [10] | 郭亚可, 李晓娟, 熊庆, 等. 含氨基化碳纳米管的壳聚糖/β-甘油磷酸钠温敏凝胶的制备及性能研究 [J]. 中国药学杂志, 2014, 49(1): 54-60. |
| [11] | Nair L S, Starnes T, Ko J W, et al. Development of jnjectable thermogelling chltosaxrinorganic phosphate solutions for biomedical applications [J]. Biomacromolecules, 2007, 8(12): 3779-3785. |
| [12] | Rue-l Gariepy E, Chenite A, Chaput C, et al. Characterization of thermosensitive chitosan gels for the sustained delivery of drugs [J]. Int J Pharm, 2000, 203(1/2): 89-98. |
| [13] | Molinaro G, Leroux J C, Damas J, et al. Biocompatibility of thermosensitive chitosan-based hydrogels: An in vivo experimental approach to injectable biomaterials [J]. Biomaterials, 2002, 23(13): 2717-2722. |
| [14] | 任源, 堵年生. HPLC测定没食子中没食子酸的含量 [J]. 华西药学杂志, 2005, 20(1): 71-72. |
| [15] | Gaudin K, Barbaud A, Boyer C, et al. In vitro release and stability of an artesunate rectal gel suitable for pediatric use [J]. Int J Pharm, 2008, 353(1/2): 1-7. |
| [16] | 中国药典 [S]. 二部. 2010. |
| [17] | 哈木拉提·吾甫尔, 阿不都热依木·卡地尔. 维吾尔医药及其他传统医学研究与应用 [M]. 乌鲁木齐: 新疆人民卫生出版社, 2003. |
| [18] | Halmurat U, Kurexi Y, Yasen M, et al. The histologic effects of the Uyghur medicine Xipayi KuiJiean on ulcerative colitis in rats [J]. J Aust Tradit-Med Soc, 2011, 17(4): 219-223. |
| [19] | Yuan Y, Cui Y, Zhang L, et al. Thermosensitive and mucoadhesive in situ gel based on poloxamer as new carrier for rectal administration of nimesulide [J]. Int J Pharm, 2012, 430(1/2): 114-119. |
| [20] | Elhady S A, Mortada N D, Awad G A, et al. Development of in situ gelling and mucoadhesive mebeverine hydrochloride solution for rectal administration [J]. Saudi Pharm J, 2003, 11(4): 159-171. |
 2015, Vol. 46
2015, Vol. 46


