2. 浙江中医药大学第一临床医学院, 浙江 杭州 310053
2. First Clinical Medical College, Zhejiang Chinese Medical University, Hangzhou 310053, China
将难溶性药物制备成高效制剂具有重要的临床意义,近年来,研究者着重于采用含脂质的制剂来提高难溶性药物的口服生物利用度[1, 2]。应用最广泛的方法是将药物包含在脂质载体中,这其中受到特别关注的是自微乳化释药系统(self-microemulsifying drug delivery system,SMEDDS)[3, 4]。自微乳起效的机制是将难溶性药物包裹在O/W型微乳中,以增加药物的溶解性,从而提高药物的吸收,增强疗效[5]。然而,自微乳制剂也存在着一定的不足。比如,在胃肠道内水相的稀释下,自微乳体系会由溶胀的W/O型反胶束变为双连续相,最终成为O/W型微乳。这种微观结构的改变会导致溶解于其中的药物溶解度发生改变;同时水溶性助表面活性剂会逐渐分配到大量水相中,导致药物在界面层溶解能力下降,最终药物析出晶体,降低自微乳处方的载药量,影响自微乳制剂的稳定性[6]。其次,通常为了防止药物析出晶体,保证自微乳制剂适宜的载药量,处方中会添加过多的表面活性剂。而过多的表面活性剂一方面会造成胃肠道的刺激性,使患者用药后产生较强烈不良反应;另一方面,会大大增加制剂生产的成本。
过饱和自微乳化释药系统(supersaturatable and self-microemulsifying drug delivery system,S-SMEDDS)是在自微乳处方中加入促过饱和物质,使自微乳中析出的药物过饱和溶解,减少表面活性剂的用量,从而降低对胃肠道的刺激。
抗肿瘤药依托泊苷(etoposide,VP-16),为鬼臼毒素衍生物,主要用于治疗小细胞肺癌、恶性淋巴瘤、恶性生殖细胞瘤和白血病,VP-16几乎不溶于水(148 μg/mL,37 ℃),目前国内外上市的VP-16制剂主要是非水溶液注射剂和软胶囊[7]。注射剂在使用时易引起较强的局部刺激,且有文献报道市售VP-16软胶囊内容物加2倍水稀释后即析出大量沉淀[8]。为增加VP-16药物的溶解度并防止其析出晶体,本实验拟通过筛选适宜的促过饱和物质制备VP-16 S-SMEDDS,并对其进行质量评价[9, 10, 11, 12, 13, 14, 15]。为解决SMEDDS存在的技术关键问题及研究提高VP-16生物利用度打下基础。
1 仪器与材料DF101S集热式恒温加热磁力搅拌器,巩义英峪予华仪器厂;Waters 2695高效液相色谱色谱仪、Waters 2996紫外检测器,杭州赛默科技有限公司;JA203H电子天平,常州市幸运电子设备有限公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;PALL Cascada纯水仪、RO-MB-20D高纯水机,杭州永洁达膜分离设备厂;酸度计,梅特勒-托利多DELTA 320台式pH计;HZ-9212S恒温水浴振荡器,太仓市科教器材厂。
VP-16对照品,中国食品药品检定研究院,质量分数100%,批号100388-200401;VP-16原料药,武汉博锐精细化工有限公司,质量分数99.3%,批号20091215;VP-16软胶囊,江苏恒瑞医药股份有限公司,批号20110317;油酸乙酯(EO),中国医药上海化学试剂公司,化学纯,批号20090601;肉豆蔻酸异丙酯(IPM),浙江杭州万景新材料有限公司,批号20091118;辛酸葵酸三甘油酯(GTCC),英国Croda公司,批号20090310;聚山梨酯80(Tween 80),温州清明化工有限公司,化学纯,批号20090901;乳化剂OP,天津市广成化学试剂有限公司,批号20090512;聚氧乙烯氢化蓖麻油(RH40,批号20091209)、聚氧乙烯蓖麻油(EL35,批号20090915)、聚乙烯吡咯烷酮K30(PVP K30,批号G81907PTO)、聚乙烯吡咯烷酮K90(PVP K90,批号G8644PTO),德国BASF公司;聚乙二醇400(PEG 400,批号090130)、1,2-丙二醇(PG,批号20090310),化学纯,上海浦东高南化工厂;无水乙醇,安徽安特生物化工有限公司,化学纯,批号20090901;羟丙基甲基纤维素E6(HPMC E6,批号PD191298)、羟丙基甲基纤维素K4M(HPMC K4M,批号PD221921),美国Dow公司;羧甲基纤维素钠(CMC-Na),上海昌为医药辅料技术有限公司,批号090211;甲醇,美国Honeywell Burdick & Jackson公司,色谱纯;其他试剂均为化学纯,水为纯化水。
2 方法与结果 2.1 VP-16HPLC定量测定方法的建立色谱条件:色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-pH 4.00的醋酸盐缓冲液(48∶52);体积流量1.0 mL/min;检测波长285 nm;柱温30 ℃;进样量20 μL。在此色谱条件下,辅料不干扰主药的测定[16, 17, 18]。VP-16在25.3~202.4 μg/mL线性关系良好,回归方程为Y=8 159.4 X+4 256.6,R2=0.999 8。
日内精密度与日间精密度RSD均<2%,符合定量测定要求,加样回收率实验测得总平均回收率为99.68%,RSD为1.37%,符合要求。
2.2 VP-16在不同溶媒中平衡溶解度和稳定性考察 2.2.1 VP-16在不同油相、表面活性剂和助表面活性剂中的溶解度选取EO、BO、IPM和GTCC为油相,EL35、RH40、Tween 80和乳化剂OP为表面活性剂,PEG 400、PG和无水乙醇为助表面活性剂,各取约5 g置于10 mL量瓶中,加入过量的VP-16,于37 ℃水浴中超声20 min加速溶解,静置24 h后,6 000 r/min离心10 min。称取上清液约0.5 g置于10 mL量瓶中,加适量甲醇超声破乳10 min,定容。再吸取各上述溶液1 mL于5 mL量瓶中,流动相稀释定容,用0.45 μm的微孔滤膜滤过进样。记录各辅料可溶解的药物量。每种辅料测定3次,计算平均值。测得VP-16在不同辅料(EO、BO、IPM、GTCC、EL35、RH40、Tween 80、乳化剂OP、PEG 400、PG、无水乙醇)中的溶解度分别为0.041、0.003、0.039、0.297、57.089、35.308、23.392、23.668、190.080、33.123、40.800 mg/mL(n=3)。
2.2.2 VP-16在不同水介质溶液中的溶解度和稳定性分别配制不同pH值的缓冲盐溶液,各取约5 g置于10 mL量瓶中,加入过量的VP-16,于37 ℃水浴中超声20 min加速溶解,静置24 h后,6 000 r/min离心10 min。称取上清液约0.5 g置于10 mL量瓶中,加适量甲醇定容。再吸取各上述溶液1 mL于5 mL量瓶中,流动相稀释定容,用0.45 μm的微孔滤膜滤过进样。记录各缓冲盐溶液可溶解的药物量。每种溶液平行测定3次,计算平均值。测得VP-16在不同溶液(蒸馏水、pH 3.0 PBS、pH 5.0 PBS、pH 6.8 PBS)中的溶解度分别为148.36、141.09、142.76、144.57 μg/mL(n=3)。
取VP-16对照品适量,分别以甲醇、乙醇、水、pH 3.0 PBS、pH 5.0 PBS和pH 6.8 PBS配制适宜浓度的溶液,室温放置,HPLC法定时测定其中VP-16的量,考察药物在以上几种溶液中的稳定性(以相对质量分数即各时间点测得VP-16质量浓度与配制后VP-16初始质量浓度比值表示)。测得VP-16在不同溶液中的稳定性结果见表 1。结果表明,在各pH值条件下,VP-16的平衡溶解度相差不大,24 h内稳定性良好。
| 表 1 VP-16在不同溶液中的稳定性 Table 1 Stability of VP-16 in different solutions |
按照文献方法[19]测得VP-16在水及不同pH值的缓冲盐(pH 3.0 PBS、pH 5.0 PBS、pH 6.8 PBS)溶液中与正辛醇的Papp分别为4.02、3.54、3.90、3.97。结果表明,VP-16的脂溶性好,容易通过生物膜。
2.4 不同油相与表面活性剂的配伍变化通过溶解度实验选择对VP-16有较好溶解能力的油相和表面活性剂,进一步考察不同表面活性剂和油相的配伍变化。本实验在不加入助表面活性剂的情况下进行,将表面活性剂与油相按不同质量比(9∶1、8∶2、7∶3)混合均匀后观察其混匀程度,再加入100倍量的蒸馏水,轻轻振荡,观察其自微乳化后的澄清度、自微乳化完全的时间长短,从而确定表面活性剂对油相的乳化能力及配伍变化。根据文献报道[20]将自乳化情况分为5个级别:乳化时间<1 min,溶液呈澄清或微泛蓝色(A);乳化时间<1 min,略浊,呈蓝白色(B);乳化时间1~2 min,呈亮白色不透明液体(C);乳化时间>2 min,色泽暗,呈灰白色,略带油状(D);难乳化,一直有油滴存在(E)。结果见表 2。从表 2的结果可以看出,EO和GTCC和不同表面活性剂的自乳化情况好于IPM;表面活性剂中RH40的乳化能力最强,其原因可能是RH40所含聚氧乙烯基数目较多,亲水疏水平衡值(HLB)值较大,对油相的增溶能力强些。最佳表面活性剂与油相的配伍为RH40与EO的比例为9∶1、8∶2或RH40与GTCC的比例为9∶1、8∶2。
| 表 2 不同油相与表面活性剂的配伍变化 Table 2 Compatibility changes of different oil phases and surfactants |
采用滴定法绘制伪三元相图,固定油相为GTCC、表面活性剂为RH40,考察不同助表面活性剂无水乙醇、PG和PEG 400形成微乳的能力,将表面活性剂-助表面活性剂按质量比(Km)1∶1混匀,再与油相按9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的比例混匀,将能形成均一、透明溶液的处方继续进行以下实验。37 ℃水浴磁力搅拌条件下,滴加水相至形成澄清透明溶液,记录微乳形成时各组分的量,绘制伪三元相图(图 1)。以相图中微乳存在区域的大小来筛选助表面活性剂。
 | 图 1 不同助表面活性剂的伪三元相图Fig. 1 Pseudo ternary phase diagrams of different surfactants |
图中阴影区为微乳(ME)区域,可以看出,3种助表面活性剂均存在ME区域。本实验研究的是自微乳体系,口服进入胃肠道后被大量的消化液稀释,因此要求微乳区域可无限稀释,在伪三元相图中,从水相的顶点沿ME区域做切线,即可比较3种助表面活性剂所形成自微乳区域的大小。当助表面活性剂为PEG 400时,具有最大的自微乳区,因此选择PEG 400为VP-16 S-SMEDDS的助表面活性剂,进行各组分比例的优化。
2.6 表面活性剂与助表面活性剂比例的筛选以RH40、PEG 400、GTCC为相图的3个顶点,将RH40及PEG 400按Km 1∶3、1∶2、1∶1、2∶1、3∶1混匀,再按不同的比例与GTCC混合均匀,将能形成均一、透明溶液的处方继续进行以下实验。37 ℃水浴磁力搅拌条件下,滴加水相至形成澄清透明溶液,记录微乳形成时各组分的量,绘制伪三元相图。以相图中ME区域的大小来筛选表面活性剂与助表面活性剂的最佳比例。结果如图 2所示,可以看出,当Km值为1∶1时,微乳区最大,故Km为1∶1。
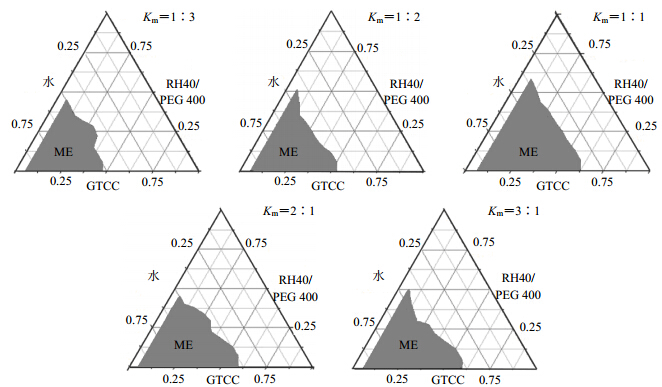 | 图 2 不同Km值的伪三元相图Fig. 2 Pseudo ternary phase diagrams of different Km values |
固定RH40作为表面活性剂,PEG 400为助表面活性剂,Km=1∶1,GTCC为油相,油量为20%,载药量为20 mg/g,分别加入不同种类不同量的促过饱和抑晶物质制备一系列溶液,精密称定处方中各个组分,于具塞广口瓶中,37 ℃加热,涡旋,使混合均匀。室温放置24 h,将能形成均一、透明溶液的处方继续进行以下试验。取0.1 g的处方液,加入到5 mL、37 ℃恒温的蒸馏水中,20 r/min磁力搅拌,观察能否形成微乳液,室温放置8、24 h,6 000 r/min离心10 min,取下层液体,观察是否析出晶体。结果见表 3。
| 表 3 不同种类促过饱和物质的抑晶效果 Table 3 Crystal suppression effect of different kinds of supersaturated substances |
结果表明,大多数抑晶物质与自微乳处方的相容性较差,PVP类相对较好,其中PVP K30的抑晶效果最好。抑晶效果和抑晶物质加入的量相关。因此,选择PVP K30作为VP-16过饱和自微乳的抑晶物质。
2.7.2 促过饱和物质对相图的影响基于上部分组成成分的筛选结果,选择RH40、PEG 400、GTCC和PVP K30为VP-16 S-SMEDDS处方的组分。精密称定自微乳处方中各个组分的量,于具塞广口瓶中,再加入2%的PVP K30,37 ℃加热,涡旋,使混合均匀。室温放置24 h,将能形成均一、透明溶液的处方继续进行以下试验。取0.1 g的处方液,加入到5 mL、37 ℃恒温的蒸馏水中,20 r/min磁力搅拌,室温放置24 h,6 000 r/min离心10 min观察分层情况。采用伪三元相图的方法,以表面活性剂/助表面活性剂、油相、水相各为一角,将能形成澄清透明和淡蓝色乳光的处方确定为相图中可自微乳化的点,结果如图 3所示。结果表明,加入PVP K30后,各配比形成的透明溶液均在一定程度上黏度增加,乳化效果不变,PVP K30的加入不影响自微乳化区域。
 | 图 3 SMEDDS (A) 和S-SMEDDS (B) 伪三元相图的比较Fig. 3 Comparison on pseudo ternary phase diagrams of SMEDDS (A) and S-SMEDDS (B) |
以RH40-PEG 400-GTCC图为依据。以油相的比例尽量大、表面活性剂尽量少,且避开自微乳化区域边界点,各组分比例的少量变化不影响自微乳化的实验数据点为依据,优化处方。筛选出2个自微乳化性能较好的备选处方,备选处方1:RH40-PEG 400-GTCC(4∶4∶2);备选处方2:RH40-PEG 400-GTCC(3.5∶3.5∶3)。
分别用自微乳备选处方1和备选处方2,加入100 mg VP-16和不同量的PVP K30,取过饱和自微乳0.1 g,加入到5 mL 37 ℃恒温的蒸馏水中稀释,20 r/min磁力搅拌,置室温下,于不同时间6 000 r/min离心10 min,取下层液体,观察是否析出晶体。结果见表 4。结果表明,当不加过饱和物质时,2个处方加水稀释后析出晶体;过饱和物质的加入均在一定程度上抑制了2个处方晶体的析出。在可溶解于自微乳处方范围内,随着加入抑晶物质量的增加,抑晶效果增强。从药剂学辅料应用的原则出发,本实验确定在处方中加入促过饱和物质PVP K30为处方量的2%。加入相同量的抑晶物质,备选处方2比备选处方1易析出晶体,可能是备选处方2的PEG 400用量相对较备选处方1少,而PVP K30与PEG 400结构相似,PVP K30主要溶解在PEG 400中的原因。
| 表 4 促过饱和物质加入量与析晶情况 Table 4 Amount of supersaturated substances and crystallization conditions |
分别取备选处方1和2,置于具塞广口瓶中,加入适量过量的VP-16,于37 ℃水浴中超声20 min加速溶解,静置24 h后,6 000 r/min离心10 min。称取上清液约0.5 g置于10 mL量瓶中,加适量甲醇超声破乳10 min,定容。再吸取各上述溶液1 mL于5 mL量瓶中,流动相稀释定容,用0.45 μm的微孔滤膜滤过进样。
备选处方1测定得到的饱和溶解度为16.48 mg/mL,而备选处方2测定得到的饱和溶解度为10.87 mg/mL,可以得出,2个处方溶解VP-16的能力均显著提高,但是备选处方1溶解VP-16的能力要强于备选处方2。因此,可进一步确定最佳处方组成为RH40-PEG 400-GTCC-PVP K30(20∶20∶10∶1)。
2.9 VP-16S-SMEDDS的制备影响S-SMEDDS性质的制备工艺因素主要有混合方式、混合的速率、温度、时间。本实验通过考察S-SMEDDS的自微乳化速率来确定制备工艺。据文献报道,自微乳化速度实验可以通过目测观察或用浊度变化来测量自微乳化的平衡时间。本实验采用目测法,以S-SMEDDS自微乳化时间的长短判断S-SMEDDS自微乳化的难易,即当自微乳化时间较短时,认为所制备的S-SMEDDS形成的ME的能力较好。
2.9.1 自微乳化速率的测定方法取VP-16 S- SMEDDS 1.00 g,滴入100 mL 37 ℃的蒸馏水中,自液滴开始接触液面时计时,在磁力搅拌下,以20 r/min的速率搅拌至完全自微乳化形成澄清透明的溶液,记录自微乳化的时间,每个样品平行测定5次。
2.9.2 混合方式的选择考察不同的混合方式(涡旋振荡、超声混合、电动搅拌和磁力搅拌)对S-SMEDDS制备的影响。由于S-SMEDDS的黏度较大,采用涡旋振荡或超声混合的方式,样品不易混匀。而电动搅拌在样品量较大时采用混合效果较好,却不适宜处方研究中少量样品的制备。故本实验采用磁力搅拌的混合方式,既适宜实验少量样品的制备,又可达到较高的搅拌速率,满足短时间内充分混匀的要求。
2.9.3 搅拌速率的考察按处方配比称取RH40、PEG 400、GTCC共1.00 g,在37 ℃条件下,分别以10、20、30、40、50 r/min的速率磁力搅拌20 min,将形成的SMEDDS滴入水中,测定自微乳化时间,结果分别为56.0、22.2、20.6、17.6、14.6 s(n=5)。结果表明,在20 r/min的搅拌速率下,自微乳化时间仅需22.2 s。
2.9.4 搅拌时间的考察按处方配比称取RH40、PEG 400、GTCC共1.00 g,在37 ℃条件下,以20 r/min的速率分别磁力搅拌10、20、30、40 min,将形成的SMEDDS滴入水中,测定自微乳化时间,结果分别为83.2、75.4、77.4、81.0 s(n=5)。结果表明,在搅拌20 min时自微乳化时间仅需75.4 s。
2.9.5 搅拌温度的考察按处方配比称取RH40、PEG 400、GTCC共1.00 g,在25、37、40、45 ℃条件下,以20 r/min的速率分别磁力搅拌20 min,将形成的SMEDDS滴入水中,测定自微乳化时间,结果分别为85.4、17.6、18.4、15.2 s(n=5)。结果表明,温度升高,能显著降低自微乳化的时间,当达到37 ℃时,自微乳化时间为17.6 s,继续升高温度,自微乳化时间无明显差异。
由自微乳化时间测定结果可知,本实验所制备的VP-16 SMEDDS的自微乳化速度较快(自微乳化时间<2 min)。SMEDDS遇水性溶液形成ME为自发过程,不需要外界做功。上述实验所考察的制备工艺条件仅是混匀的过程,各组分混合得越均匀,相互之间融合得越好,自微乳化速度越快。搅拌速率增大、搅拌时间延长、搅拌温度升高均可以显著改善SMEDDS的混合效果。各组分在37 ℃条件下,以20 r/min的速率搅拌20 min后,形成的SMEDDS的自微乳化速度趋于稳定,可推断SMEDDS已经混合均匀,因此可采用37 ℃,20 r/min磁力搅拌20 min的方法制备SMEDDS。
2.9.6 VP-16S-SMEDDS的制备 称取RH40 40.00 g、PEG 400 40.00 g、GTCC 20.00 g、PVP K30 2.08 g,在37 ℃条件下,20 r/min磁力搅拌20 min后,加入2.00 g VP-16,同法操作,得VP-16 S-SMEDDS。
2.9.7 VP-16S-SMEDDS的制备工艺验证试验 按“2.9.6”所述方法制备3个批次(批号20131206、20131213、20131220)VP-16 S-SMEDDS进行验证试验,测定3批样品的自微乳化时间,并计算其RSD,结果平均自微乳化时间分别为20.1、20.2、20.6 s(n=3)。结果表明3批VP-16 S-SMEDDS的平均自微乳化时间为20.3 s,RSD为1.30%。
2.10 过饱和自微乳形态与粒径分布
取VP-16 S-SMEDDS 1 g,加水50 mL,轻微搅拌,待自微乳化完全后,取适量滴在铜网上,用2%的磷钨酸负染色15 min,晾干后扫描电镜(SEM)观察(图 4),并用粒径分析仪测定平均粒径及粒径分布(图 5)。
 | 图 4 VP-16 S-SMEDDS的SEM图Fig. 4 SEM diagram of VP-16 S-SMEDDS |
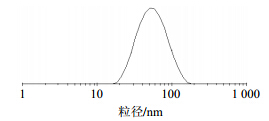 | 图 5 VP-16 S-SMEDDS的粒径分布Fig. 5 Size distribution of VP-16 S-SMEDDS |
VP-16 S-SMEDDS加水后形成的ME液在电镜下观察,液滴均呈圆球形。用粒径分析仪测得其平均粒径为(82.7±3.3)nm(n=3),粒径分布较集中。VP-16 S-SMEDDS的Zeta电位为(-20.36±1.21)mV(n=3),稳定性良好。
2.10.1 分散介质对VP-16 S-SMEDDS粒径的影响
分别用水、0.1 mol/L HCl、pH 6.8 PBS溶液作为VP-16 S-SMEDDS的分散介质,结果所得微乳的粒径分别为82.7、124.6、89.6 nm(n=3)。由数据可知,VP-16 S-SMEDDS经0.1 mol/L HCl稀释后所得的微乳粒径较用水和pH 6.8 PBS稀释后的粒径大,这可能是由于溶液中的H+竞争性地与表面活性剂中的乙氧基形成氢键,从而影响了表面活性剂的亲水性,乳化能力降低。
2.10.2 载药量对VP-16 S-SMEDDS粒径的影响
制备载药量分别为0、2%和5%的3种S-SMEDDS,分别用水稀释50倍后,用Zetaszier Nano-S90激光粒度测定仪测定其平均粒径,结果分别为145.6、82.7、54.8 nm(n=3)。可见粒径随着载药量的增加而减小,可能是由于油水间界面张力随载药量的增加而降低,使得微乳平均粒径也相应地减小。
2.10.3 稀释倍数对VP-16 S-SMEDDS粒径的影响
S-SMEDDS进入体内后,会被大量的胃液稀释,考虑到个体差异,分别用水稀释至50、100、200、1 000倍后,用Zetaszier Nano-S90激光粒度测定仪测定其平均粒径,结果分别为82.7、80.1、74.4、76.5 nm(n=3)。由该数据可知,随着稀释倍数的增大,微乳粒径稍有降低,可能是由分散相浓度降低,粒子间相互作用减小引起的。
2.11 定量测定分别精密称取VP-16 S-SMEDDS 3批(批号20131206、20131213、20131220),各约50 mg(相当于含有1 mg VP-16),用甲醇适量稀释,超声破乳10 min,制成含VP-16约100 μg/mL的溶液。按照“2.1”项色谱条件测定其峰面积,代入标准曲线计算其量,结果VP-16平均质量分数分别为19.89、19.96、20.09mg/g(n=3)。结果表明,3批样品中VP-16的平均质量分数为19.98 mg/g,RSD为0.51%,符合要求。
2.12 体外溶出度考察根据《中国药典》2010年版溶出度测定法第一法(转篮法),将自微乳装于硬胶囊壳中,温度为(37.0±0.5)℃、转速为100 r/min,溶出介质为900 mL水,分别在15、30、45、60、120、180 min取样3 mL,并补充同体积溶出介质,0.45 μm微孔滤膜滤过,HPLC法测定,代入标准曲线方程,计算累积溶出率。
分别测定VP-16 S-SMEDDS、VP-16 SMEDDS与市售软胶囊的溶出情况,并进行比较。结果如图 6所示,VP-16 S-SMEDDS的溶出速率较VP-16 SMEDDS与市售软胶囊的溶出速度快,三者在60 min时累积溶出率均接近100%。
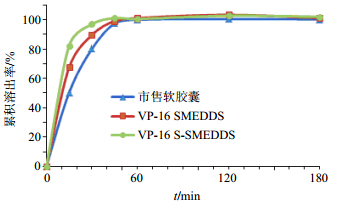 | 图 6 VP-16 S-SMEDDS、VP-16 SMEDDS与市售软胶囊的溶出度Fig. 6 Dissolution rate of VP-16 S-SMEDDS,VP-16 SMEDDS,and commercial soft capsule |
参照《中国药典》2010年版二部附录XIX C“原料药与药物制剂稳定性实验指导原则”项下相关规定及本制剂的特殊性质进行研究,将VP-16 S-SMEDDS灌封于安瓿瓶中,进行影响因素及初步稳定性考察,以外观性状、相对质量分数及自乳化时间为指标,考察S-SMEDDS的稳定性。
2.13.1 影响因素试验将VP-16 S-SMEDDS样品分别放置于高温(40、60 ℃)、低温(4 ℃)、光照(4 500±500)lx条件下,分别于5、10 d取样,考察其外观、质量分数及自乳化时间,并与0 d结果比较,结果见表 5。结果显示,高温(60 ℃)和光照(4 500±500)lx对VP-16 S-SMEDDS制剂的稳定性影响较大,其中60 ℃高温的影响最为显著,溶液颜色从无色变为淡黄色,VP-16量下降,自微乳化性能也降低,主要原因可能是由于VP-16药物被氧化。温度高时氧化速率比温度低时大,因此,VP-16 S-SMEDDS最适宜的贮存条件为阴凉处避光保存。
| 表 5 VP-16 S-SMEDDS影响因素试验 Table 5 Influencing factors test of VP-16 S-SMEDDS |
将VP-16 S-SMEDDS样品交替放于4、37 ℃下,每12 h改变1次温度,共7 d,考察其外观、相对质量分数及自乳化时间,并与0 d结果比较,结果见表 6。结果显示,样品经冷热循环实验,仍为无色澄明液体,并无药物晶体析出,同时自乳化性能也未改变。
| 表 6 VP-16 S-SMEDDS冷热循环试验 Table 6 Psychro-thermal cycles test of VP-16 S-SMEDDS |
取VP-16 S-SMEDDS室温分别放置1、2、3、6个月,取样后测定,与0月进行比较,考察样品的稳定性,结果见表 7。结果显示,室温条件下放置6个月后,样品的外观性状、相对质量分数及自乳化时间,与0月比较,均无明显变化,表明VP-16 S-SMEDDS稳定性良好。
| 表 7 VP-16 S-SMEDDS初步稳定性试验 Table 7 Preliminary stability test of VP-16 S-SMEDDS |
S-SMEDDS是在原有自微乳释药系统中添加水溶性纤维聚合材料或其他聚合物作为促过饱和物质,以使游离药物从自微乳释药系统中释放后与小分子微乳颗粒在胃肠道内达到过饱和状态,防止药物在体内发生沉淀。S-SMEDDS其本身并不是饱和状态,只有当其进入体内与胃肠液混合之后才能生成过饱和自微乳,从而使游离药物在胃肠道内局部溶液中达到过饱和,显著增加药物的生物利用度。S-SMEDDS处方中添加了促过饱和物质,常用的有聚合纤维素类,如HPMC、甲基纤维素、PVP或羟丙甲邻苯二甲酸酯等。聚合纤维素类是极好的晶体生成抑制剂,体外研究证明其能延长药物的过饱和状态,而本实验所采用的PVP也可使许多难溶药物形成过饱和状态。这些促过饱和物质的抑晶作用机制尚有待进一步探究,推测原理可能是HPMC在与水混合后能产生一个空间宽广的纤维质聚合物网状系统,此种网状系统分支端的疏水基团由水性结构鞘所包围,这种结构能抑制晶核的形成。也有人认为是药物与聚合物分子通过氢键的相互作用,使得聚合物吸附在晶核的表面或晶体表面形成流体界面层,此界面层改变了晶体附着场所的形态,进而抑制了晶体的生长。或者聚合物通过占据吸附部位来抑制药物分子从制剂进入晶格中,吸附在其上的聚合物形成了一种机械障碍以抑制结晶作用[21]。
总的来说,过饱和自微乳的优点首先在于其能显著增加药物溶解性,提高载药量,增强疗效,同时由于减少了自微乳中表面活性剂的用量,降低了胃肠道刺激性,使患者易于接受,增加口服生物利用度。其次,将过饱和自微乳做成胶囊剂后还能起到定时、定量、简单易服的作用。
本实验建立了VP-16定量测定分析方法,该方法简单、快速、专属性高;测定了VP-16在各种辅料中的溶解度,为处方筛选提供依据;测定了VP-16在不同pH值介质中的油水分配系数和各种介质中的溶解度和稳定性,表明了VP-16具备一定的亲脂性,在各种介质中较稳定。
同时对VP-16 S-SMEDDS的处方及制备工艺进行了研究,从不同表面活性剂与油相的配伍变化、伪三元相图的绘制、过饱和自微乳析晶情况的考察等方面对S-SMEDDS的处方进行了筛选;从混合方式、搅拌速度、搅拌时间、搅拌温度等方面对S- SMEDDS的工艺条件进行了评价,并考察了VP-16 S-SMEDDS的性状、微观形态、粒径分布和质量分数,ME在透射电镜下呈球状或类球状,平均粒径为(82.7±3.3)nm;采用直接释药法测定其体外溶出度,考察了体外释放条件对VP-16 S-SMEDDS释药行为的影响,结果表明,VP-16 S-SMEDDS的体外溶出较VP-16 SMEDDS和VP-16市售软胶囊均要快,三者在60 min时的累计溶出率均达100%。通过影响因素试验和初步稳定性试验证实,高温(60 ℃)和光照(4 500±500)lx对VP-16 S-SMEDDS的影响较大,因此,需考虑其最佳的贮存条件为阴凉避光处保存,其他条件的稳定性良好。
| [1] | 李津明, 张彦卓, 李鑫. 依托泊苷长循环脂质体工艺处方设计与优化的研究 [J]. 安徽医药, 2008, 12(6): 488-491. |
| [2] | van de Waterbeemd H, Lennems H, Artursson P. 药物生物利用度 [M]. 何仲贵, 钟大放, 译. 北京: 化学工业出版社, 2007. |
| [3] | 王章姐, 胡容峰, 王国凯, 等. Box-Behnken设计-效应面法优化柚皮素自微乳给药系统 [J]. 中草药, 2014, 45(17): 2461-2466. |
| [4] | 刘伟星, 李宁, 高崇凯. 葛根素自微乳化渗透泵控释胶囊的制备 [J]. 中草药, 2013, 44(12): 1568-1573. |
| [5] | 沈熊, 吴伟. 自乳化和自微乳化释药系统 [J]. 复旦大学学报: 医学版, 2003, 30(2): 180-183. |
| [6] | Kogan A, Aserin A, Garti N. Improved solubilization of carbamazepine and structural Transitions in nonionic microemulsions upon aqueous phase dilution [J]. Colloid Interface Sci, 2007, 315(2): 637-647. |
| [7] | 袁开红, 曹德善, 李萌, 等. VP-16软胶囊的研制及人体生物利用度的研究 [J]. 中国医药工业杂志, 2004, 35(5): 279-281. |
| [8] | 郭胤仕, 于海建, 邢祖林. 低剂量口服VP-16治疗晚期非小细胞肺癌 [J]. 中国新药与临床杂志, 2002, 21(2): 119-121. |
| [9] | 凡小燕. 橙皮苷自微乳的制备与评价 [D]. 合肥: 安徽医科大学, 2011. |
| [10] | 陈鹰, 史琼枝, 徐享隽, 等. 多西他赛固体过饱和自乳化释药系统的制备及体外特性 [J]. 中国医院药学杂志, 2010, 30(24): 2058-2062. |
| [11] | 彭璇, 陈苹苹, 包强, 等. 水飞蓟宾过饱和自乳化给药系统的制备及性质研究 [J]. 中草药, 2010, 41(1): 40-42. |
| [12] | 夏祖猛. 芎冰自乳化滴丸的制备及其评价体系研究 [D]. 广州: 广州中医药大学, 2011. |
| [13] | 康虞玲. 葛根黄豆苷元自微乳化给药系统的研究 [D]. 保定: 河北大学, 2010. |
| [14] | 轩肖玉, 王亚静, 张伟玲, 等. 芒果苷自微乳给药系统的制备及其大鼠体内药动学研究 [J]. 药物评价研究, 2013, 36(3): 166-170. |
| [15] | 姚金娜, 陈苹苹, 尚小广, 等. 水飞蓟宾过饱和自微乳给药系统在大鼠体内的药动学研究 [J]. 中草药, 2011, 42(11): 2261-2264. |
| [16] | 尹东东, 王杏林, 赵广荣, 等. 依托泊苷微乳的HPLC测定 [J]. 中国医药工业杂志, 2007, 38(2): 121-122. |
| [17] | 李华龙, 尹东东, 王杏林. 依托泊苷长循环亚微乳的制备和理化性质研究 [J]. 现代药物与临床, 2013, 28(2): 164-169. |
| [18] | 叶红杨, 王世亮, 周浩炳. HPLC法同时测定依托泊苷植入剂的有关物质及含量 [J]. 安徽医药, 2009, 13(7): 751-752. |
| [19] | 吴忠斌, 郭丹, 陈建明. 依托泊苷磷脂复合物的制备及理化性质研究 [J]. 中国新药杂志, 2009, 18(13): 1250-1256. |
| [20] | 廖九中, 张建, 崔永淼. 大豆苷元固体自乳化制剂的处方优化和制备 [J]. 中国药房, 2012, 23(19): 1757-1759. |
| [21] | 乔梁, 魏颖慧, 李范珠. 过饱和自微乳给药系统的研究进展 [J]. 国际药学研究杂志, 2008, 25(4): 279-283. |
 2015, Vol. 46
2015, Vol. 46


