2. 上海交通大学医学院附属仁济医院 癌基因与相关基因国家重点实验室海洋药物实验室, 上海 200127
2. Key Laboratory of Marine Drugs, State Key Laboratory of Oncogenes and Related Genes, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China
苦木Picrasma quassioides Bennet是苦木科(Simaroubaceae)苦树属Picrasma Bl. 落叶乔木,又称苦树,生长在湿润而肥沃的山坡、山谷和溪边等地,在我国主要分布在黄河以南各省区,在印度东北部、尼泊尔、不丹、朝鲜和日本也有分布[1]。国内外学者对苦树属植物的化学成分进行了深入的研究,发现该属植物中主要以生物碱、苦味素及其苷类成分为主,同时还包含少量的三萜、酚酸以及黄酮类等成分,这些化学成分显示了抗病原微生物、抗肿瘤和降血压的作用[2]。国内外专家学者也在苦木中发现了一些β-卡巴林生物碱成分[3, 4, 5, 6, 7, 8, 9, 10, 11]。本课题组从苦木茎95%乙醇提取物中分离得到了3个β-卡巴林生物碱成分,经波谱学方法以及文献比对分别鉴定为picrasidine F(1)、picrasidine G(2)和picrasidine S(3)。尽管Koike在1986年已经发表了有关化合物1的研究[12],但化合物1的1H-NMR和13C-NMR仍然未做准确归属。本研究通过对化合物1核磁数据的分析,首次对该化合物的1HNMR、13C-NMR和2D NMR数据进行了全面准确的归属;并对这3个化合物进行了抗肿瘤和抗菌活性评价。
1 仪器与材料Bruker AVANCE 400超导核磁波谱仪;Finnigan LCQDECA和Agilent 6210 LC/MSD TOF质谱仪;Jasco P-1020旋光仪;Jasco V-550紫外光谱仪;Jasco FTIR480红外光谱仪(KBr压片);东京理化MPLC色谱仪;分析型高效液相色谱仪(美国Dionex公司);PDA-100二极管阵列检测器;Welch XB-C18(250 mm×4.6 mm,5 μm)分析型色谱柱和Welch XB-C18(250 mm×21.2 mm,5 μm)制备型色谱柱;薄层色谱用硅胶G、硅胶H、柱色谱硅胶(100~140目、200~300目)(青岛海洋化工有限公司);RP-18高效薄层预制板(Merck公司);RP-18柱色谱材料(Merck公司);Sephadex LH-20(Mitsubishi Kasei公司);色谱纯甲醇为山东禹王实业有限公司化工分公司产品,其余色谱用化学试剂均为分析纯,为天津康科德科技有限公司和广州化学试剂厂产品。
苦木药材采自广西壮族自治区,由暨南大学周光雄教授鉴定为苦木科苦树属植物苦木Picrasma quassioides Bennet。标本(编号PQ05)保存于上海交通大学医学院附属仁济医院癌基因与相关基因国家重点实验室海洋药物实验室。
2 提取与分离苦木茎干质量5 kg,用95%乙醇10 L加热回流提取5次,每次2 h,提取液减压回收溶剂后得浸膏18 g,分散在水中,依次用相同体积的氯仿和正丁醇分别萃取3次,回收溶剂后得到氯仿萃取物12 g、正丁醇萃取物4.5 g。具有抗肿瘤活性的氯仿萃取物经硅胶柱色谱,环己烷-醋酸乙酯(100∶0→0∶100)梯度洗脱,得到8个流分Fr. 1~8。用氯仿-甲醇(10∶1)展开剂对这8个流分进行TLC分析,碘化铋钾显色可发现流分Fr. 7包含更多的生物碱类化合物;流分Fr. 7(1.2 g)经Sephadex LH-20柱色谱,二氯甲烷-甲醇(1∶1)洗脱,得到5个流分Fr. 7A~E。流分Fr. 7B(242 mg)经反相中压柱色谱,甲醇- 水(10∶90→100∶0)梯度洗脱,得到4个流分Fr. 7B-1~4。流分Fr. 7B-3(74 mg)经半制备型高效液相色谱分离纯化,乙腈-水-三氟乙酸(45∶55∶0.05)洗脱,体积流量2 mL/min,得到化合物1(3.1 mg,tR=17.90 min)、2(3.5 mg,tR=14.19 min)、3(5.2 mg,tR=20.81 min)。
3 结构鉴定
化合物1:淡黄色固体。1H-NMR (600 MHz,DMSO-d6) 和13C-NMR (150 MHz,DMSO-d6) 数据见表 1。化合物1的1H-NMR数据与文献报道基本一致[12],同时,本实验对化合物1的13C-NMR和2D NMR数据进行了补充。1H-NMR (600 MHz,DMSO-d6) 谱(表 1)低场区给出2个活泼氢信号δH 13.08 (1H,brs) 和12.13 (1H,brs),9个烯氢信号δH 8.31 (1H,d,J = 7.8 Hz),8.25 (1H,s),7.84 (1H,d,J = 7.8 Hz),7.79 (1H,d,J = 7.8 Hz),7.78 (1H,s),7.77 (1H,td,J = 7.8,1.2 Hz),7.45 (1H,td,J = 7.8,1.2 Hz),7.23 (1H,t,J = 7.8 Hz) 和7.18 (1H,dd,J = 7.8,1.2 Hz),1个连氮次甲基氢信号δH6.96 (1H,m),3个甲氧基氢信号δH 4.07 (3H,s),4.00 (3H,s) 和3.98 (3H,s);高场区给出6个亚甲基氢信号δH 3.69 (1H,dd,J = 19.2,6.0 Hz),3.55 (1H,m),2.64 (1H,m),2.56 (1H,m),1.98 (1H,m) 和1.76 (1H,m)。13C-NMR (150 MHz,DMSO-d6) 谱中给出29个碳信号,高场区给出3个亚甲基信号δC 13.1,24.3和27.1,3个甲氧基信号δC 55.6,56.0和57.6,1个连氮次甲基信号δC 64.8;低场区给出22个烯碳信号δC107.9,112.9,115.4,117.6,117.8,118.8,119.7,119.9,120.7,121.1,121.9,124.3,130.1,130.4,132.6,
134.1,135.5,138.0,142.3,146.0,150.8和151.1。根据以上数据,可知化合物1与picrasidine G(2)具有相同的骨架,唯一的区别在于化合物1比2多1个甲氧基。通过HMQC相关可将氢与相应的碳连接起来。化合物1的COSY相关和关键的HMBC相关已在图 1中标出。HMBC中,由6-OCH3与C-6的相关,6′-OCH3与C-6′的相关,12′-OCH3与C-12′的相关,可确定3个甲氧基的连接位置,从而确定化合物1多出的那个甲氧基连接在C-12′上,进而确定了化合物1为picrasidine F。其他的HMBC相关也验证了化合物1的结构。
| 表 1 化合物1~3的1H-NMR (600 MHz,DMSO-d6) 和13C-NMR (150 MHz,DMSO-d6) 数据 Table 1 1H-NMR (600 MHz) and 13C-NMR (150 MHz) NMR data of compounds 1—3 in DMSO-d6 |
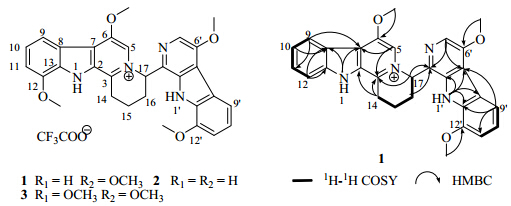 | 图 1 化合物1~3的结构及化合物1的主要1H-1H COSY和HMBC相关Fig. 1 Structures of compounds 1—3 and key 1H-1H COSY and HMBC correlations of compound 1 |
化合物2:淡黄色固体。1H-NMR (600 MHz,DMSO-d6) 和13C-NMR (150 MHz,DMSO-d6) 数据见表 1。以上数据与文献报道基本一致[8, 12, 13, 14],故鉴定化合物2为picrasidine G。
化合物3:淡黄色固体。1H-NMR (600 MHz,DMSO-d6) 和13C-NMR (150 MHz,DMSO-d6) 数据见表 1。以上数据与文献报道基本一致[8, 13],故鉴定化合物3为picrasidine S。
4 生物活性采取MTT法[15]对化合物1~3进行人宫颈癌HeLa细胞、胃癌MKN-28细胞和小鼠黑色素瘤B-16细胞的细胞毒活性测试。培养48 h后,发现化合物1对人宫颈癌HeLa细胞有显著的细胞毒活性,IC50值为16.65 μmol/L,且选择性较强;化合物2和3对人宫颈癌HeLa细胞、胃癌MKN-28细胞和小鼠黑色素瘤B-16细胞具有显著的细胞毒活性,IC50值在4.95~19.0 μmol/L;其中,化合物2对人宫颈癌HeLa细胞、化合物3对人宫颈癌HeLa细胞和胃癌MKN-28细胞的细胞毒活性强于阳性对照药5-氟尿嘧啶;活性结果见表 2。
| 表 2 化合物1~3对人宫颈癌HeLa细胞、胃癌MKN-28细胞和小鼠黑色素瘤B-16细胞的细胞毒活性(x±s, n=3) Table 2 Cytotoxicity of compounds 1—3 to human HeLa cervical and gastric MKN-28,and mouse melanoma B-16 cancer cells(x±s, n=3) |
根据美国临床和实验室标准协会(CLSI)标准,采用MIC法[16]对化合物1~3进行抗菌活性测试,菌株包括2株耐甲氧西林金黄色葡萄球菌(MRSA P0172和MARS H0117)和2株甲氧西林敏感的葡萄球菌(MSSA P0171和MSSA H0180);药物质量浓度梯度为0~128 μg/mL。37 ℃恒温培养24 h后显示,化合物1~3对2株MSSA菌株的抑制作用较强,MIC90值在4~8 μg/mL,对两株MRSA菌株的抑制作用稍弱,MIC90值在8~16 μg/mL;3个化合物对4株菌的抑制作用均比阳性对照药氯霉素稍弱;活性结果见表 3。
| 表 3 化合物1~3对MRSA (P0172/H0117) 和MSSA (P0171/H0180) 的抗菌活性 Table 3 Antibacterial activity of compounds 1—3 to MRSA (P0172/H0117) and MSSA (P0171/H0180) |
《中国药典》记载,苦木茎入药,味苦,性寒,有毒;有清热燥湿、解毒、杀虫等功效。由于苦木的化学成分复杂,其发挥治疗作用的有效成分及作用机制至今尚未阐明。本研究通过多种现代色谱分离手段,对苦木茎中的活性成分进行了分离纯化,得到了3个β-卡巴林生物碱成分:picrasidine F(1)、picrasidine G(2)和picrasidine S(3)。并首次对化合物1的1H-NMR、13C-NMR和2D NMR数据进行了全面准确的归属。本研究还对这3个生物碱进行了细胞毒和抗菌活性测试,发现它们具有显著的细胞毒活性和抗菌活性,说明苦木中含有大量活性较好的化学成分,这为开发苦木更多的药用价值和深入探讨苦木活性成分的作用机制提供了良好的基础。
| [1] | 云南省植物研究所. 云南植物志 (第一卷) [M]. 北京: 科学出版社, 1977. |
| [2] | 焦伟华, 李晨阳, 高昊, 等. 苦树属植物化学成分和生物活性研究进展 [J]. 中草药, 2007, 38(9): 1419-1424. |
| [3] | Yoshikawa M, Harada E, Aoki S, et al. Indonesian medicinal plants. VI. On the chemical constituents of the bark of Picrasma javanica BL. (Simaroubaceae) from flores island. Absolute sterostructures of picrajavanins A and B [J]. Chem Pharm Bull, 1993, 41(12): 2101-2105. |
| [4] | Ohmoto T, Koike K. Studies on the alkaloids from Picrasma quassioides Bennet. V. Structures of picrasidines L, M, and P [J]. Chem Pharm Bull, 1985, 33(9): 3847-3851. |
| [5] | Li H Y, Koike K, Ohmoto T. New alkaloids, picrasidines W, X and Y from Picrasma quassioides and X-ray crystallographic analysis of picrasidine Q [J]. Chem Pharm Bull, 1993, 41(10): 1807-1811. |
| [6] | Ohmoto T, Koike K. Studies on the alkaloids from Picrasma quassioides Bennet. VI. Structures of picrasidines N, O, and Q [J]. Chem Pharm Bull, 1985, 33(11): 4901-4905. |
| [7] | Koike K, Ohmoto T. Studies on the alkaloids from Picrasma quassioides BENNET. VII. Structures of β-carboline dimer alkaloids, picrasidines-H and-R [J]. Chem Pharm Bull, 1986, 34(5): 2090-2093. |
| [8] | Koike K, Ohmoto T. Studies on the alkaloids from Picrasma quassioides Bennet. IX. Structures of two β-carboline dimeric alkaloids, picrasidines-G and -S (Pharmacognosy, Chemical) [J]. Chem Pharm Bull, 1987, 35(8): 3305-3308. |
| [9] | Ohmoto T, Koike K, Higuchi T, et al. Studies on the alkaloids from Picrasma quassioides Bennet. IV. Structures of picrasidines I, J, and K [J]. Chem Pharm Bull, 1985, 33(8): 3356-3360. |
| [10] | Ohmoto T, Koike K. Studies on the alkaloids from Picrasma quassioides Bennet. V. Structures of picrasidines L, M, and P [J]. Chem Pharm Bull, 1985, 33(9): 3847-3851. |
| [11] | Koike K, Ohmoto T. Studies on the alkaloids from Picrasma quassioides Bennet. VII. Structures of β-carboline dimer alkaloids, picrasidines-H and -R [J]. Chem Pharm Bull, 1986, 34(5): 2090-2093. |
| [12] | Koike K, Ohmoto T, Ogata K. Studies on the alkaloids of Picrasma quassioides Bennet. VIII. X-ray crystal structure analysis of picrasidine-F [J]. Chem Pharm Bull, 1986, 34(8): 3228-3236. |
| [13] | 杨峻山, 于德泉, 梁晓天. 苦木双碱甲和苦木双碱乙的结构 [J]. 药学学报, 1988, 23(4): 267-272. |
| [14] | Liu J, Davidson R S, Howarth O W. Full assignments of proton and carbon signals of picrasidine-G by 1D and 2D NMR methods [J]. Magn Reson Chem, 1993, 31(12): 1091-1092. |
| [15] | Thornburg C C, Thimmaiah M, Shaala L A, et al. Cyclic depsipeptides, grassypeptolides D and E and Ibu-epidemethoxylyngbyastatin 3, from a Red Sea Leptolyngbya cyanobacterium [J]. J Nat Prod, 2011, 74(8): 1677-1685. |
| [16] | Jiao W H, Li J, Liu Q, et al. Dysidinoid A, an unusual meroterpenoid with anti-MRSA activity from the south china sea sponge Dysidea sp. [J]. Molecules, 2014, 19(11): 18025-18032. |
 2015, Vol. 46
2015, Vol. 46


