中医药是中国文化及哲学观念的体现,在其发展的历程中,不断吸收各个时期的先进思想理论;同时也是数千年临床经验的积淀与科学技术的结晶[1]。已有2 000多年历史的传统中医药其有效性、实用性和科学性不容置疑;但是以现代的观念看,传统中医药对于疾病的认识、诊断、治疗,以及中医药疗效的发挥的具体机制缺乏科学的认识。此外,中药尤其是中药复方物质基础复杂,并且通过多组分协同、多靶点发挥整体药效作用,这种复杂性给中医药现代化带来很多困难。因此,建立连接传统中医药与现代医药两种体系的“桥梁”已成为重要命题;而系统生物学尤其是代谢组学的提出为中医药现代化研究提供了很好的发展方向[2]。代谢组学是继基因组学、蛋白组学和转录组学之后,又一门新兴的“组学”,它利用现代分析技术定量测定生物体液中的内源性代谢产物(相对分子质量<1×106),考察生物体在不同状态下代谢产物的变化,通过对于代谢物图谱的整体分析直接认识生理、病理状态,结合化学信息学分析方法确定内源性小分子代谢物成分的变化模式,获得相应的生物标记物群,表征或揭示生物体在特定时间和环境下的整体功能状态[3]。代谢组学强调把人或动物作为一个整体来研究,同时在方法学上具有无创伤、动态、接近生理条件下研究等特点,与中药治病整体性、动态性原则极其相似,为传统中医药研究提供了崭新的和强有力的技术手段。将代谢组学方法应用于中医药的研究中,有可能使以经验为基础的中药治病向以科学的方法和标准为基础的现代化中药治病转变。在中药现代化研究中,代谢组学在中药药效物质基础与作用机制以及在中药安全性评价等方面具有重要的理论意义和应用价值。
1 代谢组学的概述 1.1 常用的分析手段代谢组学研究中的分析手段包括核磁共振谱(NMR)、气相色谱-质谱(GC-MS)和液相色谱-质谱(LC-MS)等谱学技术[4]。其中NMR技术中常用的有氢谱(1H-NMR)、碳谱(13C-NMR)和磷谱(31P-NMR),而以1H-NMR应用最为广泛[5, 6]。NMR技术对样本无破坏,是现有分析技术中唯一能用于活体研究的,且无需进行样品前处理;此外,NMR技术分析能够同时测定一个样本中所有代谢物,且其信号强度与摩尔浓度成正比,便于定量分析,而通过2D-NMR技术能够在对复杂样品不进行分离的前提下实现结构鉴定[7]。然而,NMR技术要求待测物分子含有具核磁矩的核素,还要求待测药物给药剂量高、给药后代谢时间短、代谢物浓度高[8, 9]。GC-MS是一种经典成熟的分析技术,在分离时对毛细管柱梯度加热,根据挥发性高低,在毛细管中保留时间不同达到分离的目的;GC-MS特长是分析挥发性物质,且可以检索多个大型化合物库进行代谢物的结构鉴定,使化合物鉴定简单、容易操作。但GC-MS的样品必须气化,因此不能分析大分子、难挥发性物质以及热不稳定性物质[10]。LC-MS优点是以其灵敏度高、无需高温、分析速度快、样品无需衍生化等优点,受到众多研究者的关注[11];尤其是UPLC-Q-TOF/MS能够更好地用于代谢物和同分异构体的特征鉴定,由于样品组分的分离在先,离子化和检测在后,因而能够有效地减少干扰,诸如基质效应、离子化抑制、离子化竞争等,大幅度增加代谢物的鉴别数量和准确度[12, 13, 14]。但是LC-MS的缺点在于样品重现性较差,化合物鉴定困难,而且鉴定化合物的数据库还不完备,二级质谱只能部分提供结构信息。毛细管电泳-质谱(CE-MS)也被用于代谢组学研究,相对其他分离技术,CE-MS具有明显的优势:高效分离率、微量进样量(平均注射体积1~20 μL)以及快速分析;此外CE-MS的最大优点是其可在单次分析实验中分离阴离子、阳离子和中性分子,因此可以同时获得不同类代谢物的谱图,这使得其成为高通量非目标分析代谢组学研究中一个很有吸引力和发展前景的分析技术[15, 16, 17]。
1.2 样品的处理样品制备对于实验结果影响较大。样品制备包括样品来源管理、样品储存与样品提取,目的是保证代谢信息不因为样品处理发生改变。样品来源是指受试对象的采样环境,如饮食、光照、温度等。样品储存是指样品获得后迅速灭活代谢酶,防止小分子化合物在酶作用下发生改变,最佳保存方式是液氮或-80 ℃低温冰箱。样品提取是制备过程最重要的环节,NMR样品处理方法简单,pH值和离子强度的变化引起化学位移的变化是NMR测定中的首要问题,而加入缓冲液一方面提供尽可能相同的pH环境,另一方面减少离子强度不同带来的化学位移的变化[18]。基于质谱技术的代谢组学对样品处理的要求较高,需除去大分子类物质,并且尽可能完全回收小分子化合物进行分析。例如,对于尿样的处理,尿液中的成分主要是极性低相对分子质量代谢物,同时含有少量的各种细胞、微量的大分子物质及磷酸盐、硫酸盐等各种盐类物质,这些都有可能对LC-MS分析产生一定的影响。最简单的尿液处理方式是仅用0.22 μm分析滤膜滤过,这可以最大限度保留尿液中的代谢物[19]。为降低尿液基质的干扰,也可以用蒸馏水进行稀释(1∶1→1∶4)[20, 21],但有可能降低信号强度,部分低量的代谢物可能检测不到。而对于GC-MS分析,体液与组织匀浆液中大部分成分极性比较大而且没有挥发性,因此在进行GC-MS分析前首先要对尿液进行衍生化处理[22, 23, 24]。
1.3 数据的处理代谢组学研究的关键问题在于对数据信息的充分解读,然而代谢组学原始谱图复杂、数据量大,不能用常规数据处理方法,需要进行数据降维和信息挖掘。数据处理分为三大步骤:一是数据的提取即图谱的可视化;二是数据的预处理,包括滤噪、重叠峰解析、峰对齐、峰匹配、标准化和归一化等;三是模式识别,包括非监督(unsupervised)模式和有监督(supervised)模式,前者有主成分分析(PCA)、簇类分析(HCA)和非线性映射(NLM)等,后者包括人工神经网络(ANN)、偏最小二乘-判别分析(PLS-DA)、正交最小二乘-判别分析(OPLS-DA)等[25, 26, 27]。此外,Crockford等[28]在进行毒理学研究时,采用了SHY(statistical heterospectroscopy)方法对NMR与MS数据进行了整合,为生物标志物的发现提供了一个系统生物学工具。代谢组学研究流程及其相关技术见图 1。
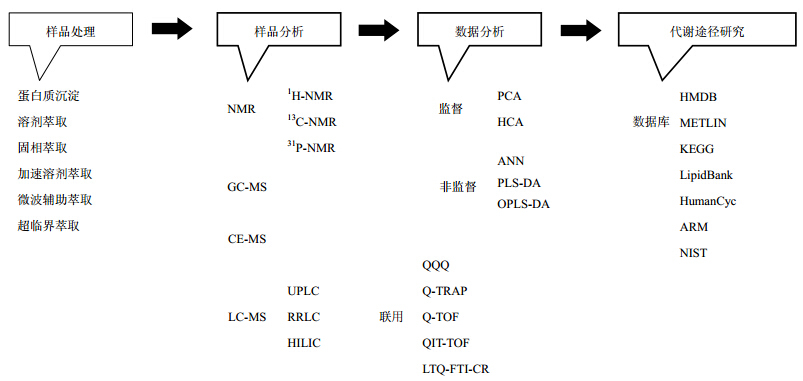 | 图 1 代谢组学研究流程及其相关技术Fig. 1 Primary process and relevant technology for metabonomic study |
传统上人们一直认为中药毒副作用小,但是近年来众多关于中药毒性的报道,使得国际社会对于中药的安全性问题非常关注[29, 30]。目前对于中药的毒性研究虽然已经非常广泛,但是主要还是采用传统的急性毒性和长期毒性实验,选择的指标主要为组织形态学及生化指标,但是得到的结果并不全面,且无法阐明毒性的物质基础的变化规律。近年来,中药毒性研究在方法学上有一些新的进展,细胞生物学技术、单细胞凝胶电泳、穿梭质粒、基因芯片等技术被引入中药的毒性研究[31],但是这些方法不能对给药后反应的整个进程以及生物整体的应答进行测量[32]。代谢组学的全面性系统策略,与中医药的整体观念思维方式不谋而合。代谢组学研究中药毒性的原理是基于有毒药物会破坏正常细胞的结构,改变细胞代谢途径中内源性代谢物的稳态,从而通过直接或间接效应改变流经靶组织的血浆成分,因此代谢物的动态变化可以作为毒性损害的评价指标,且这种代谢物的整体模式比单一靶标具有更好的一致性和预见性[33]。中药毒性的评价有时难以用单一器官或组织的毒性反应来衡量,但尿液等终端代谢物反映的是机体各种细胞、组织和器官功能变化的总和,根据代谢组的变化评价中药的毒性反应更简便快速,且可从代谢物角度解释中药毒性作用机制,这开辟了中药毒性研究的新思路。
梁琦等[34]以广防己和粉防己为研究对象,以1H-NMR技术为手段,研究ig 8.1 g/kg广防己、粉防己对大鼠尿样与血浆代谢物整体轮廓的影响,得到广防己和粉防己肝肾毒性的代谢模式特征。研究发现广防己和粉防己模型大鼠尿样中柠檬酸与尿糖量下降,马尿酸盐与三甲胺-N-氧化物(TMAO)量升高,推测广防己和粉防己会造成肾脏损伤,且主要影响肾小管排泄功能,而粉防己损伤严重,早期损伤就可涉及肾髓质。对于广防己和粉防己肝毒性的研究,实验发现广防己组大鼠血中N-乙酰糖蛋白(NAC)、O-乙酰糖蛋白(OAG)和尿2-酮戊二酸量下降,血丙氨酸和尿牛磺酸上升;粉防己组的血NAC、OAC和尿2-酮戊二酸量上升,尿牛磺酸和血低密度脂蛋白(LDL)/极低密度脂蛋白(VLDL)下降,说明广防己、粉防己给药早期即有一定肝脏毒性作用,涉及糖、脂代谢和肝线粒体功能的受损,其中粉防己表现出急性肝损伤作用。
苍耳子被认为无毒或有小毒,既可以治病又可用于补养。近年来过量使用苍耳子或使用炮制不当的苍耳子导致中毒甚至死亡的病例时有报道,而目前对苍耳子毒性的认知也多为从临床用药中总结的经验[35]。苍耳子药用引发的不良反应多见于皮肤、消化系统、神经系统、心血管系统、泌尿系统、呼吸系统、造血系统,苍耳子不良反应临床表现主要以实质脏器损害为主,其中肾脏、肝脏损害最为明显[36]。Lu等[37]以UPLC-MS代谢组学技术为手段,研究ig 1.1、5.5、22.0 g/kg苍耳子的大鼠尿样中的毒性生物标志物。研究发现,正离子模式下发现6个生物标记物,包括5-羟基-6-甲氧基吲哚-葡糖苷酸、4,6-dihydroxyquinoline、L-苯丙氨酰-L-脯氨酸、尿苷、3-methyldioxyindole、phenylalanine;负离子模式下发现4个生物标记物,包括indoxyl sulfate、hippuric acid、sebacic acid、arachidonic acid。
蟾酥为蟾蜍科动物中华大蟾蜍或黑眶蟾蜍等的耳后腺分泌的白色浆液经加工干燥而成的固体物,其化学成分复杂,含有几十种蟾蜍毒素类化合物[38]。蟾蜍毒素主要作用于心脏迷走神经中枢或末梢,并可直接作用于心肌,引起心率缓慢、心律不齐等缓慢心律失常症状,使房室传导阻滞,最后导致心跳停止于收缩期。人的蟾酥急性中毒症状表现为呕吐、呼吸急促、肌肉痉挛、惊厥和心率不齐等[39]。梁晓萍等[40]分别ig大鼠128、64、32、16 mg/kg的蟾酥,肝门静脉取血得血清,采用UPLC/TOF-MS技术分析大鼠血清代谢轮廓的变化。研究发现的生物标志物为溶血磷脂酰胆碱(Lyso-PC)类,包括Lyso-PC(C18:0)、Lyso-PC(C16:0)、Lyso-PC(C18:2)、Lyso-PC(C20:4)、Lyso-PC(C18:1)、Lyso-PC [16:1(9Z)],说明蟾酥干扰了心肌的脂质代谢(包括磷脂和脂肪酸代谢),导致心肌的能量代谢紊乱,且与空白组比较,给药组大鼠血清中大多数Lyso-PC生物标志物的代谢水平均下调;而脂肪酸类化合物中花生四烯酸(AA)的代谢水平上调,油酸(OA)和亚油酸(LA)的代谢水平下调。
雄黄是中药中的一种常见的矿物药,现代医家使用含雄黄的复方制剂或单方用于治疗血液系统疾病、恶性淋巴系统疾病以及实体瘤,取得了明显的治疗效果。雄黄主要含硫化砷,其质量分数为90%以上。硫化砷基本不溶于水,在胃肠道很难吸收,理论上该化合物的毒性应该非常低,然而,雄黄还含有一定量的可溶性砷,这也是造成雄黄毒性的主要原因[41]。Wei等[42]以1.0 g/kg雄黄连续ig大鼠7 d,取大鼠尿样,采用1H-NMR分析尿样、血样、肝组织匀浆液代谢轮廓变化。实验发现,乳酸脱氢酶(LDH)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、尿素氮(BUN)、总胆固醇(TC)、白蛋白(ALB)、总蛋白(TP)均显著升高,提示雄黄能够造成肝、肾组织的实质性损伤。同时,在尿样中发现丙酮酸盐、甜菜碱、马尿酸盐、苯乙酰甘氨酸下调;α-酮戊二酸、琥珀酸盐、柠檬酸盐、3-D-羟基丁酸、丙酮、牛磺酸量升高。在血样中发现丙酮、胆碱、胆碱磷酸、甜菜碱、N-乙酰糖蛋白、VLDL/LDL、不饱和脂肪升高;在肝组织匀浆液中发现乳酸盐、葡萄糖量下降,谷氨酸盐、胆碱、胆碱磷酸、甜菜碱、腺嘌呤、核糖、糖原升高。结果表明,雄黄能够扰乱能量代谢、胆碱代谢、氨基酸代谢导致机体的毒性变化。其他相关的研究见表 1。
| 表 1 其他代谢组学研究 Table 1 Studies on others metabonomics |
中药复方是在中医思维方法的指导下,通过四诊(望、闻、问、切),辨明证候,选择药味,按照君、臣、佐、使的配伍原则组成复方,在整体上调节人体平衡和内环境的稳态。中药复方注重从整体来调节人体的平衡,通过复方中的多成分作用于人体的五脏六腑,不仅能够治疗主证,从整体来调节各个相互联系的脏腑、组织、器官,同时能治疗兼证,最终起到标本兼治的目的[43]。西医与化学药在一些疾病尤其是慢性疾病的治疗上显得越来越无力,而中药特别是中药复方则显示了其独特优势。近年来国内外研究者对中药特别是中药复方的研究逐渐重视,掀起了一股中药研究的热潮。由于中药复方作用于人体的多维非线性的复杂效应,部分研究脱离了中医药理论的指导,或者是利用化学药的研究方法进行中药研究,虽然取得了部分阶段性成果,但在中药复方的配伍机制、组方原理及药效物质基础等方面仍没有取得突破性进展[44]。中药复方的药效物质基础和药理作用机制十分复杂,特别是缺乏一种有效的理论方法体系作为指导,导致中药复方的研究发展缓慢,这一现状也构成了中医药研究与中药现代化进程中的“瓶颈”问题。
黄连解毒汤首载于葛洪《肘后备急方》,是一味清热解毒的经典药方,由黄连、黄芩、黄柏、栀子(3∶2∶2∶3)4味药组成,中医方解认为以黄连泻心火、兼泻中焦之火为君;黄芩清肺热、泻上焦之火为臣;黄柏泻下焦之火,栀子通泻三焦之火,导热下行,合为佐使,共以收泻火解毒之功[45]。Wang等[46]采用1H-NMR技术分析尿样与脑组织中代谢物的变化,研究黄连解毒汤对于缺血性脑卒中的治疗作用,结果表明与模型组大鼠相比,黄连解毒汤组大鼠尿样中脂蛋白、丙氨酸、NAC、OAG、β-葡萄糖、甘油量显著下降,α-葡萄糖显著上升;脑组织中缬氨酸、乳酸盐、青蟹肌醇、黄嘌呤量显著下降,肌酐与磷酸肌酐量显著升高,提示黄连解毒汤可以通过改变能量代谢,改善氧化应激造成的细胞膜与线粒体损坏,改变神经递质与氨基酸代谢,调节渗透压,改善炎症损伤来达到治疗缺血性脑卒中的作用。柳长凤等[47]通过代谢组学方法研究黄连解毒汤的配伍规律,以热病证候所有代谢产物的整体变化,综合评价黄连解毒汤中君、臣、佐、使的作用及配伍规律,发现黄连在组方中作为君药发挥主要药理作用,佐使药也表现了一定的作用,但是其臣药黄芩的作用却值得商榷。左冉等[48]通过LC-FT-ICR- MS方法研究黄连解毒汤体内发挥疗效的效应物质基础,主要为环烯醚萜类、生物碱类、黄酮类,并且发现主要成分在大鼠体内多以二相代谢产物形式存在,包括葡糖醛酸和硫酸化产物。
四逆汤是《伤寒论》中的经典名方,由附子、干姜、甘草组成,具有回阳救逆之功效,现代研究表明四逆汤具有显著的心血管活性。Tan等[49]证实了四逆汤的主要成分包括乌头类生物碱、姜辣素、黄酮和皂苷类化合物,且发现四逆汤中乌头类生物碱在大鼠体内的主要代谢途经为O-去甲基化和水解,黄酮化合物的主要代谢途经为葡萄糖醛酸化、硫酸化、还原、去甲基化、羟化等。谭光国[50]采用反相色谱和亲水作用色谱-质谱联用技术建立了大鼠全面的血清代谢指纹谱,以冠脉结扎诱导的大鼠心肌梗死为模型,对四逆汤治疗心肌梗死的作用进行了血清代谢组学研究,筛选鉴定了21种潜在血清生物标志物,主要涉及鞘脂代谢、磷脂代谢、脂肪酸转运和代谢、色氨酸代谢等途经,发现四逆汤通过调节这些失衡的代谢途经而发挥治疗心肌梗死的作用。此外,谭光国[50]用液质联用技术和核磁共振波谱技术建立了大鼠尿液代谢指纹谱,以冠脉结扎诱导的大鼠心肌梗死为模型,对四逆汤治疗心肌梗死的作用进行了尿液代谢组学研究,筛选鉴定了19种潜在尿液生物标志物,主要涉及糖酵解、三羧酸循环、氨基酸代谢、嘌呤代谢和嘧啶代谢等代谢途径,以改变的代谢通路为潜在的药物靶标,并结合生理学指标分析手段,系统地揭示了四逆汤能够逆转多条失衡的代谢途经来调整机体的能量代谢水平,以改善了心肌梗死的状态。其他相关的研究见表 1。
2.3 中医“证候”本质的揭示证候研究是中医基础研究的一个关键的科学问题,在整个中医药理论体系的框架内,中医的证候问题始终处于核心的地位,它是连接临床和基础理论的桥梁,也是中医药现代化能够取得突破的关键点[51]。中医“证候”是指疾病发生和演变过程中某阶段以及患者个体所处特定内、外环境本质的反映,其以相应的症、舌、脉、形、色、神表现出来,能够不同程度地揭示病因、病位、病性、邪正盛衰、病势。在疾病发生发展过程中,具有各个内在联系的一组症状和体征,可将其称为“证候”,每一个“证”均有其外候与内涵,外候是疾病及其病理的外在表现,是中医通过望、闻、问、切四诊所获得整体信息和诊断、治疗的主要依据;内涵是生物体外在表象的背后蕴藏着疾病发生的病因病机、病理变化等生物体内在的变化信息,是开展研究工作的主要方向。目前一般采用代谢组学研究中医证候动物模型以及基于临床的证候代谢组学[52]。
李英帅[53]通过1H-NMR技术研究阳虚、阴虚体质血液与尿液代谢组学特征。阳虚体质是阳气不足,以虚寒表现为主要特征,阴虚体质是阴液亏少,以虚热表现为主要特征;在形成因素上,以过寒则伤阳、过热则伤阴为主要因素;在发病倾向上,阳虚体质易患痹证、泄泻、感冒、自汗、水肿、痰饮、咳喘、遗尿,阴虚体质易患便秘、咳嗽、血证、消渴、肺疹。发现阳虚的尿样生物标志物中,肌酐量降低,乳酸、二甲胺、柠檬酸、马尿酸量增加;血样生物标志物中,脂类、乳酸、VLDL/LDL、N-乙酰糖蛋白、脂肪酸、不饱和脂肪酸量降低,谷氨酰胺、葡萄糖、高密度脂蛋白含量增多。阴虚质尿液中肌酐、二甲胺、柠檬酸含量降低,甘氨酸、葡萄糖含量增多,血样中脂类、乳酸、丙氨酸、葡萄糖、VLDL/LDL、N-乙酰糖蛋白、不饱和脂肪酸量降低。实验结果证明阳虚、阴虚体质具有能量代谢、脂代谢、糖代谢、氨基酸代谢的差异,以及神经递质、脏腑功能的改变。
严蓓等[54]通过GC/TOF-MS研究心血瘀阻与气阴两虚证心肌缺血大鼠模型的代谢组学表征与辨识,发现缬氨酸、2-氨基丁酸、甘氨酸、丝氨酸、苏氨酸、2,5-二氨基戊内酰胺、鸟氨酸、羟脯氨酸、赖氨酸、2-羟基丁酸、3-羟基丁酸、呋喃半乳糖、肌醇是区分心血瘀阻与气阴两虚证心肌缺血大鼠模型的潜在的生物标志物,其中血瘀组大鼠血浆中前9种物质显著高于气阴两虚组,而后5种物质显著低于气阴两虚组。研究发现,这2种心肌缺血中医证的共同特点是它们与能量代谢、氧化应激反应、氨基酸代谢等多种代谢通路的异常相关,这是整体多个系统功能改变,共同造成的结果,但是不同病证之间又有不同的代谢特点。其他相关的研究见表 1。
3 展望中医药是中华民族的宝贵财富,是我国最具有原始创新潜力的学科领域,而中医药现代化就是用现代的科学技术对传统中医药的关键问题进行科学的阐释,对传统中医药的理论进行重新审视及去伪存真。代谢组学技术的使用,为中医药现代化提供了全新的技术手段。目前,代谢组学在中药药效物质与作用机制、中药安全性评价、中药复方研究等方面都取得了可喜的成果,获得了相关的生物标记物,为中药的进一步研究和探索提供了一定的理论依据。但是,代谢组学研究仅处于模式识别和生物标记物识别的层次,距离全面的代谢组学研究目标还有一定差距,如何建立专业、系统的方法对所有能采集到的图谱信息数据进行全面分析,对样品图谱中所有有差异的部分进行分析和研究也是影响其发展的关键技术难题。但代谢组学作为一门新兴的学科,仍处于不断发展和逐步完善的阶段,伴随着各种高分辨、高通量和高灵敏度分析技术的产生,各种多元统计方法的更新和代谢数据库的不断完善,代谢组学将会对中药的研究产生深远影响,这一领域将具有广阔的发展空间与前景。
| [1] | 林景超, 李后开, 周明眉, 等. 代谢组学、药物代谢组学与中医药现代化 [J]. 中国医学科学院学报, 2007, 29(6): 818-822. |
| [2] | 刘昌孝. 方兴未艾的中药代谢组学研究 [J]. 中国天然药物, 2008, 6(2): 81. |
| [3] | 黄晓晨, 宿树兰, 郭建明, 等. 代谢组学在中医药若干科学问题研究中的应用与思考 [J]. 中草药, 2014, 45(2): 147-153. |
| [4] | Lao Y M, Jiang J G, Yan L, et al. Application of metabonomic analytical techniques in the modernization and toxicology research of traditional Chinese medicine [J]. Br J Pharmacol, 2009, 157(7): 1128-1141. |
| [5] | Ott K H, Aranibar N. Nuclear magnetic resonance metabonomics: methods for drug discovery and development [J]. Methods Mol Biol, 2007, 358(2): 247-271. |
| [6] | 田俊生, 史碧云, 冯光明, 等. 慢性温和不可预知应激抑郁模型大鼠粪便1H-NMR代谢组学研究 [J]. 中草药, 2013, 44(22): 3170-3176. |
| [7] | Kim H K, Choi Y H, Verpoorte R. NMR-based metabolomic analysis of plants [J]. Nat Protoc, 2010, 5(3): 536-549. |
| [8] | 骆泽宇. 核磁共振-质谱联用技术在药学领域的应用进展 [J]. 中国医院药学杂志, 2007, 27(6): 807-809. |
| [9] | Londry F, Wells G, March R, et al. Enhanced mass resolution in a quadrupole ion trap [J]. Rapid Commun Mass Spectrom, 1993, 7(1): 43-45. |
| [10] | Dunn W B, Elli D. Metabolomics: current analytical patforms and methodol [J]. Trends Anal Chem, 2005, 24(4): 285-294. |
| [11] | Lindon J C, Nicholson J K. Spectroscopic and statistical techniques for information recovery in metabonomics and metabolomics [J]. Annu Rev Anal Chem, 2008, 1: 45-69. |
| [12] | Ma S, Chowdhury S K, Alton K B. Application of mass spectrometry for metabolite identification [J]. Curr Drug Metab, 2006, 7(5): 503-523. |
| [13] | Prasad B, Garg A, Takwani H, et al. Metabolite identification by liquid chromatography-mass spectrometry [J]. Trends Anal Chem, 2011, 30(2): 360-387. |
| [14] | Bedair M, Sumner L W. Current and emerging mass-spectrometry technologies for metabolomics [J]. Trends Anal Chem, 2008, 27(3): 238-250. |
| [15] | Britz-Mckibbin P, Terabe S. High-sensitivity analyses of metabolites in biological samples by capillary electrophoresis using dynamic pH junction-sweeping [J]. Chem Rec, 2002, 2(6): 397-404. |
| [16] | Soga T, Ohashi Y, Ueno Y, et al. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry [J]. J Proteome Res, 2003, 2(5): 488-494. |
| [17] | Soga T, Ueno Y, Naraoka H, et al. Pressure-assisted capillary electrophoresis electrospray ionization mass spectrometry for analysis of multivalent anions [J]. Anal Chem, 2002, 74(24): 6224-6229. |
| [18] | Beckonert O, Keun H C, Ebbels T M, et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts [J]. Nat Protoc, 2007, 2(11): 2692-2703. |
| [19] | Waybright T J, Van Q N, Muschik G M, et al. LC-MS in metabonomics: Optimization of experimental conditions for the analysis of metabolites in human urine [J]. J Liq Chromatogr Relat Technol, 2006, 29(17/20): 2475-2497. |
| [20] | Zhao X J, Zhang Y, Meng X L, et al. Effect of a traditional Chinese medicine preparation Xindi soft capsule on rat model of acute blood stasis: a urinary metabonomics study based on liquid chromatography mass spectrometry [J]. J Chromatogr B, 2008, 873(2): 151-158. |
| [21] | Gir I S, Krausz K W, Idle J R, et al. The metabolomics of (+/-)-arecoline 1-oxide in the mouse and its formation by human flavin-containing monooxygenases [J]. Biochem Pharmacol, 2007, 73(4): 561-573. |
| [22] | Qiu, Y, Su M, Liu Y, et al. Application o f ethyl chloroformate derivatization for gas chromatography- mass spectrometry based metabonomic profiling [J]. Anal Chim Acta, 2007, 583(2): 277-283. |
| [23] | Dai Y T, Li Z Y, Xue L M, et al. Metabolomics study on the anti-depression effect of xiaoyaosan on rat model o f chronic unpredictable mild stress [J]. J Ethnopharmacol, 2010, 128(2): 482-489. |
| [24] | Wang X Y, Zhao T, Qiu Y P, et al. Metabonomics approach to understanding acute and chronic stress in rat models [J]. J Proteome Res, 2009, 8(5): 2511-2518. |
| [25] | Keun H. Metabonomic modeling of drug toxicity [J]. Pharmacol Therap, 2006, 109(2): 92-106. |
| [26] | Trygg J, Lundstedt T. Chemometrics in metabonomics [J]. J Proteome Res, 2007, 6(2): 469-479. |
| [27] | 李 晶, 吴晓健, 刘昌孝, 等. 代谢组学研究中数据处理新方法的应用 [J]. 药学学报, 2006, 41(1): 47-53. |
| [28] | Crockford D J, Holmes E, Lindon J C. Statistical heterospectroscopy, an approach to the integrated analysis of NMR and UPLC-MS data sets: Application in metabonomic toxicology studies [J]. Anal Chem, 2006, 78(2): 363-371. |
| [29] | Vanherweghem J L, Depierreux M, Tielemans C, et al. Rapidly progressive interstitial renal fibrosis in young women: association with slimming regimen including Chinese herbs [J]. Lancet, 1993, 341(8842): 387-391. |
| [30] | Lord G M, Tagore R, Cook T, et al. Nephropathy caused by Chinese herbs in the UK [J]. Lancet, 1999, 354(9177): 481-482. |
| [31] | 陈 勇. 应用基因表达谱芯片研究黄药子对小鼠肝脏的毒性机制 [J]. 分子细胞生物学报, 2006, 39(6): 568-571. |
| [32] | 孙 蓉, 张丽美, 尹建伟, 等. 分子生物学技术在中药毒理学研究中的应用前景 [J]. 药物警戒, 2006, 3(6): 339-341. |
| [33] | 刘树民, 崔立然. 代谢组学技术在中药毒性研究中的应用前景 [J]. 毒理学杂志, 2008, 22(2): 155-158. |
| [34] | 梁 琦, 倪 诚, 颜贤忠, 等. 广防己、粉防己的肝肾毒性及代谢组学比较研究 [J]. 中国中药杂志, 2010, 35(21): 2882-2888. |
| [35] | 王 璟, 莫传丽, 却 翎, 等. 苍耳子不良反应研究进展 [J]. 中草药, 2011, 42(3): 613-616. |
| [36] | 张婷婷, 鄢良春, 赵军宁, 等. 苍耳子"毒性"及现代毒理学研究进展 [J]. 药物评价研究, 2010, 33(5): 361-366. |
| [37] | Lu F, Cao M, Wu B, et al. Urinary metabonomics study on toxicity biomarker discovery in rats treated with Xanthii Fructus [J]. J Ethnopharmacol, 2013, 149(1): 311-320. |
| [38] | Steyn P S, Heerden F R. Bufadienolides of plant and animal origin [J]. Nat Prod Rep, 1998, 15(4): 397-413. |
| [39] | Kennedy D J, Vetteth S, Periyasamy S M, et al. Central role for the cardiotonic steroid marinobufagenin in the pathogenesis of experimental uremic cardiomyopathy [J]. Hypertension, 2006, 47(3): 488-495. |
| [40] | 梁晓萍, 张 政, 胡 坪, 等. 蟾酥急性毒性的代谢组学研究 [J]. 高等学校化学学报, 2011, 32(1): 38-43. |
| [41] | 周超凡, 林育华. 传统中药雄黄应用概况及其安全性 [J]. 药物不良反应杂志, 2008, 10(2): 104-109. |
| [42] | Wei L, Liao P Q, Wu H F, et al. Metabolic profiling studies on the toxicological effects of realgar in rats by 1H NMR spectroscopy [J]. Toxicol Appl Pharmacol, 2009, 234(3): 314-325. |
| [43] | 胡耀华, 王淑萍, 姜 鹏, 等. 代谢组学及其在中药复方中的应用 [J]. 药学实践杂志, 2010, 28(6): 401-405. |
| [44] | 韩旭华, 牛 欣. 方剂药效物质系统与单味药成分之间的非线性关系 [J]. 中华中医药杂志, 2006, 21(5): 289-291. |
| [45] | 刘 磊, 姜 鹏, 窦圣姗, 等. 黄连解毒汤的化学及药理学研究进展 [J]. 中草药, 2008, 39(6): 935-938. |
| [46] | Wang P R, Wang J S, Yang M H, et al. Neuroprotective effects of Huang-Lian-Jie-Du-Decoction on ischemic stroke rats revealed by 1H NMR metabolomics approach [J]. J Pharm Biomed Anal, 2014, 88: 106-116. |
| [47] | 柳长凤, 陈平平, 刘树民, 等. 基于代谢组学技术的黄连解毒汤配伍规律研究 [J]. 中国实验方剂学杂志, 2012, 18(13): 146-152. |
| [48] | 左 冉, 王宏洁, 司 南, 等. LC-FT-ICR-MS 方法鉴定黄连解毒汤在大鼠血浆中的原形及代谢产物研究 [J]. 药学学报, 2014, 49(2): 237-243. |
| [49] | Tan G, Zhu Z, Jing J, et al. Characterization of constituents in Sini decoction and rat plasma by high-performance liquid chromatography with diode array detection coupled to time-of-flight mass spectrometry [J]. Biomed Chromatogr, 2011, 25(8): 913-924. |
| [50] | 谭光国. 中药四逆汤化学物质组和代谢组学研究 [D]. 上海: 第二军医大学, 2012. |
| [51] | 刘 蕾, 郭淑贞, 王 伟. 中医证候研究的现状及发展趋势 [J]. 中华中医药杂志, 2008, 23(8): 661-663. |
| [52] | 王芹芹, 张芳梅, 王喜军. 基于代谢组学的中医证候本质研究进展 [J]. 世界科学技术—中医药现代化, 2011, 13(3): 541-545. |
| [53] | 李英帅. 阳虚阴虚体质理论及代谢组学比较研究 [D]. 北京: 北京中医药大学, 2009. |
| [54] | 严 蓓, 阿基业, 郝海平, 等. 心血瘀阻与气阴两虚证心肌缺血大鼠模型的代谢组学表征与辨识 [J]. 中国科学C辑: 生命科学, 2008, 38(12): 1143-1151. |
| [55] | Zhang Z H, Zhao Y Y, Cheng X L, et al. Metabonomic study of biochemical changes in the rat urine induced by Pinellia ternata (Thunb.) Berit [J]. J Pharm Biomed Anal, 2013, 85: 186-193. |
| [56] | Zhang Z H, Zhao Y Y, Cheng X L, et al. General toxicity of Pinellia ternata (Thunb.) Berit. in rat: A metabonomic method for profiling of serum metabolic changes [J]. J Ethnopharmacol, 2013, 149(1): 303-310. |
| [57] | Ma C, Bi K S, Zhang M, et al. Metabonomic study of biochemical changes in the urine of Morning glory seed treated rat [J]. J Pharm Biomed Anal, 2010, 53(3): 559-566. |
| [58] | Ma C, Bi K S, Zhang M, et al. Toxicology effects of Morning glory seed in rat: A metabonomic method for profiling of urine metabolic changes [J]. J Ethnopharmacol, 2013, 130(1): 134-142. |
| [59] | Wei L, Liao P, Wu H, et al. Toxicological effects of cinnabar in rats by NMR-based metabolic profiling of urine and serum [J]. Toxicol Appl Pharmacol, 2008, 227(3): 417-429. |
| [60] | Sun B, Li L, Wu S, et al. Metabolomic analysis of biofluids from rats treated with Aconitum alkaloids using nuclear magnetic resonance and gas chromatography/ time-of-flight mass spectrometry [J]. Anal Biochem, 2009, 395(2): 125-133. |
| [61] | Wei L, Liao P, Wu H, et al. Metabolic profiling studies on the toxicological effects of realgar in rats by (1)H NMR spectroscopy [J]. Toxicol Appl Pharmacol, 2009, 234(3): 314-325. |
| [62] | Chen M J, Su M M, Zhao L P, et al. Metabonomic study of aristolochic acid-induced nephrotoxicity in rats [J]. J Proteome Res, 2006, 5(4): 995-1002. |
| [63] | Ni Y, Su M, Qiu Y, et al. Metabolic profiling using combined GC-MS and LC-MS provides a systems understanding of aristolochic acid-induced nephrotoxicity in rat [J]. FEBS Lett, 2007, 581(4): 707-711. |
| [64] | Chen M, Ni Y, Duan H, et al. Mass spectrometry-based metabolic profiling of rat urine associated with general toxicity induced by the multiglycoside of Tripterygium wilfordii Hook. f [J]. Chem Res Toxicol, 2008, 21(2): 288-294. |
| [65] | Li L, Sun B, Zhang Q, et al. Metabonomic study on the toxicity of Hei-Shun-Pian, the processed lateral root of Aconitum carmichaelii Debx. (Ranunculaceae) [J]. J Ethnopharmacol, 2008, 116(3): 561-568. |
| [66] | Wang X, Wang H, Zhang A, et al. Metabolomics study on the toxicity of aconite root and its processed products using ultraperformance liquid-chromatography/ electrospray-ionization synapt high-definition mass spectrometry coupled with pattern recognition approach and ingenuity pathways analysis [J]. J Proteome Res, 2012, 11(2): 1284-1301. |
| [67] | Sun B, Wu S, Li L, et al. A metabolomic analysis of the toxicity of Aconitum sp. alkaloids in rats using gas chromatography/mass spectrometry [J]. Rapid Commun Mass Spectrom, 2009, 23(8): 1221-1228. |
| [68] | Liu Y R, Huang R Q, Liu L J, et al. Metabonomics study of urine from Sprague-Dawley rats exposed to Huang-yao-zi using 1H NMR spectroscopy [J]. J Pharm Biomed Anal, 2010, 52(1): 136-141. |
| [69] | Xue L, Wang Y, Liu L, et al. A (1)H NMR-Based metabonomics study of postmenopausal osteoporosis and intervention effects of Er-Xian Decoction in ovariectomized rats [J]. Int J Mol Sci, 2011, 12(11): 7635-7651. |
| [70] | Zhao X, Zhang Y, Meng X, et al. Effect of a traditional Chinese medicine preparation Xindi soft capsule on rat model of acute blood stasis: A urinary metabonomics study based on liquid chromatography-mass spectrometry [J]. J Chromatogr B, 2008, 873(2): 151-158. |
| [71] | Gao X, Zheng X, Li Z, et al. Metabonomic study on chronic unpredictable mild stress and intervention effects of Xiaoyaosan in rats using gas chromatography coupled with mass spectrometry [J]. J Ethnopharmacol, 2011, 137(1): 690-699. |
| [72] | Dai W D, Wei C, Kong H W, et al. Effect of the traditional Chinese medicine tongxinluo on endothelial dysfunction rats studied by using urinary metabonomics based on liquid chromatography-mass spectrometry [J]. J Pharm Biomed Anal, 2011, 56(1): 86-92. |
| [73] | He H B, Ren X B, Wang X Y, et al. Therapeutic effect of Yunnan Baiyao on rheumatoid arthritis was partially due to regulating arachidonic acid metabolism in osteoblasts [J]. J Pharm Biomed Anal, 2012, 59: 130-137. |
| [74] | Su Z H, Li S Q, Zou G A, et al. Urinary metabonomics study of anti-depressive effect of Chaihu-Shu-Gan-San on an experimental model of depression induced by chronic variable stress in rats [J]. J Pharm Biomed Anal, 2011, 55(3): 533-539. |
| [75] | Xie B, Gong T, Gao R, et al. Development of rat urinary HPLC-UV profiling for metabonomic study on Liuwei Dihuang Pills [J]. J Pharm Biomed Anal, 2009, 49(2): 492-497. |
| [76] | Wang P, Sun H, Lv H, et al. Thyroxine and reserpine-induced changes in metabolic profiles of rat urine and the therapeutic effect of Liu Wei Di Huang Wan detected by UPLC-HDMS [J]. J Pharm Biomed Anal, 2010, 53(3): 631-645. |
| [77] | Yang B, Zhang A, Sun H, et al. Metabolomic study of insomnia and intervention effects of Suanzaoren decoction using ultra-performance liquid- chromatography/ electrospray-ionization synapt high- definition mass spectrometry [J]. J Pharm Biomed Anal, 2012, 58: 113-124. |
| [78] | Liang X, Chen X, Liang Q, et al. Metabonomic study of Chinese medicine Shuanglong formula as an effective treatment for myocardial infarction in rats [J]. J Proteome Res, 2011, 10(2): 790-799. |
| [79] | Jiang H, Nie L, Li Y, et al. Application of ultra-performance liquid chromatography coupled with mass spectrometry to metabonomic study on spontaneously hypertensive rats and intervention effects of Ping Gan prescription [J]. J Sep Sci, 2012, 35(4): 483-489. |
| [80] | Jiang P, Dai W, Yan S, et al. Potential biomarkers in the urine of myocardial infarction rats: a metabolomic method and its application [J]. Mol Biosyst, 2011, 7(3): 824-831. |
| [81] | Lv Y, Liu X, Yan S, et al. Metabolomic study of myocardial ischemia and intervention effects of Compound Danshen Tablets in rats using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2010, 52(1): 129-135. |
| [82] | Lu Y, Liu X, Liang X, et al. Metabolomic strategy to study therapeutic and synergistic effects of tanshinone IIA, salvianolic acid B and ginsenoside Rb1 in myocardial ischemia rats [J]. J Ethnopharmacol, 2011, 134(1): 45-49. |
| [83] | Wang H F, Bai J, Chen G, et al. A metabolic profiling analysis of the acute hepatotoxicity and nephrotoxicity of Zhusha Anshen Wan compared with cinnabar in rats using 1H NMR spectroscopy [J]. J Ethnopharmacol, 2013, 146(2): 572-580. |
| [84] | Zhao L C, Gao H C, Zhao Y X, et al. Metabonomic analysis of the therapeutic effect of Zhibai Dihuang Pill in treatment of streptozotocin-induced diabetic nephropathy [J]. J Ethnopharmacol, 2012, 142(3): 647-656. |
| [85] | Liu Y T, Jia H M, Chang X, et al. Metabolic pathways involved in Xin-Ke-Shu protecting against myocardial infarction in rats using ultra high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2014, 90: 35-44. |
| [86] | Gou X J, Tao Q, Feng Q, et al. Urinary metabonomics characterization of liver fibrosis induced by CCl4 in rats and intervention effects of Xia Yu Xue Decoction [J]. J Pharm Biomed Anal, 2013, 74: 62-65. |
| [87] | Li F, Lu X, Liu H, et al. A pharmaco-metabonomic study on the therapeutic basis and metabolic effects of Epimedium brevicornum Maxim. on hydrocortisone- induced rat using UPLC-MS [J]. Biomed Chromatogr, 2007, 21(4): 397-405. |
| [88] | Liu S, Lu F, Wang X, et al. Metabolomic study of a rat fever model induced with 2,4-dinitrophenol and the therapeutic effects of a crude drug derived from Coptis chinensis [J]. Am J Chin Med, 2011, 39(1): 95-109. |
| [89] | Chen M J, Zhao L P, Jia W. Metabonomic study on the biochemical profiles of a hydrocortisone-induced animal model [J]. J Proteome Res, 2005, 4(6): 2391-2396. |
| [90] | Yan B, A J Y, Hao H, et al. Metabonomic phenotype and identification of ‘heart blood stasis obstruction pattern’ and ‘qi and yin deficiency pattern’ of myocardial ischemia rat models [J]. Sci China Series C: Life Sci, 2009, 52(11): 1081-1090. |
| [91] | Wang S X, Luo K, Liang J, et al. Metabolomics study on the synergistic interaction between Salvia miltiorrhiza and Lignum dalbergiae odoriferae used as ‘Jun-Shi’ herbs in a S. miltiorrhiza recipe [J]. Med Chem Res, 2011, 20(1): 16-22. |
| [92] | Wang X J, Zhang A H, Han Y, et al. Urine metabolomics analysis for biomarker discovery and detection of jaundice syndrome in patients with liver disease [J]. Mol Cell Proteom, 2012, 11(8): 370-380. |
| [93] | Tan Y, Liu X R, Lu C, et al. Metabolic profiling reveals therapeutic biomarkers of processed Aconitum carmichaeli Debx in treating hydrocortisone induced Kidney-Yang deficiency syndrome rats [J]. J Ethnopharmacol, 2014, 152(3): 585-593. |
| [94] | Yan S, Wu B, Lin Z, et al. Metabonomic characterization of aging and investigation on the anti-aging effects of total flavones of Epimedium [J]. Mol Biosyst, 2009, 5(10): 1204-1213. |
| [95] | Zhong F, Liu X, Zhou Q, et al. (1)H NMR spectroscopy analysis of metabolites in the kidneys provides new insight into pathophysiological mechanisms: applications for treatment with Cordyceps sinensis [J]. Nephrol Dialy Transplant, 2012, 27(2): 556-565. |
| [96] | Gu Y, Zhang Y, Shi X, et al. Effect of traditional Chinese medicine berberine on type 2 diabetes based on comprehensive metabonomics [J]. Talanta, 2010, 81(3): 766-772. |
| [97] | Sun C H, Teng Y, Li G Z, et al. Metabonomics study of the protective effects of Lonicera japonica extract on acute liver injury in dimethylnitrosamine treated rats [J]. J Pharm Biomed Anal, 2010, 53(1): 98-102. |
| [98] | Yao H, Shi P, Zhang L, et al. Untargeted metabolic profiling reveals potential biomarkers in myocardial infarction and its application [J]. Mol Biosyst, 2010, 6(6): 1061-1070. |
| [99] | Liu X, Zhang S, Lu X, et al. Metabonomic study on the anti-osteoporosis effect of Rhizoma Drynariae and its action mechanism using ultra-performance liquid chromatography-tandem mass spectrometry [J]. J Ethnopharmacol, 2012, 139(1): 311-317. |
| [100] | Li X, Luo X, Lu X, et al. Metabolomics study of diabetic retinopathy using gas chromatography-mass spectrometry: a comparison of stages and subtypes diagnosed by Western and Chinese medicine [J]. Mol Biosyst, 2011, 7(7): 2228-2237. |
| [101] | Zhao Y Y, Lei P, Chen D Q, et al. Renal metabolic profiling of early renal injury and renoprotective effects of Poria cocos epidermis using UPLC Q-TOF/HSMS/ MSE [J]. J Pharm Biomed Anal, 2013, 81/82: 202-209. |
| [102] | Hua Y L, Xue W X, Zhang M, et al. Metabonomics study on the hepatoprotective effect of polysaccharides from different preparations of Angelica sinensis [J]. J Ethnopharmacol, 2014, 151(3): 1090-1099. |
| [103] | Yu Y, Yi Z B, Liang Y Z. Validate antibacterial mode and find main bioactive components of traditional Chinese medicine Aquilegia oxysepala [J]. Bioorg Med Chem Lett, 2007, 17(7): 1855-1859. |
| [104] | Qi Y, Qu L, Wu Y, et al. A plasma metabonomic investigation into the intervention of volatile oil of Magnolia biondii Pamp on rat model of acute inflammation [J]. J Ethnopharmacol, 2011, 137(1): 487-494. |
| [105] | Wang X, Su M, Qiu Y, et al. Metabolic regulatory network alterations in response to acute cold stress and ginsenoside intervention [J]. J Proteome Res, 2007, 6(9): 3449-3455. |
 2015, Vol. 46
2015, Vol. 46


