水飞蓟Silybum rnarianum (L.) Gaertn. 亦称乳蓟子、水飞雉、奶蓟,是菊科水飞蓟属一年或二年生草本植物,原产于西欧和北非[1],我国1972年从西德引种,现全国各地均有栽培。水飞蓟为经典的护肝药物,其干燥的果实被作为药材应用于临床。水飞蓟果实提取物水飞蓟素为黄酮类和木脂素类化合物,其主要的活性成分有水飞蓟宾(silibinin/silybin)、异水飞蓟宾(isosilybin)、水飞蓟亭(silychristin)和水飞蓟宁(silydianin)等7种[2, 3],水飞蓟宾占其70%,是水飞蓟素的主要成分。近年来的大量研究表明水飞蓟宾除了具有保肝作用外,亦表现出多种多样的药理学功能,如保护脑神经系统、保护心肌细胞、保护皮肤、抗炎以及良好的抗肿瘤作用[4]。
目前尚未开发出一种真正有效地适合于植物器官组织大规模培养的生物反应器。针对生物反应器的限制,试图建立高产的植物细胞悬浮培养体系是比较理想的。悬浮培养与固体培养基相比,增加培养物与营养液的接触面积,改善营养供应;同时悬浮培养在震荡的过程中可避免细胞代谢产生的有害物质在局部积累而对自身产生毒害作用。
近年来,利用壳聚糖代谢途径中形成的寡聚糖可调节植物根、茎、叶和花的生长发育,同时增加作物的免疫力,最终达到增产目的的报道屡见不鲜[5]。经壳聚糖处理的大豆种子,加水后能快速地诱导出壳聚糖酶,有利于大豆的迅速生长,提高发芽率。小麦种子经壳聚糖处理后,可增强抗病害的能力,同时促进木质素的形成,提高麦秆抗倒伏能力,与未处理过的小麦相比,可增产20%~30%[6]。日本已经将低壳聚糖制成生长调节剂,用于提高某些作物的产量[7]。
水杨酸能够在植物的抗病反应中诱导植物产生抗毒素。作为外源诱导子,水杨酸对植物细胞培养和次生代谢产物的调控所产生的特殊作用已引起越来越多学者的关注[8]。王康宇等[9]研究表明水杨酸能够提高愈伤组织过氧化物酶(POD)、苯丙氨解氨酶(PAL)、过氧化氢酶(CAT)的生物活性,POD是细胞抵御活性氧伤害的保护酶系统的主要组成部分,参与木质素、栓质素等合成及植物细胞壁的构建,同植物抗胁迫和植物的次生代谢密切相关。
1987年,研究者发现生物体内源NO合成机制,才认识到NO保护生物细胞的作用。硝普钠作为NO的供体广泛应用于研究中。NO是一种易扩散的生物活性小分子,参与植物的气孔运动,呼吸作用,种子萌发,根、茎、叶的生长发育,植物组织细胞的成熟衰老以及对生物与非生物环境胁迫的应答反应。樊洪泓等[10]用外源NO处理霍山石斛发现,NO可以提高光合作用的光能转化效率,缓解光抑制的发生,增强抗氧化系统清除活性氧的能力,有效保护光合机构免受强光伤害。另有研究表明一定浓度硝普钠处理可以促进种子萌发,延缓植物衰老[11, 12]。
本实验着重研究水飞蓟悬浮体系建立的条件及水杨酸、壳聚糖、硝普钠3种因子对水飞蓟悬浮细胞的形态、生长速率以及其水飞蓟宾量的影响,建立一种快速增殖的水飞蓟悬浮培养体系,为扩大培养、提高次生代谢产物产量奠定理论基础。
1 材料与方法 1.1 材料样品采自吉林农业大学药植园,经吉林农业大学中药材学院杨世海教授鉴定为水飞蓟Silybum marianum (L.) Gaertn. 的种子。水飞蓟宾对照品(批号MUST-13082201)购自曼斯特生物制品有限公司,质量分数大于99.50%。
1.2 方法 1.2.1 水飞蓟无菌苗的培养挑选成熟饱满的水飞蓟种子,在超净工作台内用温水浸泡20 min后,用去离子水清洗3次;75%乙醇浸泡30 s,去离子水清洗30 s,清洗3次;然后再用0.1% HgCl2浸泡7 min,去离子水再次清洗3 min/5次。最后用灭菌滤纸将种子表面的水分吸干,接种在MS固体培养基(不添加任何激素)中,置于24~25 ℃、光强2 000 lx、光照12 h/d、黑暗12 h/d的培养箱中培养,萌发无菌水飞蓟幼苗。
1.2.2 水飞蓟愈伤组织的诱导及培养取无菌苗叶片外植体,切成5 mm×5 mm小块,接种于加有激素的MS基本培养基上[13],25 ℃、暗培养,4 d后得到愈伤组织。将长势优良的愈伤组织接种于上述MS基本培养基中,对水飞蓟愈伤组织进行继代培养。
1.2.3 水飞蓟悬浮培养体系的建立及优化愈伤组织的诱导及生长主要受外植体、培养基等因素调控[14],配制4种液体培养基MS、N6、B5、White,加入一定质量浓度的6-BA、NAA、ZT,测定其增长量,选择适宜的液体培养基。利用正交助手软件设计正交试验,每瓶加入一定量切碎的愈伤组织,25 ℃下光照培养12 h/d、暗培养12 h/d。通过对培养基中不同质量浓度激素配比、生长周期、pH值和转速的选择,优化悬浮体系培养条件。在此基础上,测定不同因子对悬浮体系中水飞蓟增长量和水飞蓟宾量的影响,每个因子3组平行试验,建立最佳水飞蓟悬浮培养体系。
1.2.4 水飞蓟宾的测定参照文献方法[15],采用HPLC法测定水飞蓟宾的量。
2 结果与分析 2.1 水飞蓟悬浮培养体系的建立 2.1.1 液体培养基的筛选不同类型的基本培养基对细胞的生长和次生代谢产物的形成有很大的影响[16],配制4种组分差异较大的液体培养基MS、N6、B5、White[17],并选择6-BA 1.0 mg/L+NAA 1.0 mg/L+ZT 1.5 mg/L的激素配比,每瓶接种量约为1.3 g,每组样品设3组平行试验,光照培养(12 h/d)25 d,pH 6.5,转速 110r/min。观察生长状态并测定细胞增长量,结果见图 1。
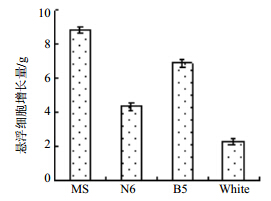 | 图 1 不同培养基对悬浮细胞增长量的影响Fig. 1 Effects of different media on growth of suspension cells |
设置pH值为5.0、6.0、6.5、7.0、7.5、8.0,编为1~6组,光照培养(12 h/d)25 d,转速 110 r/min,考察不同pH值对水飞蓟悬浮培养的影响,如图 2所示,当pH值小于6.0或高于7.5时,悬浮细胞严重褐化几乎不生长。pH值在6.0~7.0时,悬浮细胞增长量随着pH值的增加而增加;在pH值为7.0时,细胞增长量最大,达到8.68 g,并且生长状态良好,颜色为淡黄色。
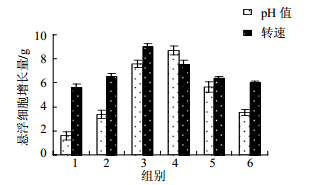 | 图 2 pH值和转速对悬浮细胞增长量的影响sFig. 2 Effects of pH value and rotational speed on growth of suspension cells |
根据优化的培养条件,每瓶接种量约为1.3 g,每组样品设3组平行试验,pH值7.0,光照培养(12 h/d)25 d,设置转速为70、90、110、130、150、170 r/min,编号为1~6组,考察不同转速下悬浮细胞增长量及生长状态。
培养转速对水飞蓟悬浮培养有较明显的调控作用,且不同转速之间有着一定差异性。由图 2可知,转速为110 r/min时,增长量达到9.01 g,130 r/min时对细胞增加也明显好于其他转数,170 r/min增长量最低,只有6.05 g。在培养过程中使用的锥形瓶体积较小,当转速为70~90 r/min时,转数较慢,培养液中的溶氧水平不足,可能导致细胞生长缓慢;当转速达到150~170 r/min时,转数太快,摇床不稳定,切力作用也较大,培养液容易溢出,导致污染,110 r/min对悬浮培养最有利。
2.1.4 液体培养周期的筛选根据优化的培养条件,光照培养(12 h/d),转速 110 r/min,pH 7.0,设置0、5、10、15、20、25、30、35 d不同培养周期,确定悬浮培养的最佳生长周期。
由图 3可知,水飞蓟悬浮细胞增长量与培养周期相关。液体培养基中的悬浮细胞从0~5 d增长量缓慢,呈现淡黄色,轻微褐化,继续培养;在10~20 d阶段,增长迅速,20 d时增长量达到9.54 g,呈淡黄绿色,有光泽,培养基清亮干净;20 d后增长明显变缓,30 d后几乎不增长,出现褐化,无光泽;培养液变混浊,培养瓶壁上出现死亡细胞。所以培养周期选择在20 d。液体培养基的培养时间与固体培养基相比明显缩短,且短时间内培养量增加,这样更有利于大批量培养水飞蓟悬浮培养体系建立。
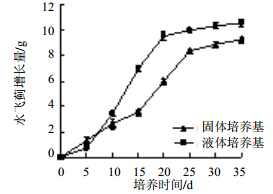 | 图 3 液体培养基与固体培养基培养周期筛选Fig. 3 Cultural period of liquid and solid media |
根据最佳激素质量浓度配制固体培养基,每瓶接种量为1.3 g,光照培养(12 h/d),每组样品设3组平行试验,优化水飞蓟固体培养基最佳生长周期。由图 3可知,水飞蓟细胞从0~10 d增长缓慢,呈现淡黄色;在15~25 d阶段,增长迅速,25 d时累积增长量达到8.39 g,呈嫩黄绿色,有光泽;30 d时增长变缓,比25 d增长量多,但是其状态不佳,出现少量褐化现象,35 d几乎不增长,出现严重褐化,无光泽。25 d时增长量与其他处理间差异显著,30~35 d时差异不显著,所以培养周期选择在25 d。
2.1.6 固体培养基MS中激素的筛选配制MS固体培养基,选择6-BA、NAA、ZT进行正交试验,以未添加任何激素的MS培养基作为对照,每瓶接种量为1.3 g,每组样品设3组平行试验,光照培养(12 h/d)25 d后,测定增长量,结果见表 1。
| 表 1 不同激素配比对水飞蓟增长量的影响(x±s,n=3) Table 1 Effect of different hormone ratios on growth of S. marianum (x±s,n = 3) |
结果表明,不同质量浓度激素的配比,水飞蓟的生长状态及增长量存在差异。第5组MS固体培养基中激素配比为6-BA 1.0 mg/L+NAA 1.0 mg/L+ZT 1.5 mg/L,生长状态最佳,呈现嫩黄绿色,水飞蓟愈伤组织生长量达到8.62 g,增长量与其他处理间存在显著差异(P<0.05)。
2.1.7 液体培养基中激素的筛选培养基中添加的植物生长调节剂与其加入量多少是产生细胞的关键环节,使用正交助手设计正交试验,以MS培养基为基础,加入6-BA、NAA、ZT,以未添加任何激素的MS培养基作为对照,每瓶接种量约为1.3 g,每组样品设3组平行试验,pH 7.0、转速110 r/min,光照培养(12 h/d)20 d,筛选最适宜的激素配比,由表 1可知,第5组激素配比为6-BA 1.5 mg/L+NAA 1.0 mg/L+ZT 1.5 mg/L,水飞蓟悬浮细胞生长最好,达到9.28 g,颗粒均匀,质地疏松,颜色呈淡黄色。液体培养基比固体培养基需要更高质量浓度的6-BA,可使坚实的愈伤组织变为松脆型,是进行悬浮培养的最合适的材料。由SPSS 17.0分析得知,第5组与其他处理间差异极显著(P<0.01)。
2.2 不同诱导子对水飞蓟悬浮细胞的影响 2.2.1 水杨酸考察不同质量浓度(0、0.01、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 μg/L,编号1~10)的水杨酸对水飞蓟悬浮细胞的影响,每瓶接种量约为1.3 g,按优选的悬浮培养体系培养,每组样品设3组平行试验,结果显示(图 4),水杨酸的浓度为0.05 μg/L时,悬浮细胞的增长量出现最高值5.32 g,随即下降,在培养过程中加入水杨酸并没有提高悬浮细胞增长量,反而比原来更低,培养液变浑浊,瓶壁上出现大量死细胞,水杨酸的加入改变了培养基的pH值,细胞不适合在较低的pH值中生长。
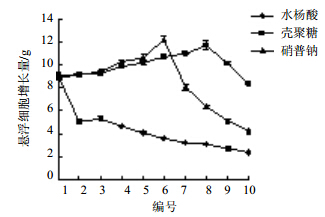 | 图 4 水杨酸、壳聚糖、硝普钠对水飞蓟悬浮细胞增长量的影响Fig. 4 Effects of salicylic acid,chitosan,and sodium nitroprusside on growth of suspension cells of S. marianum |
考察不同质量浓度(0、0.10、0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00 μg/L,编号1~10)壳聚糖对水飞蓟悬浮细胞的影响,每瓶接种量约为1.3 g,每组样品设3组平行试验,结果显示,悬浮细胞的增长量随着壳聚糖浓度的增加而升高,当培养液中壳聚糖的浓度达到3.00 μg/L时,增长量达到11.73 g,与其他处理间差异显著。随着壳聚糖浓度进一步增加时,悬浮细胞生长变缓。由此可知,3.00 μg/L的壳聚糖是维持水飞蓟悬浮培养的最适宜浓度(图 4)。
2.2.3 硝普钠利用硝普钠的性质,在悬浮培养体系中加入不同质量浓度(0、0.01、0.05、0.10、0.50、1.00、1.50、2.00、2.50、3.00 μg/L,编号1~10)的硝普钠,每瓶接种量约为1.3 g,按优选的悬浮培养体系培养,每组样品设3组平行试验,结果见图 4。在硝普钠的诱导下,水飞蓟悬浮细胞的确有延缓衰老的迹象,与其他组相比,硝普钠组的细胞可以延长生长10 d左右;水飞蓟悬浮细胞的增长量随着硝普钠质量浓度的增加而增加,当培养液中硝普钠的浓度达到1.00 μg/L时,增长量达到最大即12.24 g。进一步随着硝普钠浓度增加到1.50 μg/L时,细胞增长量下降甚至死亡。硝普钠提供的一氧化氮,参与对植物生理活动调控的过程也是其对植物实现伤害的过程,但是这种作用表现明确的剂量效应,即低浓度保护,高浓度伤害[18]。由此可知,1.00 μg/L的硝普钠浓度是维持水飞蓟悬浮培养的最适宜浓度。
2.3 水飞蓟宾的测定 2.3.1 水飞蓟宾标准曲线的绘制精密吸取水飞蓟宾对照品储备液50、80、250、500、1 000、1 500 μL置2 mL量瓶中,定容后摇匀。参照文献色谱条件[13]进样分析,以水飞蓟宾质量浓度(μg/mL)的对数值为横坐标(X),以峰面积的对数值为纵坐标(Y)进行线性回归,得回归方程Y=0.969 4 X+4.120 3(R2=0.999 2),水飞蓟宾在3.0~90.0 μg/mL与峰面积有良好的线性关系。
2.3.2 水飞蓟宾的测定取水飞蓟种子、水飞蓟原植物、水飞蓟固体培养基培养的愈伤组织、悬浮细胞、以及添加水杨酸、壳聚糖和硝普钠的悬浮细胞7种样品,参照文献方法[15]制备供试品,测定样品中水飞蓟宾的量。
结果表明,水飞蓟种子中水飞蓟宾量最高为2.197%,植物中为0.046%,固体培养基培养的愈伤组织中为0.349%,悬浮细胞中为0.501%,悬浮培养基中添加水杨酸、壳聚糖、硝普钠培养的细胞中的水飞蓟宾分别为0.146%、0.616%和0.686%。
2.3.3 不同诱导子对悬浮体系中水飞蓟宾量的影响对悬浮培养基中加入不同质量浓度的水杨酸(0.01、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 μg/L,编号1~9)、壳聚糖(0.10、0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00 μg/L,编号1~9)和硝普钠(0.01、0.05、0.10、0.50、1.00、1.50、2.00、2.50、3.00 μg/L,编号1~9),考察不同质量浓度诱导子对悬浮培养体系中水飞蓟宾量的影响,以未添加任何诱导子的悬浮培养体系作为对照,结果见图 5。
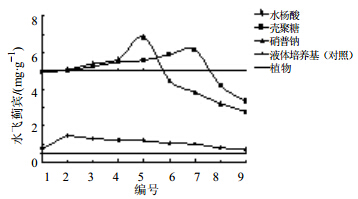 | 图 5 不同诱导子对悬浮培养细胞中水飞蓟宾量的影响Fig. 5 Effects of different elicitors on silybin contents in suspension cells |
如图 5所示,其中液体培养基中水飞蓟宾质量浓度是指不添加任何诱导子、无组别之分培养的细胞以此作为对照。水杨酸的添加,不但不能够促进细胞的生长同时还影响水飞蓟宾的产生和富集,水飞蓟宾的量远远低于正常悬浮培养细胞中的水飞蓟宾量。添加壳聚糖和硝普钠在一定质量浓度下则能够促进细胞中水飞蓟宾的产生和富集。壳聚糖的浓度为3.00 μg/L时,水飞蓟宾的量达到0.616%,硝普钠的质量浓度为1.00 μg/L时,水飞蓟宾的量为0.686%。分别为正常悬浮培养的1.23和1.37倍。
3 讨论固体培养基中选择6-BA 1.0 mg/L+NAA 1.0 mg/L+ZT 1.5 mg/L的比例,细胞长势良好,增长量达8.62 g,悬浮培养基中选择6-BA 1.5 mg/L+NAA 1.0 mg/L+ZT 1.5 mg/L的比例,增加质量达9.28 g。当植物细胞在悬浮培养基中生长时,既有团状细胞又有单细胞,能够保持良好的分散状态,培养过程需要较高浓度的6-BA促进其细胞分裂;此外,通过悬浮培养改善培养基中氧气的供应,营养物质充足,生长迅速,适合大批量增殖。
不同种类的培养基中含有的无机元素差异较大,对植物细胞生长和次生代谢产物的形成必然会有较大的影响。B5培养基的主要特点是含有较低的铵,因为铵可能对某些培养物的生长具有抑制作用。N6培养基特别适合于禾谷类植物的花药和花粉培养,在国内外得到广泛应用。White培养基由于无机盐的数量比较低,可能更适合木本植物的组织培养。MS培养基含有较高浓度的硝酸盐、钾和铵,无机养分的数量和比例较适宜,足以满足植物细胞在营养上和生理上的需求。实验发现,水飞蓟悬浮细胞在MS悬浮培养基中的生长比B5、N6、White培养基增长量高2~5倍。
3种诱导子对水飞蓟宾量的影响存在较大的差异,植物本身中的水飞蓟宾量较低,只有462.03 μg/g,液体培养基中水飞蓟宾量明显高于植物本身,达到5 009.79 μg/g,3种诱导子中,硝普钠最适宜提高水飞蓟悬浮细胞的增长量及水飞蓟宾量的积累,积累量达到6 861.11 μg/g,约是植物本身的15倍,液体培养基的1.36倍,硝普钠作为NO的供体被广泛应用,其参与植物的气孔运动,呼吸作用,种子萌发,根、茎、叶的生长发育,植物组织细胞的成熟衰老以及对生物与非生物环境胁迫的应答反应。NO可以保护细胞中H2O2的积累,提高细胞内H2O2水平,从而对次生代谢产物的积累产生影响。其次为壳聚糖,积累量达到6 157.73 μg/g,是液体培养基的1.23倍,壳聚糖诱导子与植物细胞结合后,引起质膜的去极化与离子流的变化,使得细胞质内呈酸性,细胞间呈碱性,碱性是激活细胞的防御系统以及酶活性所必需的条件;过氧化物酶可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。与此同时,次生代谢的信号分子也会促使H2O2量的升高,最终刺激植物防御基因的表达,诱导特定次生代谢产物的生成和积累。水杨酸明显不适宜水飞蓟悬浮细胞生长及次生代谢产物的积累,由于水杨酸改变了培养基的pH值,可能引起细胞膜的电荷变化,影响细胞对营养物质的吸收,因此不适宜水飞蓟悬浮培养。
本研究建立了快速繁殖的水飞蓟悬浮培养体系,测定3种诱导子对水飞蓟宾量的影响,为大批量悬浮培养水飞蓟及水飞蓟宾获得提供理论依据。
| [1] | 南京中医药大学. 中药大辞典 (上册) [M]. 上海: 上海科学技术出版社, 2006. |
| [2] | 王红军, 姜媛媛. 水飞蓟宾的抗肿瘤、抗氧化和免疫调节分子药理学机制研究进展 [J]. 药学学报, 2010, 45(4): 413-421. |
| [3] | 朱 弦, 郑哲洙, 崔京浩. 水飞蓟素制剂及其研究进展 [J]. 中国野生植物资源, 2001, 20(3): 47-49. |
| [4] | 丁乐成, 顾长海. 水飞蓟药理学效应研究进展 [J]. 中国医院药学杂志, 2001, 22(2): 28-29. |
| [5] | 杜昱光, 白雪芳, 虞星炬, 等. 寡聚糖类物质生理活性的研究 [J]. 中国生化药物杂志, 1997, 18(5): 268-270. |
| [6] | 黄丽萍, 刘宋明, 姚 波. 甲壳素和壳聚糖在农业中的应用 [J]. 天然产物研究与开发, 1999, 11(5): 60-64. |
| [7] | 袁向华, 蔡 妙, 郭祀远, 等. 低壳聚糖的制备与应用 [J]. 生命化学, 2001, 21(2): 165-167. |
| [8] | 周丽丽, 詹亚光, 刘孚婧, 等. 水杨酸对白蜡属种间杂交子代悬浮细胞中香豆素类量的影响 [J]. 中国农学通报, 2012, 28(34): 63-69. |
| [9] | 王康宇, 杜 研, 张美萍, 等. 诱导子协同对黄芪愈伤组织生理生化指标的影响 [J]. 安徽农业科学, 2010, 38(14): 7309-7311. |
| [10] | 樊洪泓, 李廷春, 李正鹏, 等. 强光胁迫下外源NO对霍山石斛叶绿素荧光和抗氧化系统的影响 [J]. 园艺学报, 2008, 35(8): 1215-1220. |
| [11] | Giba Z, Grubsic D, Todorovc S, et al. Effect of nitricoxide- releasing compounds on phytochrome-controlled germination of empress tree seeds [J]. Plant Growth Reg, 1998, 26: 175 -181. |
| [12] | 任小林, 张少颖, 于建娜. 一氧化氮与植物成熟衰老的关系 [J]. 西北植物学报, 2004, 24(1):167-171. |
| [13] | 付 瑜. 水飞蓟的愈伤组织培养 [D]. 长春: 吉林农业大学, 2012. |
| [14] | 马英姿, 许 欢, 王志毅, 等. 凹叶厚朴愈伤组织诱导及其有效成分量变化研究 [J]. 中草药, 2014, 45(4): 546-551. |
| [15] | 中国药典 [S]. 一部. 2010. |
| [16] | Fujita Y, Hara Y, Suga C, et al. Production of shikonin derivatives by cell suspension cultures of Lithospermum erythrorhizon [J]. Plant Cell Rep, 1981(1): 61-63. |
| [17] | 王 莉, 管江红. 长鞭红景天细胞悬浮培养体系优化研究 [J]. 中草药, 2012, 43(11): 2772-2278. |
| [18] | 张绪成, 上官周平, 高世铭. NO对植物生长发育的调控机制 [J]. 西北植物学报, 2005, 25(4): 812-818. |
 2015, Vol. 46
2015, Vol. 46



