2. 温州医科大学信息与工程学院, 浙江 温州 325035;
3. 温州医科大学附属第六医院, 浙江 丽水 323000;
4. 温州医科大学药学院, 浙江 温州 325035
2. College of Information and Engineering, Wenzhou Medical University, Wenzhou 325035, China;
3. The Sixth Affiliated Hospital of Wenzhou Medical University, Lishui 323000, China;
4. College of Pharmacy, Wenzhou Medical University, Wenzhou 325035, China
胃癌是世界上第二大癌症死因,我国的胃癌发病率和死亡率均是世界平均水平两倍多,是最高的国家之一[1, 2]。目前临床治疗胃癌的方法主要包括手术治疗、化学治疗、放射治疗等[3, 4, 5, 6, 7]。常用的化疗
试剂,如烷化剂、氮芥和代谢拮抗剂能有效地抑制肿瘤的生长[8, 9, 10],但是不同的化疗药物对于胃癌的作用机制各不相同。
长春新碱是从长春花中提取的很重要的二聚吲哚类生物碱,具有很强的抗癌效果。近年来发现,长春新碱对宫颈癌[11]、肺癌[12]、结肠癌[13]、乳腺癌[14]等均有一定的抑制生长及诱导调亡的作用,但目前针对长春新碱是否能影响人胃癌细胞增殖与凋亡的研究较少。本研究首先用不同质量浓度的长春新碱对人胃癌BGC细胞处理不同时间后,通过MTS法检测药物对BGC细胞增殖的影响;通过Hoechst、流式细胞技术检测不同质量浓度长春新碱对细胞周期及凋亡的影响;采用Western blotting技术检测不同浓度长春新碱处理后BGC细胞中增殖、周期以及凋亡相关蛋白的表达情况。通过人胃癌裸鼠动物模型,研究长春新碱体内对胃癌生长抑制能力。以此初步阐明长春新碱影响胃癌细胞增殖及凋亡进程的调节机制,为长春新碱用于胃癌的临床治疗提供理论依据。
1 材料和方法 1.1 实验对象人胃癌细胞系BGC购于中国典型培养物保藏委员科学院细胞库,Balb/c-nu裸鼠(6周龄)购于上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2012-0002。
1.2 试剂和仪器注射用硫酸长春新碱(批号130602)购于浙江海正药业股份有限公司;DMEM培养基、胎牛血清(FBS)、0.05% Trypsin-EDTA均购于Invitrogen公司,MTS细胞增殖分析试剂购于Promega公司,流式细胞仪及细胞周期检测试剂均购于BD公司,蛋白抗体购于Cell Signaling Technolgy公司,硝酸纤维素膜购于GE公司,Hoechst 试剂购于碧云天生物技术有限公司;SpectraMax M5酶标仪购于Molecular Devices公司,Axiovent 40C倒置显微镜和Axiovent 200荧光显微镜均购于Carl Zeiss。
1.3 实验方法 1.3.1 细胞培养人胃癌细胞系BGC细胞采用含10% FBS的DMEM培养液,置37 ℃、5% CO2培养箱中培养,细胞接近融合时用胰蛋白酶消化传代,同时接种细胞进行实验。
1.3.2 细胞形态学观察将对数生长期的BGC细胞接种到96孔板中,8×103/孔,每个实验组有6个复孔,24 h后细胞长至60%左右,用生理盐水将长春新碱稀释不同质量浓度(0.5、1、5、10、50、100 μg/μL)进行加药,空白对照组不加生理盐水和药物,阴性对照组加相同体积的生理盐水,加药24 h后将细胞置于显微镜下观察细胞形态。
1.3.3 细胞增殖实验将对数生长期的BGC细胞接种到96孔板中,8×103/孔,每个实验组有6个复孔,24 h后细胞长至60%左右,质量浓度、加药方式同“1.3.2”项,加药24、48、72 h后将细胞培养液换成无血清培养液100 μL/孔,加入20 μL MTS混合液[PMS-MTS(1∶20)],37 ℃孵育1 h后,用酶标仪在490 nm波长下读取吸光度(A)值,计算细胞生长抑制率。
细胞生长抑制率=(阴性对照组A值-实验组A值)/阴性对照组A值
1.3.4 Hoechst荧光染色观察药物诱导细胞凋亡情况将贴壁细胞以2×104/孔接种到48孔板中,37 ℃、5% CO2孵箱中培养24 h后细胞长至60%左右进行加药,质量浓度、加药方式同“1.3.2”项;加药24 h后,用4%多聚甲醛固定细胞20 min;去固定液,用PBS洗2遍,每次3 min,吸尽液体,PBS清洗后,加Hoechst染色液,室温染色10 min后吸尽染液;用PBS洗2遍,每次3 min;清洗后每孔加入适量的荧光淬灭剂,在荧光倒置显微镜下观察并拍照。
1.3.5 流式细胞仪检测细胞周期及凋亡将对数生长期的BGC细胞接种到6孔板中,24 h后加药,质量浓度、加药方式同“1.3.2”项,加药24 h后收集细胞,70%乙醇4 ℃固定过夜,碘化丙啶(PI)4 ℃避光染色30 min,400目滤布滤过,流式细胞仪检测细胞周期分布,每样品获取30 000个细胞,Modfit软件分析细胞周期各时期以及凋亡细胞的百分率。
1.3.6 Westernblotting检测细胞内相关蛋白的表达情况 将BGC细胞接种到6孔板中,24 h后加药,加药质量浓度为0.5、5、50 μg/μL,阴性对照组和空白对照组同“1.3.2”项,加药24 h后收集细胞,用RIPA裂解液提取各实验组细胞的总蛋白,蛋白溶液与上样缓冲液混合后进行10% SDS-PAGE电泳,将电泳分离后的蛋白转移至硝酸纤维素膜上,用5%脱脂奶粉-PBST封闭液室温封闭3 h,用1∶800稀释的一抗混合液4 ℃孵育过夜,用1∶2 000稀释的HRP标记的二抗混合液室温孵育2 h,最后在暗室进行化学发光和显影。
1.3.7 体内肿瘤生成实验将裸鼠饲养在严格的SPF级环境中,将人胃癌BGC细胞接种至6周龄雌性裸鼠的背部脊柱右侧,每侧注射细胞6×106个,待肿瘤体积达到100 mm3时,将符合要求的裸鼠12只随机分成2组,每组6只,给药组隔天相同时间尾iv给药,给药3次,给药剂量为0.8 mg/kg[15],阴性对照组给相同体积生理盐水,分别于给药后第3、6、9、12、15、17天用游标卡尺测量肿瘤长径与短径,计算肿瘤体积[V=(长径×短径2)/2],并观察裸鼠的生存状况。给药17 d后处死。
1.3.8 统计方法所有数据均采用SPSS 10.0统计软件处理。实验数据以x ±s表示,组间比较采用单因素方差分析(one-way ANOVA)进行统计学分析。
2 结果 2.1 长春新碱对BGC细胞形态的影响不同质量浓度长春新碱(0.5、1、5、10、50、100 μg/μL)处理BGC细胞24 h后,显微镜下观察发现,空白对照组和阴性对照组细胞贴壁良好,形态规则饱满,随着加药浓度增加,细胞变圆,变亮,悬浮细胞增多,细胞数也逐渐减少(图 1)。
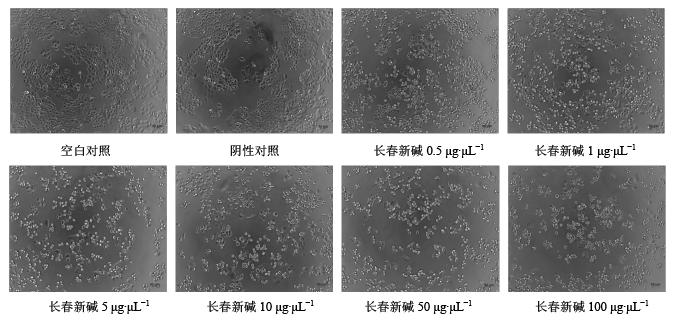 | 图 1 不同质量浓度长春新碱对BGC细胞形态的影响Fig. 1 Effect of vincristine at different concentration on cellular morphology of BGC cells |
与阴性对照组相比,不同质量浓度长春新碱(0.5、1、5、10、50、100 μg/μL)处理BGC细胞24、48、72 h后,细胞增殖受到明显抑制(P<0.01),其抑制作用具有剂量和时间相关性(图 2),且随着作用时间的增加,细胞抑制率不断的增加。结果表明,长春新碱对BGC细胞增殖具有明显的抑制效果,并呈现时间和剂量的相关性。
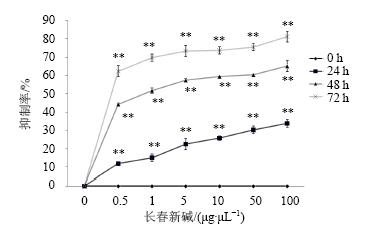 | 与阴性对照组比较:**P<0.01**P< 0.01 vs negative control group图 2 MTS法检测不同质量浓度长春新碱处理不同时间后BGC细胞增殖情况 (x ±s , n = 6)Fig. 2 MTS determination of BGC cell proliferation treated by vincristine at different concentration in different times (x ±s , n = 6) |
将不同质量浓度长春新碱(0.5、1、5、10、50、100 μg/μL)处理BGC细胞24 h后,通过Hoechst染色实验结果显示(图 3),随着长春新碱质量浓度的增加,BGC细胞呈逐步减少的趋势,且变化具有统计学意义(P<0.05),在质量浓度大于0.5 μg/μL时细胞减少量较明显。Hoechst染色后,活细胞核呈弥散均匀荧光,而细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒块状荧光。从图 3可以看出,随着长春新碱浓度的不断增加,凋亡细胞数不断增加。
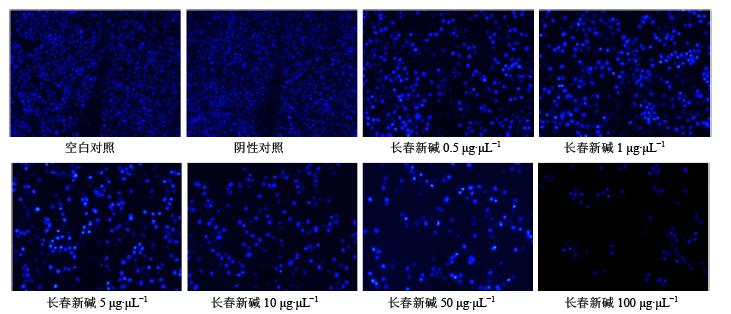 | 图 3 Hoechst荧光染色观察长春新碱诱导细胞凋亡情况Fig. 3 Hoechst fluorescence staining assay on apoptosis induced by vincristine |
流式细胞仪检测结果显示(图 4),与空白对照组和阴性对照组相比,经不同质量浓度长春新碱(0.5、1、5、10、50、100 μg/μL)处理24 h后,细胞周期明显被阻滞在G1期,并且随着药物质量浓度的增加细胞凋亡也明显增加。
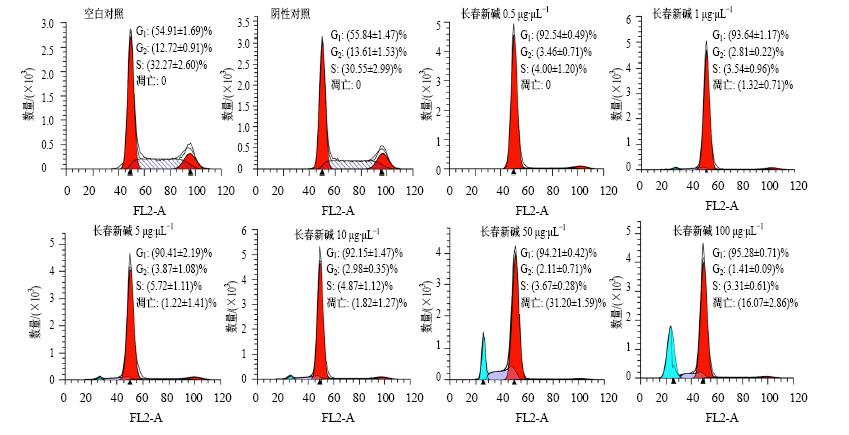 | 图 4 不同质量浓度长春新碱处理后BGC细胞周期及凋亡情况Fig. 4 Effect of vincristine at different concentration on cell cycle and apoptosis of BGC cells |
Western blotting结果显示,随着长春新碱质量浓度的增加,Caspase-3被激活而发生裂解生成的活性片段增加,细胞增殖以及周期相关蛋白p-FAK、FAK、E2F1、CylinE2、CyclinD2、CDK2、CDK6的表达量也下调(图 5)。长春新碱是通过激活细胞内凋亡蛋白Caspase-3的活化,抑制增殖蛋白p-FAK、FAK的表达来抑制BGC细胞的增殖,同时通过抑制细胞周期相关蛋白E2F1、CylinE2、CyclinD2、CDK2、CDK6的表达来抑制BGC细胞的增殖。
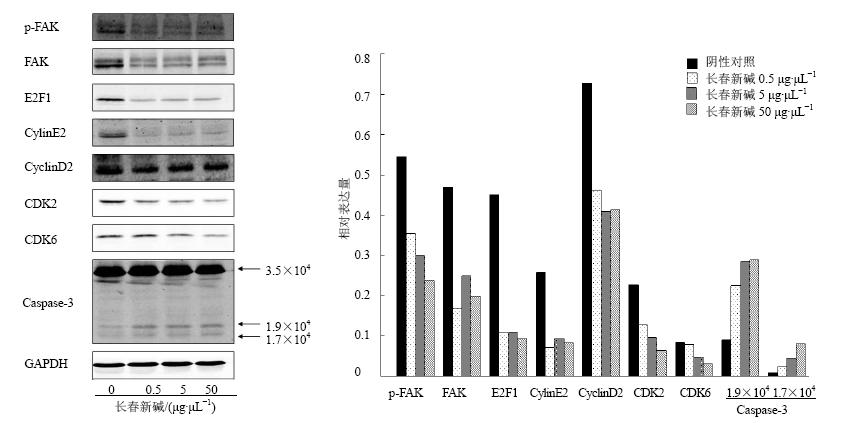 | 图 5 不同浓度长春新碱处理24 h后BGC细胞内蛋白表达情况及半定量分析 (x ±s , n = 6)Fig. 5 Protein expression and semi-quantitative analysis of BGC cells after 24 h treatment by vincristine at different concentration (x ±s , n = 6) |
结果显示,长春新碱能有效抑制肿瘤的生长,肿瘤体积与阴性对照组比较差异显著(P<0.05、0.01),见图 6。
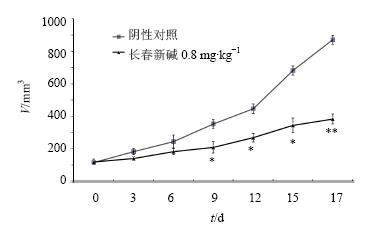 | 与阴性对照组比较:*P<0.05 **P<0.01*P < 0.05 **P < 0.01 vs negative control group图 6 长春新碱对BGC荷瘤裸鼠肿瘤体积的影响 (x ±s , n = 6)Fig. 6 Effect of vincristine on volume of tumors in BGC-bearing nude mice(x ±s , n = 6) |
胃癌是世界上第二大癌症死因,是威胁人类健康最常见的恶性肿瘤之一。化疗在胃癌综合治疗中占据着重要地位,长春新碱在化疗药物中属于常用药物,但是长春新碱对人胃癌BGC细胞的相关报道比较少。长春新碱是作用于细胞周期的一种特异性药物,通常在S期能通过与微管蛋白结合,阻断细胞周期,进而抑制肿瘤细胞的增殖[16, 17]。长春新碱在其他方面也有显著的作用,如其可以影响细胞核酸或蛋白质代谢功能进而抑制细胞增殖诱导多种恶性肿瘤细胞发生凋亡。
本研究发现人胃癌细胞BGC在不同质量浓度长春新碱作用后,细胞形态发生了明显变化,细胞变圆、变亮,悬浮细胞增多,贴壁细胞数也逐渐减少,给药浓度越高,效果就越明显。从细胞形态观察,长春新碱具有抑制BGC细胞增殖、促进其凋亡的作用。
通过MTS法检测不同质量浓度长春新碱处理不同时间后BGC细胞的增殖情况发现,0.5 μg/μL的长春新碱处理BGC细胞48 h后,细胞生长抑制率就达到44%,且随着长春新碱给药浓度的增加,处理时间的延长,细胞生长抑制率逐渐升高。该实验结果显示,长春新碱能显著抑制BGC细胞的增殖,且抑制效果呈剂量和时间相关性。通过Hoechst 染色实验结果显示,不同质量浓度长春新碱处理BGC细胞24 h后,细胞出现明显的凋亡现象,随着药物质量浓度的升高,凋亡细胞也明显增加。通过流式细胞技术检测发现,长春新碱将BGC细胞周期阻滞在G1期,且阻滞效果显著,不过低质量浓度和高质量浓度的长春新碱对细胞的周期的阻滞效果没有出现剂量相关性。同时该检测结果显示,高质量浓度的长春新碱可以促进细胞凋亡的发生,该结果与Hoechst染色实验结果显示一致。
为了进一步研究长春新碱抑制BGC细胞增殖、促进其凋亡的作用机制,本实验收集了0.5、5、50 μg/μL长春新碱处理24 h后的BGC细胞,检测了细胞增殖、周期、凋亡相关蛋白的表达情况。
FAK是一种非受体型酪氨酸蛋白激酶,它在许多肿瘤中表达上调,且通过多条信号通路参与细胞增殖、迁移和凋亡等生物学过程,在肿瘤的发生发展过程中发挥重要作用。本研究发现长春新碱处理后,BGC细胞中的FAK及p-FAK的表达明显下调。
细胞的增殖与细胞周期进程密切相关,细胞周期是指亲代细胞分裂结束到子代细胞分裂结束所经历的过程,由G1、S、G2和M期组成(G1、S和G2期又合称为分裂间期)[18]。细胞周期时间的长短主要由G1期决定。根据流式细胞仪结果显示长春新碱能使BGC细胞大部分滞留在G1期,这可能是使BGC细胞增殖受到抑制的原因之一。本实验检测了与G1期进程密切相关蛋白的表达情况,发现E2F1、CylinE2、CyclinD2、CDK2、CDK6[19, 20, 21, 22]在长春新碱处理后的BGC细胞中表达出现不同程度的下调。
细胞相关的凋亡蛋白Caspases是一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,Caspase-3是细胞凋亡过程中最主要的终末剪切酶,在细胞凋亡中起着不可替代的作用[23, 24]。正常情况下,胞质中的Caspase-3以无活性的酶原形式存在,当细胞发生凋亡时,它将被激活切割形成有活性的Caspase-3。Western blotting结果显示,长春新碱是通过激活细胞内凋亡蛋白Caspase-3,从而促进细胞凋亡。
通过建立人胃癌细胞BGC的裸鼠模型,在体内研究长春新碱抑制荷瘤裸鼠肿瘤情况,结果发现0.8 mg/kg的长春新碱能显著抑制肿瘤的生长。
综上所述,长春新碱抑制人胃癌细胞BGC增殖、促进细胞凋亡的可能分子机制为通过下调FAK及p-FAK的表达抑制细胞的增殖,促进细胞的凋亡;同时长春新碱还抑制与G1期进程密切相关蛋白E2F1、CylinE2、CyclinD2、CDK2、CDK6的表达量,使大量细胞的细胞周期滞留在G1期,从而抑制了细胞增殖的进程;而且长春新碱激活了细胞内凋亡蛋白Caspase-3,从而加速了细胞凋亡的进程。阐明长春新碱在胃癌细胞增殖与凋亡过程中的调控机制,有助于为该疾病在临床上治疗提供理论依据。
| [1] | Bang Y J, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial [J]. Lancet, 2010, 376(9742): 687-697. |
| [2] | 邹小农, 孙喜斌, 陈万青, 等. 2003—2007年中国胃癌发病与死亡情况分析 [J]. 肿瘤, 2012, 32(12): 109-114. |
| [3] | Fulda S, Galluzzi L, Kroemer G. Targeting mitochondria for cancer therapy [J]. Nat Rev Drug Discov, 2010, 9(6): 447-464. |
| [4] | Dhar S, Kolishetti N, Lippard S J, et al. Targeted delivery of a cisplatin prodrug for safer and more effective prostate cancer therapy in vivo [J]. Proc Natl Acad Sci USA, 2011, 108(5): 1850-1855. |
| [5] | Moore T A, Berger A M, Dizona P. Sleep aid use during and following breast cancer adjuvant chemotherapy [J]. Psycho-Oncol, 2011, 20(3): 321-325. |
| [6] | Rejinold N S, Muthunarayanan M, Chennazhi K P, et al. Curcumin loaded fibrinogen nanoparticles for cancer drug delivery [J]. J Biomed Nanotechnol, 2011, 7(4): 521-534. |
| [7] | Zhang G, Zeng X, Li P. Nanomaterials in cancer-therapy drug delivery system [J]. J Biomed Nanotechnol, 2013, 9(5): 741-750. |
| [8] | Cho K, Wang X, Nie S, et al. Therapeutic nanoparticles for drug delivery in cancer [J]. Clin Cancer Res, 2008, 14(5): 1310-1316. |
| [9] | Vinogradov S, Wei X. Cancer stem cells and drug resistance: The potential of nanomedicine [J]. Nanomedicine, 2010,7(4): 597-615. |
| [10] | Kohanski M A, DePristo M A, Collins J J. Sublethal antibiotic treatment leads to multidrug resistance via radical-induced mutagenesis [J]. Mol Cell, 2010, 37(3): 311-320. |
| [11] | Fu J H, Gao Z, Ren C C, et al. Comparison of clinical efficacy of three different neoadjuvant approaches (chemotherapy combined vaginal intracavitary irradiation, neoadjuvant chemotherapy alone or radiotherapy) combined with surgery for patients with stage Ib2 and IIa2 cervical cancer [J]. Asian Pac J Cancer Prev, 2013, 14(4): 2377-2381. |
| [12] | Von Pawel J, Schiller J H, Shepherd F A, et al. Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer [J]. J Clin Oncol, 1999, 17(2): 658-667. |
| [13] | Moon J W, Lee S K, Lee J O, et al. Demethylation of RUNX3 by vincristine in colorectal adenocarcinoma cells [J]. Anticancer Res, 2014, 34(1): 133-140. |
| [14] | Esmaeili-Mahani S, Falahi F, Yaghoobi M M. Proapoptotic and antiproliferative effects of Thymus caramanicus on human breast cancer cell line (MCF-7) and its interaction with anticancer drug vincristine [J]. Evid Based Complement Alternat Med, 2014, doi: 10.1155/2014/893247. |
| [15] | 卢 懿. 抗恶性淋巴瘤中药成分长春新碱透皮靶向给药系统及其转运机理的研究 [D]. 成都: 四川大学, 2006. |
| [16] | Novotny N M, Markel T A, Crisostomo P R, et al. Differential IL-6 and VEGF secretion in adult and neonatal mesenchymal stem cells: role of NF-κB [J]. Cytokine, 2008, 43(2): 215-219. |
| [17] | Lecland N, Lüders J. The dynamics of microtubule minus ends in the human mitotic spindle [J]. Nat Cell Biol, 2014, 16(8): 770-778. |
| [18] | Viallard J F, Lacombe F, Belloc F, et al. Molecular mechanisms controlling the cell cycle: fundamental aspects and implications for oncology [J]. Cancer Radiother, 2001, 5(2): 109-129. |
| [19] | Boxem M, van den Heuvel S. Lin-35 Rb and cki-1 Cip/Kip cooperate in developmental regulation of G1 progression in C. elegans [J]. Development, 2001, 128(21): 4349-4359. |
| [20] | Van den Heuvel S. Cell-cycle regulation [J]. Worm Book, 2005, 21: 1-16. |
| [21] | Nishida N, Fukuda Y. Tumor suppressor RB gene and its related molecules in hepatocellular carcinoma [J]. Nihon Rinsho, 2001, 59(S6): 134-137. |
| [22] | Vermeulen K, Van Bockstaele D R, Berneman Z N. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer [J]. Cell Prolif, 2003, 36(3): 131-149. |
| [23] | Barrezueta L F, Oshima C T, Lima F O, et al. The intrinsic apoptotic signaling pathway in gastric adenocarcinomas of Brazilian patients: Immuno- expression of the Bcl-2 family (Bcl-2, Bcl-x, Bak, Bax, Bad) determined by tissue microarray analysis [J]. Mol Med Report, 2010, 3(2): 261-267. |
| [24] | Xu J D, Cao X X, Long Z W, et al. BCL-2 L10 protein regulates apoptosis / proliferation through differential pathways in gastric cancer cells [J]. J Pathol, 2011, 223(3): 400-409. |
 2015, Vol. 46
2015, Vol. 46


