2. 中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室, 云南 昆明 650201
2. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China
盆架树Winchia calophylla A. DC. 属夹竹桃科(Apocynaceae)盆架树属Winchia A. DC. 植物,分布于中国、印度、缅甸、越南和印度尼西亚等地,在我国主要分布于云南和海南。该植物有止咳、平喘和祛痰的功效,西双版纳民间用其治疗慢性气管炎,亦用于治疗外伤[1, 2]。研究表明,盆架树中主要含有三萜、单萜及其苷类等非生物碱成分[3, 4, 5, 6, 7]和单萜吲哚生物碱成分[8, 9, 10, 11, 12],其中单萜吲哚生物碱为其特征成分,主要具有抗支气管扩张活性[10]及抗肿瘤活性[11]等。本课题组曾对采自云南西双版纳的盆架树树皮的生物碱成分及其抗肿瘤活性进行过研究,发现其中部分生物碱成分具有抑制肿瘤细胞增殖作用[12]。在此基础上,为了得到更多结构新颖的单萜吲哚生物碱成分并研究其抗肿瘤活性,本实验对盆架树树皮的生物碱成分进行了进一步研究,分离鉴定出一个新单萜吲哚生物碱,命名为盆架树碱B,其对肺癌(A549)、乳腺癌(MCF-7)、前列腺癌(PC-3)、神经胶质瘤(U87MG)、多发性骨髓瘤(U266、MM1.S、MM1.R)等7种人体肿瘤细胞的增殖无明显抑制作用。
1 仪器与材料X-6精密显微熔点测定仪(北京华业寰宇化工有限公司);Perkin-Elmer 341旋光仪(美国PerkinElmer公司);Perkin-Elmer Spectrum One FT-IR红外光谱仪(美国PerkinElmer公司);Perkin-Elmer Lambda 35 UV/VIS紫外分光光度计(美国PerkinElmer公司);Bruker MicrO TOF QII质谱仪(德国Bruker公司);Bruker Avance 600核磁共振仪(瑞士Bruker公司);Xcalibur E X射线单晶衍射仪(英国Oxford公司);BioTek SynergyTM 2酶标仪(美国BioTek公司);AxioCam ERc 5s显微镜(德国Zeiss公司);CO2培养箱(上海齐欣科学仪器有限公司)。柱色谱硅胶(200~300目)和薄层色谱硅胶板(GF254,100 mm×5 mm)均由青岛海洋化工厂生产;Sephadex LH-20为Amersham Biosciences公司产品;DMEM、RPMI 1640 培养基、胎牛血清均为美国Hyclone 公司生产;胰蛋白酶由美国Gibco公司生产;MTT试剂、DMF、DMSO和阿霉素为美国Sigma公司生产;肺肿瘤细胞A549,乳腺肿瘤细胞MCF-7,前列腺肿瘤细胞PC-3,神经胶质瘤细胞U87MG,多发性骨髓瘤细胞U266、MM1.S、MM1.R均来源于美国ATCC公司。其他试剂均为分析纯或色谱纯。
盆架树Winchia calophylla A. DC. 树皮采自云南西双版纳勐腊县,由中国科学院成都生物研究所彭玉兰副研究员鉴定。
2 提取与分离干燥盆架树树皮(1.4 kg)粉碎,室温下用5 L 95%乙醇浸提3次,每次7 d,减压蒸馏回收乙醇得到浸膏,将浸膏溶于1 mol/L稀盐酸水溶液,调至pH值为3,用2 L醋酸乙酯萃取3次,再用氢氧化钠调pH值为10,用2 L氯仿萃取4次,得总生物碱39 g。将总生物碱部分经硅胶柱色谱分离,氯仿-甲醇(20∶1→1∶1)梯度洗脱,薄层色谱检测,合并组成相似的流分得到9个部分Fr. 1~9。其中Fr. 4(0.2 g)经Sephadex LH-20色谱(氯仿-甲醇1∶1)分离纯化,再经硅胶柱色谱(醋酸乙酯-甲醇8∶1),得到化合物1(8 mg)。
3 结构鉴定化合物1:无色针晶(甲醇),mp 165.9~168.7 ℃;碘化铋钾试剂显橙红色。[α]20D −50° (c 0.001, MeOH);UV光谱在205、236、293 nm显示特征的二氢吲哚环吸收峰;IR光谱中3 322和3 221 cm−1为多个羟基的伸缩振动吸收峰;1 732 cm−1是羰基伸缩振动吸收峰。HR-ESI-MS m/z: 399.228 3 [M-Cl]+(计算值399.227 8,C23H31N2</ sub>O4),推断相对分子质量为434,分子式为C23H31N2O4Cl。1H-NMR (600 MHz, CD3OD) 和13C-NMR (150 MHz, CD3OD) 数据(表 1)显示二氢吲哚片断的特征信号δH 7.84 (1H, d, J = 7.7 Hz, H-9), 6.81 (1H, dd, J = 7.4, 7.8 Hz, H-10), 7.13 (1H, dd, J = 7.4, 7.0 Hz, H-11), 6.78 (1H, d, J = 7. 9 Hz, H-12);δC 147.3 (C-13), 129.7 (C-8), 129.0 (C-11), 126.9 (C-9), 120.1 (C-10), 110.7 (C-12)。上述信息提示化合物1可能是单萜吲哚生物碱类化合物。由于化合物1和echitaminic acid[13]具有非常相似的核磁数据,说明化合物1是echitamine型吲哚生物碱。进一步比较两者数据,发现化合物1比echitaminic acid多了1个甲基碳 (δC 13.1) 和1个连氧亚甲基碳 (δC 61.4),其他碳的化学位移相差不大。在1H-NMR谱中,化合物1比echitaminic acid多了2组氢,分别为δH4.34 (m), 4.28 (m) 和δH1.36 (3H, t, J = 7.1 Hz),由此推测化合物1比echitaminic acid多了1个乙氧基。HMBC谱中,不但-OCH2CH3的甲基氢 (δH 1.36) 与连氧亚甲基碳 (δC 61.4) 相关,而且-OCH2CH3的连氧亚甲基氢 (δH 4.34, 4.28) 与C-22 (δC 172.3) 相关(图 1),说明该乙氧基与羰基碳相连,同时,N-CH3 (δH 3.39) 与C-2 (δC 100.2), C-21 (δC 65.8), C-5 (δC 62.6) 相关,H-14 (δH 2.71, 1.66) 与C-20 (δC 132.2) 相关,H-18 (δH 1.88) 与C-20 (δC 132.2) 相关,H-17 (δH 3.97, 3.31) 与C-22 (δC 172.3) 相关,也进一步证实了化合物1比echitaminic acid多1个乙氧基。
| 表 1 化合物1与echitaminic acid的1H-NMR (600/400 Hz, CD3OD) 和13C-NMR (150/100 Hz, CD3OD) 数据 Table 1 1H-NMR (600/400 Hz, CD3OD) and 13C-NMR (150/100 Hz, CD3OD) data of compound 1 and echitaminic acid |
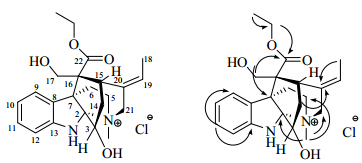 | 图 1 化合物1的结构与重要HMBC相关Fig. 1 Structure and key HMBC correlations of compound 1 |
另外,X-射线单晶衍射实验证明该化合物属于离子型单萜吲哚生物碱,结合质谱及提取过程中使用的试剂和溶剂,通过最后精修,确认主分子附近1个很重的Q峰为氯离子,另2个离主分子稍远的较重Q峰分别为氧和碳(甲醇分子)。因此,化合物1的结构最终鉴定为ethyl echitaminate chloride,命名为盆架树碱 B(图 1)。由于提取过程使用了乙醇和盐酸,所以该化合物有可能是人工产物。但是,该离子型生物碱的分离和鉴定提示按通常的生物碱提取分离流程得到的生物碱可能是游离态的,也可能是离子态,而游离态与不同的离子态的波谱数据是有差别的[14, 15]。因此,在报道生物碱结构时,除了提供常规的波谱数据外,最好能够给出X-射线单晶衍射分析结果,以进一步确定生物碱的真实状态,从而为后续研究提供较全面科学的参考。
化合物1的X-射线单晶衍射分析(单晶编号:CCDC 1020844):无色方晶(甲醇),X-衍射实验用晶体大小为0.25 mm×0.20 mm×0.15 mm,属斜方晶系,晶胞参数:a=1.087 1(3) nm,b=1.429 1(3) nm,c=1.492 3(5) nm,α=90.00°,β=90.00°,γ=90.00°,晶胞体积:V=2.318 4(11) nm3,T=293(2)K,空间群为P212121,晶胞内分子数Z=4,吸收系数 μ(MoKα)=0.203 mm−1,可观察点为13 350个,独立衍射点为4 733(Rint=0.024 2)。经计算与绝对构型相关的Flack系数为−0.02(9),表明分子的绝对构型可以被确定[16]。化合物1的X-射线单晶衍射分析结构见图 2。
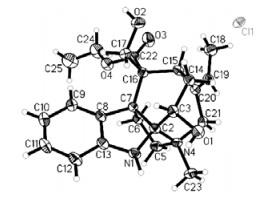 | 图 2 化合物1的X-射线单晶衍射图Fig. 2 Single-crystal X-ray diffractogram of compound 1 |
采用MTT方法[17]检测化合物1对7种人体肿瘤细胞(肺肿瘤A549,乳腺肿瘤MCF-7,前列腺肿瘤PC-3,神经胶质瘤U87MG,多发性骨髓瘤U266、MM1.S、MM1.R)增殖的抑制作用。将上述肿瘤细胞于96孔板中培养,细胞密度为40~60个/mL,放入孵箱培养12 h(5% CO2,37 ℃),使细胞在加药前贴壁并保持活性。以阿霉素为阳性对照,分别用5、10、20、50 μmol/L的化合物1处理细胞,每个浓度设3个复孔。加药处理48 h后,每孔加入20 μL MTT试剂,于37 ℃孵育4 h后,用20% SDS-50% DMF裂解细胞,再用酶标仪于570 nm检测吸光度(A)值,最后用Graphed Prism软件计算化合物1的半数抑制浓度(IC50)。结果显示化合物1对各肿瘤细胞的IC50均>50 μmol/L,提示其对上述肿瘤细胞增殖无明显抑制作用。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1977. |
| [2] | 西双版纳傣族州民族医药调研办. 西双版纳傣药志 (第3卷) [M]. 西双版纳: 西双版纳傣族州卫生局, 1980. |
| [3] | 朱伟明, 李顺林, 赵 庆, 等. 药用植物盆架树中的缩醛 [J]. 云南植物研究, 2007, 29(6): 708-712. |
| [4] | Zhu W M, Lu C H, Wang Y, et al. Monoterpenoids and their glycosides from Winchia calophylla [J]. J Asia Nat Prod Res, 2004, 6(3): 193-198. |
| [5] | Zhu W M, Wang B G, Kang W Y, et al. Two new monoterpene diglycosides from Winchia calophylla A. DC. [J]. Chin Chem Lett, 2003, 14(10): 1029-1032. |
| [6] | Zhu W M, Shen Y M, Hong X, et al. Triterpenoids from the Dai medicinal plant Winchia calophylla [J]. Acta Bot Sin, 2002, 44(3): 354-358. |
| [7] | 朱伟明, 何红平, 王跃虎, 等. 药用植物盆架树中的马钱子苷及其衍生物 [J]. 云南植物研究, 2004, 26(6): 683-686. |
| [8] | Chen W M, Zhang P L, Rucker G. Nb-Demethyl- echitamine N-oxide from roots of Winchia calophylla [J]. Planta Med, 1988, 54(5): 480-481. |
| [9] | 郭 峰, 郁建平, 张 于, 等. 盆架树中单萜吲哚生物碱成分的分离与结构鉴定 [J]. 天然产物研究与开发, 2014, 26(3): 361-363. |
| [10] | Zhu W M, He H P, Fan L M, et al. Components of stem barks of Winchia calophylla A. DC. and their bronchodilator activities [J]. J Integr Plant Biol, 2005, 47(7): 892-896. |
| [11] | Gan L S, Yang S P, Wu Y, et al. Terpenoid indole alkaloids from Winchia calophylla [J]. J Nat Prod, 2006, 69(1): 18-22. |
| [12] | Li L M, Yang T, Liu J, et al. Calophyline A, a new rearranged monoterpenoid indole alkaloid from Winchia calophylla [J]. Org Lett, 2012, 14(13): 3450-3453. |
| [13] | Salim A A, Garson M J, Craik D J. New indole alkaloids from the bark of Alstonia scholaris [J]. J Nat Prod, 2004, 67(9): 1591-1594. |
| [14] | 宁永成. 有机化合物结构鉴定与有机波谱学 [M]. 第2版. 北京: 科学出版社, 2000. |
| [15] | 荣国斌. 波谱数据表——有机化合物的结构解析 [M]. 上海: 华东理工大学出版社, 2002. |
| [16] | Flack H D. On enantiomorph-polarity estimation [J]. Acta Cryst, 1983, A39(6): 876-881. |
| [17] | Alley M C, Scudiero D A, Monks A, et al. Feasibility of drug screening with oanels of human tumor cell lines using a microculture tetrazolium assay [J]. Cancer Res, 1988, 48(3): 589-601. |
 2015, Vol. 46
2015, Vol. 46


