作为许多中药的主要活性成分——绿原酸是由咖啡酸与奎尼酸形成的缩酚酸,属于苯丙素类化合物中的多酚类化合物[1]。绿原酸在从植物提取过程中,往往通过水解和分子内酯基迁移而发生异构化[2]。
绿原酸具有广泛的生物活性:(1)可调节糖代谢及改善脂质、脂蛋白和酶参与的脂质代谢[3];还可以通过改变营养物质如脂肪、糖、氨基酸的代谢来降低胆固醇水平[4]。(2)具有抗氧化活性,能够阻止单氯胺导致的DNA断裂损伤;还可以与过氧自由基快速反应,起到清除自由基的作用[5];可升高紫外线照射后,ESF-1细胞中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性、基质金属蛋白酶抑制因子1(TIMP-1)mRNA的表达量、TIMP-1的量,以及降低丙二醛(MDA)的量[6]。(3)具有抗菌活性,表现为对革兰氏阳性菌如肺炎链球菌和革兰氏阴性菌如大肠杆菌的抑制作用[5,7]。(4)还具有利胆、保肝、降压、兴奋中枢神经系统等作用[5]。
在众多的绿原酸类物质中,常见的有3-O-咖啡酰奎尼酸、4-O-咖啡酰奎尼酸、5-O-咖啡酰奎尼酸,均可在植物中分离得到,其中5-O-咖啡酰奎尼酸 (5-CQA)是饮食和中药中广泛分布的绿原酸类物质,植物来源广泛,主要存在于忍冬科忍冬属、菊科蒿属及杜仲科杜仲属植物中[8,9]。
一个成年人身上的微生物总量约为1kg,其数量超过1×1014个,而人体自身的细胞数只有1×1013个,也就是说大概有90%的细胞是属于微生物的,只有10%是属于人类的[10,11]。人体胃肠道内种类繁多的微生物——肠道菌群构成了一个巨大而复杂的生态系统,可被比作肠道中的微生物器官[11]。这个微观世界为机体提供重要的生物和代谢功能,是人体宏观代谢所不能描绘出来的[10]。它一方面在肠内壁形成保护膜,抵御外来病原体的入侵;另一方面还有助于生物活性成分的转化[12]。绿原酸是一种有机弱酸,在低酸度溶液中其电离过程被抑制,主要以分子形式存在[13],口服不易吸收,但可在肠道菌群作用下部分水解,发生一系列反应形成小分子物质后被吸收入血发挥其药理作用[9,14]。研究肠道菌群对绿原酸的代谢规律有助于了解其在体内的整个代谢过程,并阐明绿原酸发挥药效的物质基础及其生物效应。
1 绿原酸在机体内的肠道菌群代谢绿原酸的体内代谢主要取决于肠道微生物的组成和活性,依次经过加氢、脱羟基及酯水解等作用降解,在不同个体中降解顺序有所不同[15],但形成的代谢产物基本相同。人体肠道不同部位对绿原酸的代谢不同,使之降解产物及其吸收也有所差异。
1.1 胃和小肠对绿原酸的代谢吸收作用绿原酸在胃和小肠中吸收较少。Stalmach等[16]研究表明,口服200 mL(含绿原酸类物质385 μmol)的速溶咖啡后,在回肠液中检测到71%的绿原酸类原型物质和葡糖苷酸化或硫酸化的代谢物,说明有29%的绿原酸类物质被小肠吸收,与Olthof等[17]的研究口服1 000 mg(2.8 mmol)5-CQA后在回肠液中检测到67% 5-CQA原型结果一致。这两个研究尽管口服绿原酸物质的量不同,但结果都是食物中约1/3的绿原酸被小肠消化吸收进入血液循环,胃对此可能也有些许贡献[16]。小肠中的糖苷酶和酯酶[18]可使绿原酸的酯键断裂释放奎尼酸和咖啡酸,而β-葡糖苷酶起到水解作用,此酶存在于肠道黏膜刷状缘[19]。之后咖啡酸部分被肠道吸收,未被吸收的一部分发生甲基化反应生成阿魏酸和异阿魏酸(此步既可在肝脏发生,也可由肠道菌群作用完成[20]),咖啡酸和阿魏酸及异阿魏酸均可发生磺酰化和葡糖苷酸化反应[21,22]。小肠的空肠段含有葡糖醛酸基转移酶,使得绿原酸在小肠中大多(约96.5%)以葡糖苷酸化形式吸收[23]。
1.2 大肠对绿原酸的吸收代谢作用大肠尤其结肠是肠道中富含菌群的部位,肠道菌群能够转化植物化学成分,比如水解苷类、葡萄糖苷酸类、硫酸盐、氨基酸和酯类;它还可以实现还原、环裂解、脱甲基和脱羟基反应;最后使之产生与原型化合物生物活性不同的代谢物[19]。绿原酸口服后约70%通过胃、小肠到达大肠[15,16,22],结肠对其代谢和吸收起关键作用[19]。
大肠对5-CQA主要有以下几种代谢途径(图 1):(1)进入大肠的5-CQA在微生物如大肠杆菌、双歧杆菌和加氏乳杆菌产生的酯酶的作用下发生水解形成咖啡酸和奎尼酸[24],还会发生酯基位置异构形成3-咖啡酰奎尼酸(3-CQA)和4-咖啡酰奎尼酸(4-CQA)[9,22]。(2)咖啡酸在肠道内未发生降解[24],未被肠道吸收的部分发生甲基化生成阿魏酸和异阿魏酸。咖啡酸可经肠道微生物作用脱羟基形成间香豆酸[25,26],也可经还原酶(RA)发生氢化作用生成二氢咖啡酸[22]。二氢咖啡酸会发生C-4位脱羟基作用生成3-(3′-羟苯基)丙酸,或经辅酶A(CoA)介导脱去一个亚甲基形成3,4-二羟基苯乙酸。3,4-二羟基苯乙酸迅速脱亚甲基转化为3,4-二羟基苯甲酸,因此一般无法检测到;它还可以脱C-4位羟基形成3-羟基苯乙酸。随后3,4-二羟基苯甲酸会脱羧转化为儿茶素,脱C-4位羟基形成3-羟基苯甲酸。3-(3′-羟苯基)丙酸也可以脱一个亚甲基形成3-羟基苯乙酸,进一步脱去亚甲基生成微量的3-羟基苯甲酸[27]。(3)5-CQA可以经体内的儿茶酚-O-甲基转移酶(COMT)作用发生甲基化反应形成5-阿魏酰奎尼酸(5-FQA),进而降解生成阿魏酸和奎尼酸。阿魏酸氢化还原形成3-(3′-甲氧基-4′-羟苯基)丙酸,之后脱甲氧基形成3-(4′-羟苯基)丙酸[22]。3-(4′-羟苯基)丙酸一次脱亚甲基可形成4-羟基苯乙酸,再次脱去一个亚甲基可得到微量的4-羟基苯甲酸[27]。(4)5-CQA和5-FQA水解形成的奎尼酸在肠道菌群作用下发生芳构化反应形成苯甲酸[28],此步骤是形成苯甲酸的主要步骤;3-(4′-羟苯基)丙酸和3-(3′-羟苯基)丙酸继续脱羟基均得到3-苯基丙酸,此产物又会脱去一个碳形成3-苯乙酸,进一步脱亚甲基形成苯甲酸[27]。苯甲酸可以在机体肝脏和肾脏内与甘氨酸结合形成马尿酸,而注射或者肠道菌群受抑制的状态下则不发生此类细菌芳构化反应[28],这 是形成马尿酸的主要途径,而其他的代谢物则来源于咖啡酸的细菌还原化反应[25,29]。
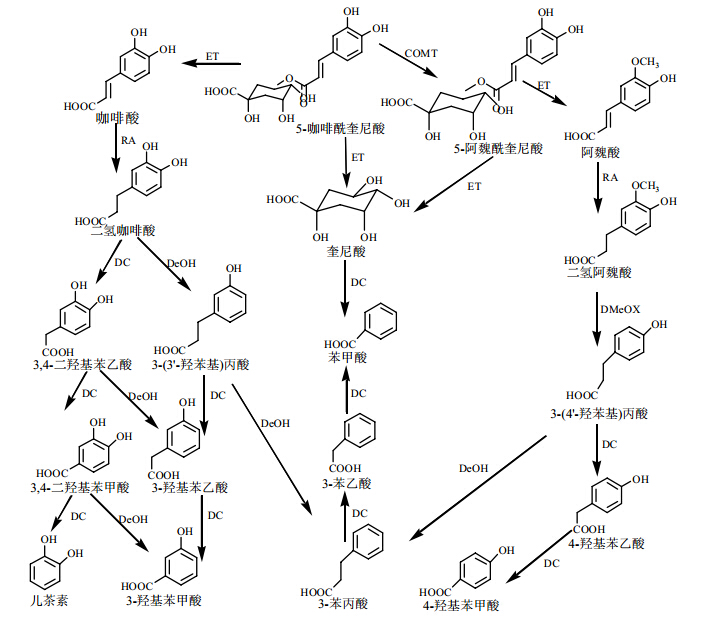 |
图 1 5-CQA 在肠道内的代谢降解过程Fig.1 Metabolic degradation process of 5-CQA in intestine
COMT-儿茶酚-O-甲基转移酶 ET-酯酶 RA-还原酶 DeOH-脱羟基 DMeOX-脱甲氧基 DC-脱甲基或脱羧
COMT-catechol-O-methyltransferase ET-esterase RA-reductase DeOH-dehydroxylation DMeOX-demethoxy DC-demethylation or decarboxylation |
综上所述,绿原酸的体内过程:绿原酸进入体内后,少量以原型在胃和小肠吸收,然后在肠黏膜的酯酶和肠道菌群的作用下水解为咖啡酸、阿魏酸;大部分进入结肠后,经过广泛代谢。绿原酸饮食后在尿液中主要检测到咖啡酸及其甲基化产物(阿魏酸和异阿魏酸)、间香豆酸、3,4-二羟基苯丙酸、3-羟基苯丙酸、3-羟基苯甲酸及马尿酸,其中阿魏酸、间香豆酸、3-羟基苯甲酸和马尿酸也可以在大鼠的血浆中观察到[22]。给大鼠ig绿原酸2 h后,咖啡酸和绿原酸的磺酰结合物及葡萄糖苷酸结合物在血浆中的浓度达到最大值,之后开始下降,咖啡酸和阿魏酸显示较高的浓度,咖啡酸的葡萄糖苷酸化形式是血浆中的主要代谢物,占了此时所有代谢物总量的41%[30]。二氢咖啡酸和二氢阿魏酸是血浆和尿液中的主要代谢物[27],之后随着时间的增加尿液中更小相对分子质量的产物马尿酸的累积量增加,仅次于3-羟基苯丙酸和间香豆酸[25]。
绿原酸的代谢物在人血浆和尿液中主要以磺酰化和葡萄糖苷酸化的形式存在,阿魏酸、二氢阿魏酸、磺酰化的咖啡酸、二氢咖啡酸、阿魏酸和二氢阿魏酸都存在于血浆和尿液中,而阿魏酰甘氨酸和葡萄糖苷酸化的咖啡酸可以在尿液中检测到,在血浆中则检测不到[22,31]。人口服绿原酸后,血浆中检测到3-CQA、4-CQA、5-CQA和其他原型物质以及少量的咖啡酸,有的机体中还会出现4-阿魏酰奎尼酸和5-FQA。由此得知,绿原酸原型主要分布于血浆中[21]。也有文献指出,口服给药后,血浆中主要存在咖啡酸等绿原酸的代谢物和极少原型化合物[32],但是少量绿原酸原型及其代谢物都可由肾脏排泄。
2 绿原酸与肠道菌群体外孵育的降解过程通过离体实验方法研究肠道菌群对绿原酸的转化作用可进一步探明其代谢产物。Gonthier等[29]通过粪便提取物体外发酵模式研究了绿原酸的代谢,HPLC-ESI-MS-MS检测到了2种主要的代谢产物,分别为3-羟基苯丙酸和苯甲酸,后者又可经微生物的脱羟基作用形成3-羟基苯丙酸,并进一步代谢为苯甲酸或3-羟基苯甲酸。Plumb等[26]通过小肠上皮组织在体外与绿原酸共培养,并HPLC检测其代谢产物,发现绿原酸可被代谢为3,4-二羟基肉桂酸、3,4-二羟基苯甲酸等物质。
Ludwig等[27]将一定量的咖啡粉末与分别来自3名志愿者的粪便在体外共同孵育6 h,于孵育0、1、2、3、4和6 h时间点取6 mL粪便悬液,采用HPLC-PDA-MSn和GC-MS技术分别对其中的绿原酸类物质和它们的代谢产物进行定性与定量分析。结果显示,首先是绿原酸类物质水解生成咖啡酸、阿魏酸和奎尼酸,约1 h后这3种代谢物的浓度达到最大并随之开始减小,咖啡酸氢化还原形成二氢咖啡酸,阿魏酸形成二氢阿魏酸,在6 h时它们占代谢产物总量的比例仍然很大;2 h后,二氢咖啡酸发生C-4位脱羟基作用,二氢阿魏酸、3,4-二羟基苯乙酸、3-(3′-羟苯基)丙酸等代谢物继续生成更小相对分子质量的物质,只是有的代谢产物会很快转化为下一级物质,导致其被检测到的量很小甚至检测不到,如苯甲酸的羟基化物质;最后一些小分子代谢物累积量较大,如3-苯基丙酸、苯甲酸。分析数据显示人体肠道菌尤其富含菌群的结肠能够使二氢咖啡酸、二氢阿魏酸及3-(3′-羟苯基)丙酸等发生脱甲基、脱羟基和脱羰基反应,从而也很大程度影响了绿原酸的生物利用度。
根据体外研究结果,绿原酸与粪便孵育时不存在代谢产物的葡萄糖苷酸化和磺酰化,这种结合方式主要发生在体内[22,31]。绿原酸在体外的代谢过程类似于体内转化,代谢产物主要有咖啡酸、阿魏酸、异阿魏酸、奎尼酸、二氢咖啡酸、二氢阿魏酸、苯乙酸及其羟基化物质、苯甲酸及其羟基化物质、香豆酸和儿茶素等。绿原酸的体外肠道菌群代谢产物与体内研究所得出的结果一致,这进一步验证了绿原酸在体内的肠道代谢情况。
3 结语随着中药体内过程研究的发展,对中药有效成分的代谢机制研究越发重要。分析测定技术的发展,提高了分析效率和检测灵敏度,为代谢产物的分析提供了有力的技术保障。本文首次针对单一中药成分绿原酸的肠道菌群代谢研究进展进行了综述,探讨其在肠道中的代谢规律,阐明了其在肠道中的代谢过程。绿原酸在人体肠道中规律地变化,在肠道菌群的作用下最终生成一些芳香类小分子物质如苯甲酸及其羟基化物、儿茶素、间香豆酸等,其体内、体外研究均得到相似的最终代谢产物。绿原酸的肠道代谢研究为更深入地研究绿原酸体内活性及其临床应用提供参考。
| [1] | 高锦明, 张鞍灵, 赵晓明, 等. 绿原酸分布、提取与生物活性研究[J]. 西北林学院学报, 1999, 14(2): 73-82. |
| [2] | 邓 良, 袁 华, 喻宗沅. 绿原酸的研究进展[J]. 化学与生物工程, 2005, 22(7): 4-6. |
| [3] | Meng S X, Cao J M, Feng Q, et al. Roles of chlorogenic acid on regulating glucose and lipids metabolism: A review[J]. Evid-Based Compl Alt Med, 2013, doi.org/ 10.1155/2013/801457. |
| [4] | Ruan Z, Yang Y H, Zhou Y, et al. Metabolomic analysis of amino acid and energy metabolism in rats supplemented with chlorogenic acid[J]. Amino Acids, 2014, 46(9): 2219-2229. |
| [5] | 张星海, 王岳飞. 茶多酚与绿原酸生物活性的比较研究[J]. 茶叶科学, 2007, 27(1): 39-44. |
| [6] | 王业秋, 陈巧云, 李建民, 等. 绿原酸对光老化ESF-1细胞ERK信号通路的调控研究[J]. 中草药, 2014, 45(3): 386-391. |
| [7] | Lou Z X, Wang H X, Zhu S, et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. Food Sci, 2011, 76(6): 398-403. |
| [8] | Xie C, Zhong D F, Chen X Y. Identification of the ortho-benzoquinone intermediate of 5-O-caffeoylquinic acid in vitro and in vivo: comparison of bioactivation under normal and pathological situations[J]. Drug Metab Dispos, 2012, 40(8): 1628-1640. |
| [9] | 谢 岑, 钟大放, 陈笑艳. 鉴定大鼠注射绿原酸后体内的代谢产物[J]. 药学学报, 2011, 46(1): 88-95. |
| [10] | Cani P D, Delzenne N M. The gut microbiome as therapeutic target[J]. Pharm Ther, 2011, 130(2): 202-212. |
| [11] | Jia W, Li H K, Zhao L P, et al. Gut microbiota: a potential new territory for drug targeting[J]. Nat Rev Drug Discov, 2008, 7(2): 123-131. |
| [12] | Wong J M W. Gut microbiota and cardiometabolic outcomes: influence of dietary patterns and their associated components[J]. Am J Clin Nutr, 2014, 100(1): 369-377. |
| [13] | 屈景年, 莫运春, 刘梦琴, 等. 金银花中绿原酸一步提取法及绿原酸抗菌活性[J]. 化学世界, 2005, 46(3): 167-169. |
| [14] | Park E K, Shin J, Bae E A, et al. Intestinal bacteria activate estrogenic effect of main constituents puerarin and daidzin of Pueraria thunbergiana[J]. Biol Pharm Bull, 2006, 29(12): 2432-2435. |
| [15] | Francisco T B, Roc G V, Andrea Q, et al. In vitro transformation of chlorogenic acid by human gut microbiota[J]. Mol Nutr Food Res, 2014, 58(5): 1122-1131. |
| [16] | Stalmach A, Steiling H, Williamson G, et al. Bioavailability of chlorogenic acids following acute ingestion of coffee by humans with an ileostomy[J]. Arch Biochem Biophys, 2010, 501(1): 98-105. |
| [17] | Olthof M R, Hollman P C H, Katan M B. Chlorogenic acid and caffeic acid are absorbed in humans[J]. Nutrients, 2001, 131(1): 66-71. |
| [18] | Aleksandra D C. The inhibitory effect of polyphenols on human gut microbiota[J]. J Phys Pharm, 2012, 63(5): 497-503. |
| [19] | Johanna W L, Chang J L. Interindividual differences in phytochemical metabolism and disposition[J]. Semin Cancer Biol, 2007, 17(5): 347-353. |
| [20] | Andreas R R, Jeremy P E S, Gunter K, et al. Novel biomarkers of the metabolism of caffeic acid derivatives in vivo[J]. Free Radic Biol Med, 2001, 30(11): 1213-1222. |
| [21] | Monteiro M, Farah A, Perrone D, et al. Chlorogenic acid compounds from coffee are differentially absorbed and metabolized in humans[J]. J Nutr, 2007, 137(10): 2196-2201. |
| [22] | Rio D D, Stalmach A, Calani L, et al. Bioavailability of coffee chlorogenic acids and green tea flavan-3-ols[J]. Nutrients, 2010, 2(8): 820-833. |
| [23] | Jeremy P E S, George C, Ruksana C, et al. The small intestine can both absorb and glucuronidate luminal flavonoids[J]. FEBS Lett, 1999, 458(2): 224-230. |
| [24] | Couteau D, McCartneyl A L, Gibson1 G R, et al. Isolation and characterization of human colonic bacteria able to hydrolyse chlorogenic acid[J]. J Appl Microbiol, 2001, 90(6): 873-881. |
| [25] | Gonthier M P, Verny M A, Besson C, et al. Chlorogenic acid bioavailability largely depends on its metabolism by the gut microflora in rats[J]. Nutr Metab, 2003, 133(6): 1853-1859. |
| [26] | Plumb G W, Kroon P A, Rhodes M, et al. Metabolism of chlorogenic acid by human plasma, liver, intestine and gut microflora[J]. J Sci Food Agric, 1999, 79(3): 390-392. |
| [27] | Ludwig A I, Pena M P, Cid C, et al. Catabolism of coffee chlorogenic acids by human colonic microbiota[J]. Bio Factors, 2013, 39(6): 623-632. |
| [28] | Adamson R H, Bridges J W, Evans M E, et al. Species differences in the aromatization of quinic acid in vivo and the role of gut bacteria[J]. Biochem J, 1970, 116(3): 433-437. |
| [29] | Gonthier M P, Remesy C, Scalbert A, et al. Microbial metabolism of caffeic acid and its esters chlorogenic and caftaric acids by human faecal microbiota in vitro[J]. Biomed Pharmacother, 2006, 60(9): 536-540. |
| [30] | Keiko A, Katsunari I, Masayoshi N, et al. Absorption of chlorogenic acid and caffeic acid in rats after oral administration[J]. Agric Food Chem, 2000, 48(11): 5496-5500. |
| [31] | Stalmach A, Mullen W, Barron D, et al. Metabolite profiling of hydroxycinnamate derivatives in plasma and urine after the ingestion of coffee by humans: identification of biomarkers of coffee consumption[J]. Drug Metab Dispos, 2009, 37(8): 1749-1758. |
| [32] | Wittemer S M, Ploch M, Windeck T, et al. Bioavailability and pharmacokinetics of caffeoylquinic acids and flavonoids after oral administration of artichoke leaf extracts in humans[J]. Phytomedicine, 2005, 12(1/2): 28-38. |
 2015, Vol. 46
2015, Vol. 46


