二氢杨梅素(dihydromyricelin,DMY或DHM)又称蛇葡萄素(ampelopsin,AMP)、白蔹素(ampelopsin)、双氢杨梅树皮素、双氢杨梅素、福建茶素等,是一种二氢黄酮醇类黄酮化合物,1940年,首先从蛇葡萄属植物楝叶玉葡萄Ampelopsis meliaefolia (Hand. -Mazz.) W. T. Wang的叶中分离得到[1]。二氢杨梅素广泛存在于蛇葡萄科蛇葡萄属植物中,在藤茶中的量可以达到30%[2],也存在于杨梅科、杜鹃科、藤黄科、大戟科、橄榄科、豆科、山榄科及柳科等植物中。既往研究证实二氢杨梅素具有抗氧化、抗肿瘤、抗炎、解酒保肝、抗病原微生物及调血脂等多方面的药理作用。此外,二氢杨梅素还具有抗高血压、抑制体内血栓形成、降血糖等生物活性。通过查阅国内外文献,本文对10余年来二氢杨梅素药理作用的研究进展进行综述,为进一步开发、利用和研究二氢杨梅素提供参考。
1 理化性质二氢杨梅素化学名称为 (2R,3R)-3,5,7-三羟基- 2-(3,4,5-三羟基苯基)苯并二氢吡喃-4-酮,分子式为C15H12O8,相对分子质量为320.25;为白色针状结晶,熔点为245~246 ℃。常温和冷水中溶解度较低,易溶于甲醇、乙醇及丙酮,极微溶于醋酸乙酯,难溶于氯仿、石油醚。结构见图 1。
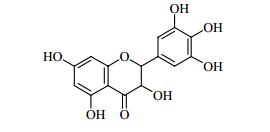 | 图 1 二氢杨梅素结构Fig.1 Structure of dihydromyricelin |
药物的药理作用与其化学结构特征密切相关。二氢杨梅素可发生氧化反应、脱氢反应、酯化反应,还可与金属离子发生络合反应。实验研究证实,二氢杨梅素的抗氧化活性中心是位于其分子结构B环上的3′、4′、5′位连酚羟基结构,A环上的3个OH虽具有一定的抗氧化作用,但是抗氧化作用相对较弱[3, 4, 5]。金属离子可与二氢杨梅素分子中的酸性酚羟基和成络基团羰基发生络合反应,提高二氢杨梅素的抗氧化能力[6]。另外,通过对3′、4′、5′位酚羟基和3、5、7位的羟基进行酯化、酰基化、糖苷化等结构修饰,来提高二氢杨梅素的水溶性和脂溶性,或增强二氢杨梅素的药理活性,也是二氢杨梅素研究的热点方向之一。
2 药理作用 2.1 抗肿瘤二氢杨梅素能够抑制肝癌细胞、乳腺癌细胞、前列腺癌细胞和膀胱癌细胞的增殖,促进多种肿瘤细胞凋亡,作用机制与诱导肿瘤细胞的凋亡、阻滞肿瘤细胞的细胞周期、诱导肿瘤细胞自噬以及抑制肿瘤细胞的侵袭等多种途径相关。
2.1.1 抑制肿瘤细胞增殖肿瘤的主要特征之一就是能够无限增殖,即具有永生化特性,二氢杨梅素可以通过细胞毒直接发挥抗肿瘤作用。在裸鼠移植瘤模型中,连续21 d给药能明显抑制肿瘤的体积,延缓裸鼠移植瘤的生长;MTT分析结果显示,在12、24和48 h,二氢杨梅素对人肝癌细胞HepG2的IC50分别为140、127和55 μmol/L[7];不同浓度的二氢杨梅素能够浓度和时间依赖性地抑制人肝癌细胞株Bel-7402增殖,其机制可能与下调Bcl-2表达、上调Bax表达和活化caspase3相关[8]。
嵌入剂是抗肿瘤药物中作用于DNA的药物的一种[9]。紫外-可见光谱、荧光光谱、红外光谱、热重分析等结果显示,二氢杨梅素-Mn(II)的复合物能够嵌入DNA双螺旋结构,结合常数为5.64×104 M,Stern-Volmer猝灭常数为1.16,表明该复合物能够与DNA牢固地结合,这在某种程度上能够解释二氢杨梅素的抗癌作用机制,也能在一定程度上为二氢杨梅素其他药理作用机制研究提供依据[10]。
2.1.2 诱导肿瘤细胞凋亡细胞凋亡指细胞在发育的一定阶段出现的程序性死亡,是多细胞生物的一种重要的自稳机制。各种因素导致的细胞凋亡的调节紊乱是肿瘤形成及发展的重要原因,诱导细胞凋亡是抗肿瘤的一种有效策略。目前认为细胞凋亡信号转导通路主要包括3种:内源性途径(又称线粒体途径)、外源性途径(又称死亡受体途径)和内质网途径。细胞凋亡受到多种凋亡抑制基因和凋亡促进基因如caspase家族、Bcl-2、p53、C-myc等的调节。
在凋亡过程中,各种死亡信号诱导线粒体膜通透性改变孔(PTpore)开放,导致线粒体跨膜电位下降,细胞色素C从线粒体释放入胞浆,与Apaf1、ATP/dATP形成凋亡体,凋亡体活化caspase-9前体,使其自我剪切活化并启动caspase级联反应,激活下游的caspase-3和caspase-7,完成其相应底物的剪切,促进细胞凋亡。文献报道,二氢杨梅素对人乳腺癌细胞MDA-MB-231具有促凋亡作用,随二氢杨梅素浓度增加,胞内钙离子浓度逐渐增加,线粒体跨膜电位逐渐减少,二氢杨梅素浓度依赖性地活化MDA-MB-231细胞内caspase-3和caspase-9,引起细胞凋亡,凋亡作用很可能与影响线粒体途径有关[11]。TUNEL实验结果显示二氢杨梅素可以诱发肺腺癌细胞AGZY-83-a凋亡,通过升高胞内钙离子浓度,增强caspase-3活性来发挥抗肿瘤作用[12]。
作为一种关键的癌症抑制基因,p53能够增加细胞对凋亡刺激的敏感性。研究发现,二氢杨梅素能够抑制HepG2细胞的生长,明显增强p53的表达,有效降低Bcl-2的表达,进而诱导肿瘤细胞凋亡,该作用呈时间和剂量依赖性[13]。另有文献报道,二氢杨梅素对肝癌细胞具有抑制作用,呈现时间和剂量依赖性,而对正常肝细胞HL7702和L02细胞的活力无明显影响;在作用12 h后检测发现,p53的表达量升高,该作用可能与p53介导的凋亡信号通路的激活有关[7]。
线粒体产生大量活性氧(ROS),使通透性转换孔开放,引起线粒体跨膜电位降低,导致细胞色素C等凋亡因子释放到细胞质中,激活caspase,引起细胞凋亡。二氢杨梅素可剂量依赖性地引起乳腺癌细胞MCF-7和MDA-MB-231产生ROS,上调乳腺癌细胞GRP78中p-PERK、p-elF2α的表达,从而激活内质网应激,而ROS清除剂scavenger能够减少ROS的产生;二氢杨梅素能够抑制人乳腺癌细胞MCF-7和MDA-MB-231的增殖,并诱导其凋亡,但对人正常乳腺细胞不产生细胞毒作用。这种作用和ROS的产生以及内质网应激通路密切相关[14]。
2.1.3 阻滞细胞周期细胞周期的有序运转受到细胞周期蛋白(cylin)、周期蛋白激酶(CDK)等的严密调控。肿瘤的发生发展与细胞周期调控密切相关。二氢杨梅素能够通过影响相关蛋白如cyclinA、cyclinB1、Cdk1、P53、Cdc25c、p-Cdc25c Chk1和Chk使HepG2细胞阻滞于G2/M期,该作用可被Chk2 si RNA阻断,而p53和Chk1基因敲除的HepG2细胞并不能引起细胞周期阻滞于G2/M期[15]。二氢杨梅素能使人前列腺癌细胞PC3阻滞于S期,剂量依赖性地抑制细胞增殖[16]。
2.1.4 诱导细胞自噬与凋亡(I型程序性死亡)不同,自噬性细胞死亡被称为II型程序性死亡。自噬是指一些需要降解的蛋白质和细胞器等胞浆成分被包裹,并最终运送至溶酶体降解的过程,是真核细胞维持细胞稳态、实现更新的重要机制[17]。大量的细胞自噬会引起细胞死亡。近来研究发现,二氢杨梅素可通过诱导细胞自噬进而抑制HepG2细胞的增殖。二氢杨梅素可诱导HepG2细胞产生明显的自噬体特征,透射电镜可观察到包含有降解的细胞内容物的自噬溶酶体结构。基于自噬体标记蛋白的检测发现,在二氢杨梅素作用后,微管相关蛋白1轻链3(LC3)大量弥散形成点状结构。进一步的研究显示,二氢杨梅素能够剂量和时间依赖性地促进LC3-II和自噬基因Beclin-1的表达,抑制mTOR的活性,这些作用可能与对细胞外调解蛋白激酶(ERK)1/2、腺苷酸活化蛋白激酶(AMPK)和PI3K/PDK-1/Akt通路的调节有关[18]。
2.1.5 抑制肿瘤侵袭转移癌细胞的侵袭和转移是恶性肿瘤的基本特征,也是癌症患者死亡的重要原因之一。基质金属蛋白酶(MMP)可降解细胞外基质蛋白,与肿瘤细胞的侵袭能力密切相关。二氢杨梅素能够剂量依赖性地抑制乳腺癌MDA-MB-231细胞的MMP-2/9转录和蛋白表达水平,抑制MDA-MB-231细胞的侵袭[19]。另外,二氢杨梅素能够通过诱导与bcl-2有关的细胞凋亡来抑制雄激素非依赖型人类乳腺癌细胞PC-3的增殖,但对于正常的前列腺癌细胞的活性没有影响;也能够通过下调趋化因子受体4(CXCR4)的表达抑制PC-3细胞的迁移和入侵。二氢杨梅素的体外抗增殖和抗迁移活性可能与其对前列腺癌细胞诱导凋亡作用有关,也与减少前列腺肿瘤血管生成,减少CXCR4的表达有关[20]。
2.1.6 逆转肿瘤细胞多药耐药肿瘤对化疗药物产生耐药性是影响化疗效果的主要问题之一,二氢杨梅素对逆转肿瘤细胞多药耐药具有较好的效果。研究发现,二氢杨梅素能够浓度依赖性地抑制细胞P-糖蛋白(P-gp)的表达,减少阿霉素的外排,增加其在细胞内的浓度进而增强对耐药细胞的细胞毒作用,最终使得人白血病多药耐药细胞株K562/ADR对阿霉素的耐药作用得以逆转[21]。
2.1.7 抗癌辅助作用二氢杨梅素还能够发挥抗癌辅助作用。谷胱甘肽-S-转移酶(GST)在人多种肿瘤组织中过量表达[22],而二氢杨梅素能对小鼠肝脏GST活性产生明显抑制作用,且抑制作用随浓度增加而增强,因而具有潜在的辅助抗癌药用价值[23]。
2.2 抗氧化自由基在生物体中有很高的活性,结构不稳定,能够与邻近的蛋白质、脂质、碳水化合物以及核酸发生反应。产生的氧化应激涉及到众多的疾病,如高血压、动脉粥样硬化和糖尿病等,也参与衰老过程[24]。二氢杨梅素具有较强的抗氧化活性,这与其诸多药理作用相关,也是其作为一种安全、无残留的食品添加剂而应用于畜牧业的基础。
自Kambara于2000年首次报道二氢杨梅素的抗氧化活性起,越来越多的研究证实了二氢杨梅素具有清除自由基、修复氧化应激相关损伤的作用。目前抗氧化活性的评价方法主要有化学测定法和细胞抗氧化评价法[25],化学测定法包括以脂质过氧化为基础的测定、以清除自由基为基础的测定、对抗氧化酶活性的影响测定等。
2.2.1 清除自由基通常采用测定清除自由基的能力来评价抗氧化剂的抗氧化活性。二氢杨梅素对稳定自由基DPPH的清除率高达73.3%~91.5%[26]。另报道,二氢杨梅素清除DPPH的IC50为5.4 mmol/L,且B环发挥主要的抗氧化活性。电子自旋共振(ESR)和自旋捕集技术测定结果显示,二氢杨梅素清除和抑制超氧阴离子、羟自由基和DPPH自由基的IC50分别为7.4、297.8和12.4 μg/mL,表明二氢杨梅素对超氧自由基具有更强的清除作用[27]。
2.2.2 抗脂质过氧化氧自由基反应和脂质过氧化的动态平衡发生紊乱时,就会形成氧自由基连锁反应,损害生物膜及其功能。二氢杨梅素对FeSO4-依他酸引发亚油酸过氧化产物的抑制效果等同或优于特丁基对苯二酚(TBHQ),机制为通过络合Fe2+,阻止由Fe2+引发的亚油酸过氧化[26]。差示扫描量热法分析结果显示二氢杨梅素的抗氧化活性优于人工合成的抗氧化剂如Irganox 1010,这与其分子中羟基的数量和位置有关[28]。
丙二醛(MDA)为机体内自由基作用于脂质发生过氧化反应的氧化终产物,具有细胞毒性。二氢杨梅素能较强地抑制Fe2+-维生素C体系、Fe2+-过氧化氢体系、Fe2+-半胱氨酸体系诱导的心、肝、脑、组织匀浆及线粒体MDA的生成,作用呈现明显的量效关系,且对肝脏的保护作用更强[29]。
2.2.3 增强抗氧化酶活性机体内清除自由基的酶系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化物酶(GSH-Px)等。先于H2O2加入二氢杨梅素能够明显减少MDA的产生,保护细胞DNA免于氧化损伤,但不影响SOD和GSH-Px的活性,说明二氢杨梅素能够保护猪肾上皮细胞系PK-15免于H2O2诱导的脂质过氧化损伤[30]。
2.3 抗炎藤茶在民间作为治疗咽喉肿痛的保健茶而广为应用,近年来其主要活性成分二氢杨梅素的抗炎作用也有相关报道。二氢杨梅素能够明显抑制脂多糖(LPS)诱导RAW264.7细胞释放NO和致炎因子如白细胞介素(IL)-1β、IL-6以及肿瘤坏死因子-α(TNF-α),且呈现剂量依赖性;能有效抑制LPS诱导的诱导型一氧化氮合酶(iNOS)的表达,机制与抑制IκB激酶磷酸化、IκB磷酸化以及核转录因子- κB(NF-κB)的核转运密切相关[31]。
二氢杨梅素能显著抑制巴豆油引起的小鼠耳肿胀,显著抑制粉刺杆菌和LPS共同诱发的小鼠血浆丙氨酸氨基转移酶(ALT)活性的升高,也能显著抑制二硝基氟苯(DNFB)诱发的小鼠迟发性超敏反应引起的血管通透性的增高,抑制蛋白胨引起的腹腔炎症小鼠的中性粒细胞白三烯B4(LTB4)及白三烯C4(LTC4)的释放[32]。另外,陈立峰等[33]发现二氢杨梅素能明显升高免疫性慢性胃炎大鼠胃黏膜胃游离酸(TA)和总酸(FA)的量,显著降低血清胃泌素水平;显著降低血清iNOS活性、血清NO水平和血清IgG水平,从而对免疫性慢性胃炎大鼠胃黏膜发挥保护作用。
近年来亦有二氢杨梅素抗口腔溃疡的文献报道。兔复发性口腔黏膜溃疡模型的实验证明,二氢杨梅素能使口腔黏膜溃疡次数明显减少,血清抗体滴度、IgG降低,该作用可能通过中和血清抗口腔黏膜抗体、抗氧自由基损伤以及抑菌来实现[34]。
2.4 解酒护肝酒精滥用和依赖仍然缺乏治疗手段,目前,FDA仅批准了3种口服药物和一种注射药物[35]。二氢杨梅素能增加海马和神经元GABAARs a4亚基的表达,发挥抵抗酒精中毒和酒精依赖性作用,有望成为治疗酒精应用障碍(AUD)的候选药物[36]。给予二氢杨梅素能延长醉酒小鼠的耐受时间,并能明显缩短醒酒时间,证实二氢杨梅素有较好的防醉解酒效果[37]。
另外,二氢杨梅素也能有效地保护肝损伤,能够抑制由氨基半乳糖(GalN)引起的肝损伤大鼠乳酸脱氢酶(LDH)、ALT、天门冬氨酸氨基转移酶(AST)、α-维生素E和GSG/GSSH的增加,具有较好的肝保护作用[38]。二氢杨梅素对痤疮丙酸杆菌与脂多糖诱发的小鼠肝损伤具有保护作用,对小鼠腹腔中性粒细胞LTB4和LTC4的分泌呈剂量依赖性抑制作用[39]。乙醇诱导的小鼠肝损伤模型亦证明二氢杨梅素能有效升高肝脏还原型谷胱甘肽(GSH)水平,降低肝脏MDA水平。另外二氢杨梅素还能降低三酰甘油(TG)量,减轻肝细胞脂肪变性,具有较显著的乙醇性肝损伤保护作用,该作用可能是通过清除自由基,提高肝细胞抗氧化能力,抑制乙醇引起的膜脂质过氧化来实现的[40]。
2.5 降血糖不同的糖尿病动物模型均证实了二氢杨梅素具有降血糖作用。大剂量二氢杨梅素能够明显降低高糖高脂饲料结合ip链脲佐菌素诱导的II型糖尿病大鼠2周、3周血糖值,明显升高肾脏组织的SOD、GSH-Px活性,降低MDA量[41];亦能显著降低D2半乳糖诱导的糖耐量异常大鼠餐后2 h血糖值及血清胰岛素水平,有效改善糖耐量异常状态,明显降低尿微量白蛋白量及乳酸脱氢酶活性,对肾脏组织早期损伤有一定的保护作用[42]。另外,低浓度二氢杨梅素(25 mg/kg)对四氧嘧啶诱导的糖尿病小鼠的血清胰岛素水平和糖原量影响不明显,但能降低血糖水平,显著改善糖耐量;而高浓度二氢杨梅素(250 mg/kg)未能降低糖尿病小鼠血糖,但能明显促进胰岛素分泌及肝糖原合成[43],该结果是否说明二氢杨梅素存在降血糖浓度范围,还有待进一步研究。
二氢杨梅素也能抑制糖尿病相关酶的活性。醛糖还原酶是糖代谢的多元醇通路的关键限速酶,该通路与糖尿病并发症密切相关。二氢杨梅素能够浓度依赖性地抑制醛糖还原酶的活性,因而具有潜在的降血糖作用[44]。
2.6 抗病原微生物二氢杨梅素对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、链球菌等细菌均有很强的抑制活性,且抑菌作用在pH 3~4的环境中最强,但对真菌的抑制效果不明显[45];二氢杨梅素对乙型肝炎鸭血清中DHBV-DNA有显著抑制作用,且停药后3 d无反跳现象[46]。
2.7 其他作用二氢杨梅素药理活性非常广泛,除了抗肿瘤、抗氧化、抗炎等作用,也表现出一定的抗疲劳、抗血栓以及调血脂等生物活性。
高辉等[47]研究发现,二氢杨梅素能够延长小鼠负重游泳时间和缺氧生存时间;摘眼球取血检测发现,二氢杨梅素能升高小鼠体内肝糖原量,降低血清乳酸、尿素氮量,明显降低肝组织MDA量。在模拟高纬度环境下,给予SD大鼠不同浓度的二氢杨梅素,结果显示二氢杨梅素能够剂量依赖性地延长大鼠抗疲劳时间,在透射电子显微镜下观察线粒体形态发现,二氢杨梅素能够有效减少低压缺氧诱导的线粒体损伤,也能够降低血尿素、血清乳酸脱氢酶和肌酸激酶的活性,上调过氧化物酶体增生物激活受体(PPAR)、核呼吸因子1(NRF1)、腺苷酸活化蛋白激酶(AMPK)的表达,通过促进骨骼肌中线粒体的生物合成及调节线粒体分裂和融合的动态变化发挥抗疲劳作用[48]。
二氢杨梅素能降低急性血瘀大鼠血浆黏度和红细胞聚集指数,改善血瘀后血液流变学异常;小鼠耳廓微循环模型亦证实二氢杨梅素能够扩张血管,增加血流速度,改善机体微循环状态;二氢杨梅素还能明显延长小鼠血浆凝血酶时间(TT)和凝血酶原时间(PT),减少纤维蛋白原(FIB)量,以上实验均证明二氢杨梅素能发挥活血化瘀的作用[49]。二氢杨梅素能明显减轻大鼠静脉血栓模型中血栓的湿质量和干质量,抑制大鼠颈总动脉-颈外静脉血流旁路的血栓形成,对胶原蛋白-肾上腺素联合诱导后的小鼠脑血栓形成有抑制作用,能提高瘫痪小鼠的恢复率,但具体通过何种途径发挥抗血栓作用尚不明确[50]。
二氢杨梅素能明显减轻高血脂小鼠体质量,对小鼠血清总胆固醇(TC)/TG和低密度脂蛋白胆固醇(LDL-C)量的降低、高密度脂蛋白胆固醇(HDL-C)量的升高均影响显著,且能提高血清SOD活性[51]。
3 安全性二氢杨梅素毒理学的相关研究资料较少。徐静娟等[52]依照《保健食品检验与评价急性毒性试验技术规范》要求,ig给予大鼠二氢杨梅素(5.0 g/kg)进行急性毒性试验。在观察期内,大鼠皮肤、黏膜、毛色、眼睛、呼吸、循环、自主活动及中枢神经系统、行为表现等均未见异常现象,大鼠体质量未发生明显变化,试验期内无动物死亡,表明二氢杨梅素毒性很小。藤茶乙醇提取物的急性毒性试验结果也表明,ig给予10.0 g/kg藤茶乙醇提取物(经测定其中二氢杨梅素量为70%),大鼠的各项急性毒性评价指标均无明显变化,说明藤茶(二氢杨梅素)具有较好的食用安全性[53]。关于二氢杨梅素的亚急性毒性、长期毒性、生殖发育毒性等研究还未见报道。
4 展望二氢杨梅素是一种极具药用价值的黄酮类物质,近年来的研究表明,二氢杨梅素具有广泛的药理活性,能够通过多环节阻滞或延缓肿瘤的发生发展,有较强的抗氧化作用,另外还具有抗炎、解酒护肝、抗病原微生物、调血脂、降血糖等药理作用,具有较大的临床应用潜力。但总体而言,研究还不够系统和深入,如存在缺乏药动学研究资料、药理作用机制尚不明确等问题。
理想的药物除了应当具备疗效强、毒副作用小等特点之外,还应当具备优良的药动学性质。药动学研究影响到一个药物的应用前景,贯穿药物研发的全过程。从目前文献报道来看,二氢杨梅素此方面的研究极少,其在生物体内的生物膜透过率等性质几乎无法判断。药动学研究应当成为二氢杨梅素下一步研究的重点方向:(1)可考察二氢杨梅素在人或动物体内的生物利用度,分析最大血浆药物浓度,达峰时间和时量曲线下面积等药动学参数;如果存在口服生物利用度较低的情况,还应当进行肝首关效应实验。(2)考察二氢杨梅素在体内的分布半衰期,以及在脾脏、血浆、心脏、肝脏、肺、肾脏中的分布状况;由于血浆蛋白结合率影响到药物的组织分布,因此还需测定二氢杨梅素的血浆蛋白结合率。(3)对二氢杨梅素血、尿及肝胆中的代谢物分析鉴定,此方面虽有报道[54],但不够深入;另外还应当探究二氢杨梅素对肝脏细胞色素P450(CYP450)各亚酶蛋白表达的影响。通过以上研究,了解二氢杨梅素的药动学特征,可为进一步的药理学研究(如各部位的药物浓度)、药剂学研究(如不同剂型的选择及制备)以及临床应用(如制定合理的临床用药方案)提供理论依据。
药理作用方面,除抗肿瘤研究较多以外,二氢杨梅素其他方面的药理研究,如抗炎、保护心血管系统、解酒保肝等方面的研究还很少。黄酮类化合物对心血管有很好的治疗效果,许多活血化瘀中药中都含有黄酮类化合物。但是从文献报道来看,相对于已经广泛研究,且与之结构相似的黄酮类化合物如槲皮素、木犀草素、儿茶素而言,二氢杨梅素的心血管方面的研究较少,二氢杨梅素具有哪些黄酮化合物的一般特性,又具有哪些特殊的活性,还不得而知。进一步的药理研究有助于阐明其药效物质基础,亦有可能发现其新的有价值的活性。
近年来的许多研究证实二氢杨梅素有着广泛的药理作用,尽管还有很多问题需要进一步研究和确证,但其良好的药理活性为临床应用提供了广阔的空间,随着对二氢杨梅素更多分子水平、细胞水平、动物实验和临床研究的开展,这些机制将会被逐步阐明,二氢杨梅素的潜在药用价值将进一步显现。
| [1] | Purrmann R. Ber die flügelpigmente der schmetterlinge. VII. Synthese des leukopterins und natur des guanopterins[J]. Justus Liebigs Ann Chem, 1940, 544(1): 182-190. |
| [2] | 陈夏静, 姚汉玲, 张秋琼, 等. 大叶蛇葡萄中蛇葡萄素含量的高效液相色谱法测定[J]. 时珍国医国药, 2010, 21(5): 1053-1054. |
| [3] | 郭清泉, 林淑英, 李大光, 等. 二氢杨梅素抗氧化机制探讨[J]. 食品科学, 2006, 27(5): 121-123. |
| [4] | 李 卫, 郑 成, 宁正祥, 等. 二氢杨梅素的酯化及其抗氧化规律探讨[J]. 食品科技, 2007, 32(5): 198-201. |
| [5] | 郭清泉, 林淑英, 周立清, 等. 采用量子化学计算法探讨二氢杨梅素抗氧化机制[J]. 食品研究与开发, 2006, 27(2): 131-133. |
| [6] | 袁 娟. 二氢杨梅素的提取、金属离子配合物的制备及其生理活性的研究[D]. 广州: 广东工业大学, 2013. |
| [7] | Zhang Q, Liu J, Liu B, et al. Dihydromyricetin promotes hepatocellular carcinoma regression via a p53 activation-dependent mechanism[J]. Sci Rep, 2014, doi: 10.1038/srep04628. |
| [8] | 张 琼, 刘德育. 蛇葡萄素改变Bcl-2/Bax表达和激活caspase-3诱导人肝癌细胞Bel-7402凋亡[J]. 中国药理学通报, 2009, 25(11): 1502-1506. |
| [9] | Reddy B S, Sharma S K, Lown J W. Recent developments in sequence selective minor groove DNA effectors[J]. Curr Med Chem, 2001, 8(5): 475-508. |
| [10] | Guo Q Q, Yuan J, Zeng J H, et al. Synthesis of dihydromyricetin-manganese (ii) complex and interaction with DNA[J]. J Mol Struct, 2012, 1027: 64-69. |
| [11] | 周防震, 张晓元, 孙奋勇, 等. 二氢杨梅素诱导MDA-MB-231细胞凋亡[J]. 浙江大学学报: 农业与生命科学版, 2012, 38(3): 299-304. |
| [12] | 尹梅梅, 潘振伟, 蔡本志, 等. 二氢杨梅素诱导人肺腺癌细胞系AGZY-83-a凋亡的实验研究[J]. 中国药理学通报, 2008, 24(5): 626-630. |
| [13] | Wu S, Liu B, Zhang Q, et al. Dihydromyricetin reduced bcl-2 expression via p53 in human hepatoma hepg2 cells[J]. PLoS One, 2013, 8(11): e76886. |
| [14] | Zhou Y, Shu F, Liang X, et al. Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ros generation and endoplasmic reticulum stress pathway[J]. PLoS One, 2014, 9(2): e89021. |
| [15] | Huang H, Hu M, Zhao R, et al. Dihydromyricetin suppresses the proliferation of hepatocellular carcinoma cells by inducing G2/M arrest through the chk1/chk2/ cdc25c pathway[J]. Oncol Res, 2013, 30(5): 2467-2475. |
| [16] | 倪 峰, 姚 欣, 郭 丹, 等. 蛇葡萄素对人前列腺癌PC3细胞增殖与凋亡的影响[J]. 中药药理与临床, 2012, 28(3): 39-41. |
| [17] | 佳娜提·达吾列提, 姜 楠, 寇俊萍, 等. 调节细胞自噬的中药有效成分研究进展[J]. 中草药, 2014, 45(16): 2283-2292. |
| [18] | Xia J, Guo S, Fang T, et al. Dihydromyricetin induces autophagy in hepg2 cells involved in inhibition of mtor and regulating its upstream pathways[J]. Food Chem Toxicol, 2014, 66: 7-13. |
| [19] | Zhou F Z, Zhang X Y, Zhan Y J, et al. Dihydromyricetin inhibits cell invasion and down-regulates mmp-2/-9 protein expression levels in human breast cancer cells[J]. Prog Biochem Biophys, 2012, 39(4): 352-358. |
| [20] | Ni F, Gong Y, Li L, et al. Flavonoid ampelopsin inhibits the growth and metastasis of prostate cancer in vitro and in mice[J]. PLoS One, 2012, 7(6): e38802. |
| [21] | 叶建涛, 郑义磊, 刘德育. 蛇葡萄素对K562/adr细胞耐药性的逆转作用及机制研究[J]. 中国中药杂志, 2009, 34(6): 761-765. |
| [22] | Ruzza P, Rosato A, Rossi C R, et al. Glutathione transferases as targets for cancer therapy[J]. Anti-cancer Agents Med Chem, 2009, 9(7): 763-777. |
| [23] | 杨秀芬, 杨子明. 二氢杨梅素对小鼠肝脏谷胱甘肽-s转-移酶的抑制作用及其动力学分析[J]. 中国药理学通报, 2010, 26(7): 894-898. |
| [24] | Chen A F, Chen D D, Daiber A, et al. Free radical biology of the cardiovascular system[J]. Clin Sci, 2012, 123(1/2): 73-91. |
| [25] | 刘微微, 任 虹, 曹学丽, 等. 天然产物抗氧化活性体外评价方法研究进展[J]. 食品科学, 2010, 31(17): 415-419. |
| [26] | 张友胜, 宁正祥, 杨书珍, 等. 显齿蛇葡萄中二氢杨梅树皮素的抗氧化作用及其机制[J]. 药学学报, 2003, 38(4): 241-244. |
| [27] | Xin M L, Ma Y J, Xu K, et al. Structure-activity relationship for dihydromyricetin as a new natural antioxidant in polymer[J]. J Appl Polym Sci, 2013, 128(3): 1436-1442. |
| [28] | Zheng Q K, Xu L L, Zhu L H, et al. Preliminary investigations of antioxidation of dihydromyricetin in polymers[J]. Bull Mater Sci, 2010, 33(3): 273-275. |
| [29] | 何桂霞, 杨伟丽, 裴 刚, 等. 二氢杨梅素抗脂质过氧化作用的研究[J]. 中国中药杂志, 2003, 28(12): 88-90. |
| [30] | Tan G Y, Zhang M H, Feng J H, et al. Effects of pretreatment by the flavanol ampelopsin on porcine kidney epithelial cell injury induced by hydrogen peroxide[J]. Agric Sci China, 2010, 9(4): 598-604. |
| [31] | Qi S, Xin Y, Guo Y, et al. Ampelopsin reduces endotoxic inflammation via repressing ros-mediated activation of pi3k/akt/nf-kappa B signaling pathways[J]. Int Immunopharmacol, 2012, 12(1): 278-287. |
| [32] | 梁 婷. 二氢杨梅素抗炎及抗过敏作用的研究[D]. 沈阳: 沈阳药科大学, 2007. |
| [33] | 陈立峰, 张 琼, 董倩倩. 二氢杨梅素对大鼠免疫性慢性胃炎胃黏膜的保护作用及其机制[J]. 中国药理学与毒理学杂志, 2009, 23(5): 381-387. |
| [34] | 陈立峰, 董倩倩, 张 琼. 二氢杨梅素对兔复发性口腔黏膜溃疡的作用[J]. 中国中药杂志, 2008, 33(2): 176-180. |
| [35] | Davies D L, Bortolato M, Finn D A, et al. Recent advances in the discovery and preclinical testing of novel compounds for the prevention and/or treatment of alcohol use disorders[J]. Alcohol Clin Exp Res, 2013, 37(1): 8-15. |
| [36] | Shen Y, Lindemeyer A K, Gonzalez C, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J]. J Neurosci: Official J Soc Neurosci, 2012, 32(1): 390-401. |
| [37] | 潘人琦, 郁建平. 二氢杨梅素解酒作用的研究[J]. 山地农业生物学报, 2012, 31(3): 247-249. |
| [38] | Murakami T, Miyakoshi M, Araho D, et al. Hepatoprotective activity of tocha, the stems and leaves of ampelopsis grossedentata, and ampelopsin[J]. Biofactors, 2004, 21(1/4): 175-178. |
| [39] | 梁 婷, 吴春福, 吕艳青, 等. 二氢杨梅素对痤疮丙酸杆菌和脂多糖诱发小鼠肝损伤的保护作用及对中性粒细胞释放白三烯的影响[J]. 中草药, 2008, 39(1): 83-87. |
| [40] | 徐静娟, 姚茂君, 邬敏辰. 二氢杨梅素生物功效的研究[J]. 食品科学, 2008, 29(11): 622-625. |
| [41] | 黄先菊, 王文英, 王贵林, 等. 蛇葡萄素对2型糖尿病大鼠NO/NOS水平及抗氧化能力的影响[J]. 中国现代应用药学, 2008, 25(2): 95-98. |
| [42] | 郑 成, 陈 静, 郭丽娜, 等. 二氢杨梅素的降血糖及保护肾脏损伤效果研究[J]. 精细化工, 2008, 25(10): 966-969. |
| [43] | 卢 威, 秦晓改, 王跃虎, 等. 二氢杨梅素对四氧嘧啶性糖尿病小鼠的降糖作用研究[J]. 中药药理与临床, 2011, 27(4): 15-17. |
| [44] | 刘 恺, 高丽辉, 牛艳芬, 等. 二氢杨梅素对醛糖还原酶的抑制作用[J]. 中药药理与临床, 2012, 28(4): 43-45. |
| [45] | 萧力争, 银霞, 刘素纯, 等. 二氢杨梅素抗菌活性研究[J]. 食品科技, 2008, 33(4): 140-143. |
| [46] | 阎 莉, 郑作文. 藤茶双氢杨梅树皮素抗鸭乙肝病毒的实验研究[J]. 中国中药杂志, 2009, 34(7): 908-910. |
| [47] | 高 辉, 李春艳. 二氢杨梅素对小鼠运动性疲劳的影响[J]. 食品科学, 2012, 33(21): 295-297. |
| [48] | Zou D, Chen K, Liu P, et al. Dihydromyricetin improves physical performance under simulated high altitude[J]. Med Sci Sports Exerc, 2014, 46(11):2077-2084 |
| [49] | 覃 潇, 韦玉娜. 二氢杨梅素活血化瘀作用的实验研究[J]. 中国中医药科技, 2011, 18(1): 36-38. |
| [50] | 潘照斌, 李棐朝, 廖月娥, 等. 二氢杨梅素抗血栓形成的作用研究[J]. 中医药导报, 2010, 16(11): 92-94. |
| [51] | 陈玉琼, 倪德江, 程 倩, 等. 藤茶总黄酮及二氢杨梅素降血脂作用研究[J]. 茶叶科学, 2007, 27(3): 221-225. |
| [52] | 徐静娟, 姚茂君, 邬敏辰. 二氢杨梅素生物功效的研究[J]. 食品科学, 2008, 29(11): 622-625. |
| [53] | 谭 平, 姚茂君, 辛益妹, 等. 莓茶乙醇提取物的急性毒性研究[J]. 食品与机械, 2011, 27(6): 101-102. |
| [54] | Zhang Y, Que S, Yang X, et al. Isolation and identification of metabolites from dihydromyricetin[J]. Magn Res Chem: MRC, 2007, 45(11): 909-916. |
 2015, Vol. 46
2015, Vol. 46


