北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag. 为马兜铃科(Aristolochiaceae)细辛属Asarum L. 多年生草本植物,又名辽细辛、烟袋锅花、东北细辛、细参等,它与汉城细辛Asarum sieboldii Miq. var. seoulense Nakai.、华细辛Asarum sieboldii Miq. 的地下根及根茎一同被列为正品生药细辛,具有抗菌抗炎、解热镇痛、平喘祛痰等药理作用[1]。北细辛主要生长在东北三省地区,近年来由于过度采挖和生境破坏,导致野生资源急剧减少[2]。通过人工栽培北细辛在一定程度上缓解了临床用药的紧张局面[3];但北细辛种子繁殖所需时间长,通常播种当年只长根不长苗,成苗需5~6年[4]。而组织培养具有繁殖速度快、繁殖系数高等特点,已成为种苗规模化生产的有效途径。愈伤组织的诱导和形态发生是组织培养成败的关键环节,为此,本研究以北细辛地上部分叶片和叶柄为外植体,探讨不同状态的外植体对愈伤组织诱导发生的影响,筛选最佳的基本培养基及植物生长调节剂种类及配比,为获得大量高质量的愈伤组织提供参考资料。同时,对不同时期愈伤组织进行组织学观察,了解其形态、类型及发生过程,为后续的扩大培养及再生体系、悬浮体系的建立提供依据。
1 材料与方法 1.1 材料北细辛植株取自黑龙江中医药大学药用植物园和黑龙江省森林植物园药物园,经黑龙江中医药大学王振月教授鉴定为马兜铃科细辛属北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.。以叶柄和叶片作为外植体,分为幼期、生长期和成熟期3个时期,其中休眠芽萌发破土后2 d叶片未完全展开,叶柄长2~3 cm,此时定为幼期;生长15 d叶片刚展开,叶柄长8~10 cm,此时定为生长期;生长30 d叶片完全展开,叶柄长15~20 cm,此时定为成熟期。
取幼期叶柄接种后培养5、7、10、15、20、25、30、40、60 d长势一致且无染菌现象的愈伤组织,置于福尔马林-乙酸-酒精(F.A.A)固定液中,用于愈伤组织形态结构观察。
1.2 方法 1.2.1 外植体前处理流水冲洗叶柄及叶片3 h,再置于蒸馏水中浸泡1 h。然后用70%乙醇、0.1%升汞溶液灭菌消毒,灭菌后将与溶液相接触的叶柄两端和叶片边缘部分切掉。
1.2.2 愈伤组织诱导培养基将幼期叶柄分别接种到含30 g/L蔗糖的MS、1/2 MS、B5培养基中,均添加0.6 mg/L 6-苄基腺嘌呤(6-BA)和0.15 mg/L萘乙酸(NAA),培养20 d后统计出愈率(出愈率=出愈块数/接种块数)。
以1/2 MS为基本培养基,加入30 g/L蔗糖,并添加不同质量浓度的2,4-二氯苯氧基乙酸(2,4-D)、激动素(KT)、6-BA和NAA。培养基采用高压湿热灭菌,121 ℃,灭菌20 min;植物生长调节剂采用过滤法灭菌。
1.2.3 愈伤组织形态结构观察采用石蜡切片法,将固定后的愈伤组织经过冲洗、脱水、透明、浸蜡和包埋、切片、贴片及番红-固绿双重染色、中性树胶封藏等过程,制成永久切片,OLYMPUS-BH显微镜下观察并拍照。
2 结果与分析 2.1 不同基本培养基对愈伤组织诱导的影响以幼期叶柄或叶片为外植体,分别接入到3种愈伤组织诱导培养基,培养20 d后观察并统计愈伤组织诱导情况(表 1)。结果显示(图 1),在MS
| 表 1 不同基本培养基对愈伤组织诱导的影响 Table 1 Effects of different basic media on callus induction |
 | A~C-分别以MS(A)、B5(B)和1/2 MS(C)为基本培养基幼期叶柄诱导的愈伤组织 D-以1/2 MS为基本培养基幼期叶片诱导的愈伤组织 A—C-callus induction from young petioles with MS medium (A),B5 medium (B),and 1/2MS medium (C) D-callus induction from young leaves with 1/2MS medium图 1 北细辛愈伤组织的诱导Fig. 1 Callus induction from A. heterotropoides var. mandshuricum |
培养基中诱导形成的愈伤组织结构致密,褐化程度较高(图 1-A);B5培养基愈伤组织诱导率低至4%,生长缓慢,且褐化现象严重,愈伤组织结构致密,表面有结晶物质产生(图 1-B);而以1/2 MS作为基本培养基,愈伤组织诱导率高,呈淡绿色颗粒状,结构较松散,褐化程度低(图 1-C,D)。根据愈伤组织生长状况和褐化程度可以得出,以幼期叶柄或叶片为外植体,1/2 MS为愈伤组织诱导的最佳培养基。
2.2 不同类型外植体对愈伤组织诱导的影响将不同生长时期的叶柄和叶片,接种到1/2 MS培养基中,培养20 d后对愈伤组织形态进行观察统计(表 2)。结果显示,外植体越成熟,出愈率越低,褐化现象越严重。以幼期的叶柄及叶片为外植体,褐化程度较低,且生长状态良好,并在切口处膨大长出愈伤组织(图 1-C、1-D)。若以幼期叶柄为外植体,可全部诱导出愈伤组织,接种7 d后切口处膨大,12 d左右可见嫩绿色愈伤组织形成,并能继续生长。而将幼期叶片接种后,呈现进一步长大的趋势,以此无菌培养的叶片为外植体再次接种,培养15 d左右叶片边缘卷曲膨大并在切口处长出淡黄绿色愈伤组织,生长较为缓慢。因此,幼期叶片和叶柄均可用于北细辛愈伤组织诱导,比较而言幼期叶柄是最适外植体材料。
| 表 2 不同类型外植体对愈伤组织诱导的影响 Table 2 Effects of different explants on callus induction |
植物生长调节剂对北细辛幼嫩叶柄愈伤组织诱导的影响见表 3~5,单独添加2,4-D、2,4-D+KT和6-BA+NAA均能诱导形成愈伤组织。表 3可以看出添加1.5 mg/L 2,4-D时出愈率最高,2,4-D在0.2~1.5 mg/L愈伤组织的诱导率随着浓度升高而增加;培养10 d左右,外植体切口两端膨大,愈伤组织致密,呈深绿色颗粒,生长缓慢,褐化率高,40 d左右外植体及愈伤组织全部褐化死亡。2,4-D+KT组合仅在比例为4∶1时诱导形成愈伤组织,但生长缓慢,呈致密状,且外植体褐化严重(表 4)。由表 5可见6-BA和NAA在多种浓度配比下均能诱导愈伤组织发生,但愈伤组织诱导情况随浓度配比有很大变化,其中0.6 mg/L 6-BA和0.15 mg/L NAA即质量浓度配比为4∶1条件下愈伤组织诱导率达到100%,且愈伤组织状态良好,呈淡绿色颗粒状,褐化率低,适合扩大培养。因此,以幼期北细辛叶柄为外植体,最适的愈伤组织诱导条件为1/2 MS+30 g/L蔗糖+0.6 mg/L 6-BA+0.15 mg/L NAA。
| 表 3 不同质量浓度2,4-D对愈伤组织诱导的影响 Table 3 Effects of different concentration of 2,4-D on callus induction |
| 表 4 不同质量浓度2,4-D+KT组合对愈伤组织诱导的影响 Table 4 Effects of different 2,4-D + KT concentration on callus induction |
| 表 5 不同质量浓度6-BA+NAA组合对愈伤组织诱导的影响 Table 5 Effects of different 6-BA + NAA concentration on callus induction |
将幼期叶柄接种于培养基5 d后,可观察到叶柄切口边缘膨大,通过组织切片观察发现此时的细胞明显增大,细胞核显著(图 2-A);培养12~15 d后,切口处进一步膨大,并形成少量的愈伤组织,图 2-B显示出在叶柄切口处已形成分裂活跃的细胞团;培养20~25 d,则有较多愈伤组织的出现,图 2-C显示愈伤组织的细胞核明显,细胞体积变小,且细胞排列紧密。观察发现愈伤组织主要存在于叶柄维管束附近,因此认为分化初期叶柄维管束附近部分薄壁细胞恢复分裂能力形成分生细胞团,成为新的生长中心,继而产生了愈伤组织。部分分生细胞团分化为维管细胞,呈鸟巢状结构排列(图 2-D)。图 2-E可以看出这些维管细胞已与外植体的维管束相连接,作为愈伤组织与外植体之间物质传输的通道。有的外植体切口处会出现褐化物质(图 2-F),导致切口处不能产生愈伤组织,外植体进一步褐化而死亡。
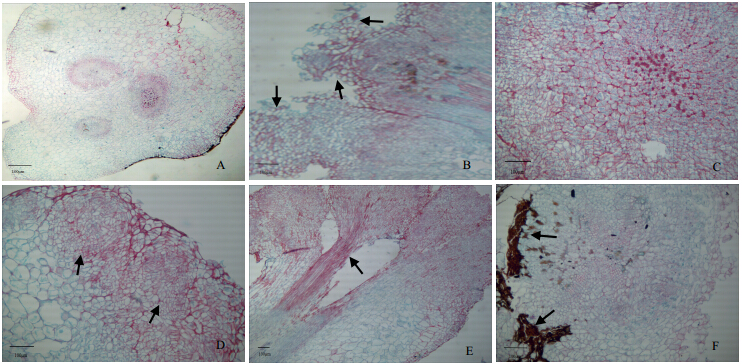 | A-愈伤组织形成初期叶柄横切 B-切口处分裂活跃的细胞团(箭头所示) C-愈伤组织横切 D-分生细胞团分化形成的维管细胞排列呈鸟巢状结构(箭头所示) E-形成的维管细胞与外植体维管束相连接(箭头所示) F-切口处褐化(箭头所示),导致细胞死亡 A-crosssection of petiole while forming the initial callus B-cell masses (shown by arrows) actively divided near the cut end C-crosssection of callus D-meristematic cells were differentiated into vascular cells arranged with the bird’s nest-like structure (shown by arrows) E-vascular cells were connected with the vascular bundle of the explant (shown by arrows) F-browning of the cut end (shown by arrows) led to cell death图 2 北细辛愈伤组织的组织学观察Fig. 2 Histological observation on callus formation of A. heterotropoides var. mandshuricum |
褐化、污染和玻璃化被称为组织培养的三大难题,能否有效控制褐化则成为组培成功与否的关键,而引起外植体褐化的因素包括外植体自身(外植体的遗传特性、生长状态等)及所处的培养环境(培养基成分、培养条件)2方面[5]。愈伤组织诱导时出现褐化主要是伤口处的酚类物质被多酚氧化酶氧化为褐色的醌类物质[6],这种物质外流深入培养基抑制其他酶的活性,从而导致外植体死亡。通过对愈伤组织切片观察也发现在外植体切口表面出现褐化物质。本研究以3个生长阶段的叶片和叶柄为外植体,发现随着植株生长进程的推进,叶片和叶柄愈伤组织诱导率降低,褐化越严重,说明成熟期叶片和叶柄中导致褐化的多酚类化合物增加。王南等[7]以叶片为外植体诱导的愈伤组织生长缓慢,与本研究结果一致。而与同一生长时期的叶片相比,叶柄愈伤组织诱导具有出愈时间短、愈伤组织状态良好等特点,因此幼期叶柄是北细辛愈伤组织诱导的最佳材料,保障了后续再生体系的成功建立。
段曼姣[8]、萧洪东等[9]、南桂仙等[10]先后进行了北细辛地下部分根及根茎愈伤组织诱导,得出MS为最适诱导培养基,而本研究以幼期叶柄为外植体,发现1/2 MS诱导形成的愈伤组织较优,诱导率有的可达100%。推测1/2 MS培养基中盐离子浓度降低、减小了渗透压,因而更适合叶柄愈伤组织的诱导。植物生长调节剂在愈伤组织诱导过程中发挥重要作用,细胞分裂素与生长素浓度配比适宜才能更好的诱导愈伤组织[11],常用的细胞分裂素有6-BA、KT,生长素有2,4-D、NAA等[12, 13, 14]。本研究通过正交试验,结果表明以0.6 mg/L 6-BA和0.15 mg/L NAA即4∶1的浓度配比,最适合叶柄愈伤组织的诱导。
研究表明北细辛叶柄维管束具有3-5-3的分布规律,即上部和下部为3束,中间为5束[15],本研究在进行北细辛叶柄愈伤组织诱导过程中发现愈伤组织基本发生在3束维管束处,进一步通过组织切片观察发现愈伤组织形成初期外植体维管组织薄壁细胞及周围少量薄壁细胞脱分化,分裂活跃,这与刘克斌等[16]、Ouyang等[17]和岳鑫等[18]对番茄、肉苁蓉和锁阳愈伤组织发生形态学观察结果类似。因此推断北细辛愈伤组织的发生位点为维管组织,脱分化分裂活跃的细胞形成分生细胞团,Shen等[19]称其为愈伤组织的生长中心。有的分生细胞团逐渐分化,形成鸟巢状结构排列的维管细胞,并与外植体的维管束连接以进行物质运输,该结构与许智宏等[20]对烟草愈伤组织诱导研究相吻合。分生细胞团经过不断的分裂,在外植体切口处形成大量愈伤组织,细胞小且排列紧密,为胚性愈伤组织[21]。获得的胚性愈伤组织,将进一步诱导分化为再生植株,从而保证了北细辛种质资源的可持续开发与利用。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 邵 财, 郭 靖, 王志清, 等. 东北三省野生北细辛资源调查报告[J]. 中国野生植物资源, 2012, 31(1): 52-53. |
| [3] | 刘东吉, 刘春生. 不同产地栽培辽细辛的挥发油研究[J]. 中国实验方剂学杂志, 2010, 16(9): 79-82. |
| [4] | 韩广辉, 张 欣. 落叶松下细辛栽培技术[J]. 内蒙古林业调查设计, 2008, 31(6): 71-72. |
| [5] | 郭 艳, 杨海玲. 植物组织培养中的褐化现象及解决途径[J]. 山西农业科学, 2009, 37(7): 14-16. |
| [6] | 李凤华, 汤绍虎, 孙一铭, 等. 降低何首乌愈伤组织褐化研究[J]. 西南师范大学学报, 2005, 30(2): 337-340. |
| [7] | 王 南, 臧 埔, 于 英, 等. 细辛愈伤组织诱导条件的研究[J]. 安徽农业科学, 2010, 38(5): 2239-2240. |
| [8] | 段曼姣. 细辛组织快繁技术[J]. 郴州师范高等专科学校学报, 2001, 22(2): 120-121. |
| [9] | 萧洪东, 聂 磊, 蓝旭东, 等. 细辛组织培养快速繁殖初探[J]. 佛山科学技术学院学报: 自然科学版, 2004, 22(2): 67-68. |
| [10] | 南桂仙, 金光德. 细辛组织培养研究[J]. 河北农业科学, 2009, 13(7): 39. |
| [11] | 李代丽, 康向阳. 植物愈伤组织培养中内外源激素效应的研究现状与展望[J]. 生物技术通讯, 2007(3): 546-548. |
| [12] | 李浚明, 朱登云. 植物组织培养教程[M]. 北京: 中国农业大学出版社, 2005. |
| [13] | 韦 莹, 黄雪彦, 韦坤华, 等. 箭根薯愈伤组织诱导及无性系的建立[J]. 中草药, 2013, 44(17): 2466-2470. |
| [14] | 黄衡宇, 王美蓉. 紫背金盘愈伤组织诱导与再生体系的建立[J]. 中草药, 2014, 45(9): 1313-1318. |
| [15] | 穆 靖, 袁 强, 吴秀菊. 北细辛 (Asarum heterotropoides) 营养器官解剖结构及其挥发油的组织化学定位[J]. 东北农业大学学报, 2009, 40(2): 51-56. |
| [16] | 刘克斌, 李曙轩. 番茄叶组织培养中愈伤组织形成和器官发生的细胞学和微形态学研究[J]. 广西植物, 1991, 11(3): 240-246. |
| [17] | Ouyang J, Wang X D, Zhao B, et al. Enhanced production of phenylethanoid glycosides by precursor feeding to cell culture of Cistanche deserticola[J]. Process Biochem, 2005, 40(11): 3480-3484. |
| [18] | 岳 鑫, 段园园, 陈贵林. 锁阳愈伤组织诱导和增殖及不定根分化[J]. 植物生理学报, 2013, 49(12): 1421-1426. |
| [19] | Shen X L, Michael K, Chen J J. Effects of genotype, explant source, and plant growth regulators on indirect shoot org-anogenesis in Dieffenbachia cultivars[J]. In vitro Cell Dev Biol Plant, 2008, 44(4): 282-288. |
| [20] | 许智宏, 刘桂云. 烟草叶组织培养中愈伤组织和芽形成的细胞学观察[J]. 植物学报, 1980, 22(1): 1-7. |
| [21] | 尤培雷, 许 杰, 钱忠英. 黄秋葵愈伤组织的产生及其切片观察[J]. 上海农业学报, 2007, 23(3): 92-95. |
 2015, Vol. 46
2015, Vol. 46


