2. 安徽省中医药科学院中西医结合研究所, 安徽 合肥 230038
2. Institute of Integrated Traditional Chinese and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230038, China
近年来,随着人口老龄化的日趋严峻,广谱抗生素、糖皮质激素以及免疫抑制剂的广泛使用,HIV感染者不断增加,加之器官移植等新技术的发展,深部真菌感染的发病率逐渐升高。其中念珠菌属是引起深部真菌感染的主要致病菌[1, 2],临床分离的常见念珠菌主要包括白色念珠菌和非白念珠菌,如热带念珠菌Candida tropicalis、光滑念珠菌C. glabrata、近平滑念珠菌C. parapsilokis、克柔念珠菌C. Krusei、季也蒙念珠菌C. guilliermondii等。虽然在念珠菌属中白色念珠菌仍是引起念珠菌感染的主要致病菌种,但是近年来,随着真菌感染的病原谱发生改变,该菌种的临床检出率较以往有所下降,而该菌属中的非白念珠菌所占的比例逐年上升[3]。
念珠菌为酵母-菌丝双相菌,通常酵母相时无致病力,但当机体免疫力下降时,念珠菌会转化为菌丝相,对机体造成损伤[4]。同时,菌丝也是念珠菌生物膜的重要组成部分,在完整的生物膜中,大量菌丝纵横交织并伴有一定的酵母相,此时,对常规抗真菌药如氟康唑等的敏感性大大下降。目前抗真菌药物种类较少,毒副作用较大,且耐药菌株不断增多,因此,亟需研发新型的抗真菌药物,而从天然产物中发掘抗真菌药物已成为获取抗真菌药物的一个重要渠道[5]。
姜黄是一种常用中药,其主要有效成分姜黄素(curcumin)具有多方面的药理作用,如抗炎、抗氧化、抗凝、调血脂、抗动脉粥样硬化及抗肿瘤等[6]。近期研究发现姜黄素对白色念珠菌有抑制作用[7],但姜黄素对非白念珠菌是否也存在抑制作用尚未见报道,故本实验观察姜黄素对热带念珠菌、光滑念珠菌、近平滑念珠菌、克柔念珠菌、季也蒙念珠菌5种非白念珠菌菌丝发育及生物膜形成的影响,旨在为姜黄素将来可能用于此类感染的治疗提供一定的实验依据。
1 材料与方法 1.1 试剂与培养基姜黄素购于中国食品药品检定研究院(批号110823-201004,质量分数98%);二甲基亚砜(DMSO)购于天津市光复精细化工研究所,分析纯;RPMI 1640培养基(Gibco公司)。胎牛血清购于浙江天杭生物科技有限公司,维生素K3购于Sigma公司,YPD琼脂购于北京路桥技术有限公司(批号130107),pH 7.4磷酸盐缓冲液(NaCl 8.0 g,KCl 0.2 g,KH2PO4 0.24 g,Na2HPO4·12H2O 3.628 g,溶于800 mL蒸馏水中,用盐酸调pH值为7.4,蒸馏水定容至1 000 mL,高压灭菌后-4 ℃保存),戊二醛(25%)购于国药集团化学试剂有限公司,氟康唑对照品购于中国食品药品检定研究院(批号100314-201204)。
1.2 仪器DPH-9162型电热恒温培养箱(上海一恒科技有限公司),血细胞计数板(上海求精生化试剂仪器有限公司),CX21型光学显微镜,CKX41-32型倒置显微镜(日本Olympus公司),Sirion200扫描电镜(美国FEI公司),96孔微量培养板、24孔微量培养板(美国Coming公司)。
1.3 菌株热带念珠菌标准株(ATCC 750)、光滑念珠菌标准株(ATCC 2340)、近平滑念珠菌标准株(ATCC 22019)、克柔念珠菌标准株(ATCC 1182)、季也蒙念珠菌标准株(ATCC 6260)均购自南京便诊生物科技有限公司。
1.4 菌悬液的配制从4℃保存的沙氏固体培养基上挑取非白念珠菌单菌落,接种至RPMI 1640培养液中,37 ℃、200 r/min培养16 h,用血细胞计数板计数,再用RPMI 1640培养液稀释至2×106 CFU/mL,备用。
1.5 对非白念珠菌最小抑菌浓度(MIC)的测定将100 μL菌液(2×103 CFU/mL)接种于96孔板中,分别加入100 μL(终质量浓度为512、256、128、64、32、16、8、4 μg/mL)姜黄素,并设未加药的对照组和阳性药氟康唑(终质量浓度为8、4、2、1、0.5、0.25 μg/mL)组,以下实验均设对照与阳性对照组,37 ℃培养48 h。观察结果,以肉眼观察无菌生长的最小药液稀释浓度为MIC,实验重复3次。
1.6 对非白念珠菌抑制生物膜50%浓度(SMIC50)的测定将菌液浓度调至2×106 CFU/mL,姜黄素质量浓度同“1.5”项,37 ℃培养24 h后,每孔加入甲基四氮盐(XTT)60 μL(临用前加入终质量浓度1 μg/mL的维生素K3),继续37 ℃避光培养2 h后492 nm波长处测定吸光度(A)值。以对照组A值的50%为SMIC50,实验重复3次。
1.7 倒置显微镜下观察姜黄素对非白念株菌菌丝形成的影响将100 μL菌液(2×106 CFU/mL)接种于96孔板中,分别加入100 μL(终质量浓度为512、256、128 μg/mL)姜黄素,37 ℃分别培养2、4 h。倒置显微镜下观察并拍摄各菌株形态的变化。
1.8 YPD固体培养基上观察姜黄素对非白念珠菌菌落形态的影响配制YPD固体培养基(加入10%胎牛血清),分别加入终质量浓度为512、256、128 μg/mL的姜黄素。用倍比稀释法将非白念珠菌菌悬液稀释至20 CFU/mL,用微量移液器吸取100 μL,均匀涂布于YPD固体培养基上。在37 ℃培养箱中培养4 d后取出,用光学显微镜观察并用相机拍摄其菌落形态。
1.9 扫描电镜观察姜黄素对非白念珠菌生物膜的影响将1mL菌液(2×106 CFU/mL)接种24孔板中,分别加入1 mL(终质量浓度为512、256、128 μg/mL)的姜黄素。菌药混合后加入经过灭菌处理的医用导管片,放入37 ℃培养箱培养24 h后,将待检测的导管片标本取出,以PBS缓冲液轻洗2次,于预冷2.5%戊二醛溶液中避光固定3 h,用PBS缓冲液轻洗2次,乙醇梯度脱水(30%,10 min;70%,10 min;100%,10 min),过夜干燥后镀金,使用扫描电镜观察并拍照。
2 结果 2.1 姜黄素对非白念珠菌的MIC与SMIC50姜黄素对5种非白念珠菌的MIC与SMIC50见表 1。
| 表 1 姜黄素对5种非白念珠菌的MIC与SMIC50 Table 1 MIC and SMIC50 of curcumin to five kinds of non-C. albicans |
倒置显微镜下发现,培养4 h后,对照组5种非白念珠菌均出现菌丝,呈交织状态,而姜黄素组(512 μg/mL)与氟康唑组的5种非白念珠菌仅为酵母相,偶见出芽(图 1)。
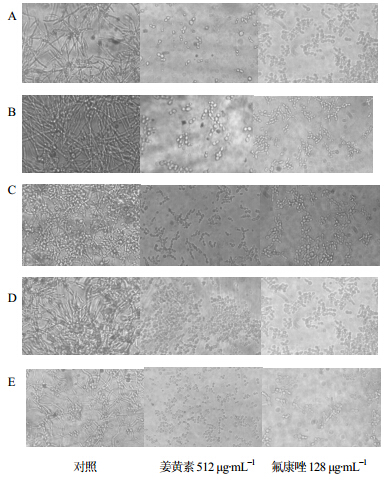 | A-热带念珠菌 B-光滑念珠菌 C-近光滑念珠菌 D-克柔念珠菌 E-季也蒙念珠菌,下同, A-C.tropicalis B-C. glabrata C-C. parapsilokis D-C. krusei E-C. guilliermondii,same as below 图 1 姜黄素对5种非白念珠菌菌丝形成的影响 (倒置显微镜)Fig. 1 Effectof curcumin on hyphal formation of five kinds of non-C. albicans (inverted microscope) |
在加入10%胎牛血清的YPD培养基上经过37 ℃、4 d的培养后,对照组5种非白念珠菌菌落周围出现大量密集的菌丝,不仅在培养基表面延伸,还渗入培养基内部。而姜黄素组与氟康唑组的5种非白念珠菌菌落表面光滑,无菌丝延伸,见图 2。
 | 图 2 姜黄素对5种非白念珠菌菌落中菌丝的影响 (光学显微镜)Fig. 2 Effect of curcumin on hyphae on solid medium of five kinds of non-C. albicans (optical microscope) |
经扫描电镜观察发现,培养24 h后,对照组5种非白念珠菌均形成生物膜,其内部有大量菌丝,菌丝相与酵母相纵横交织。而姜黄素组与氟康唑组的5种非白念珠菌多数为酵母相,呈单层或简单多层,很少见菌丝相,见图 3。
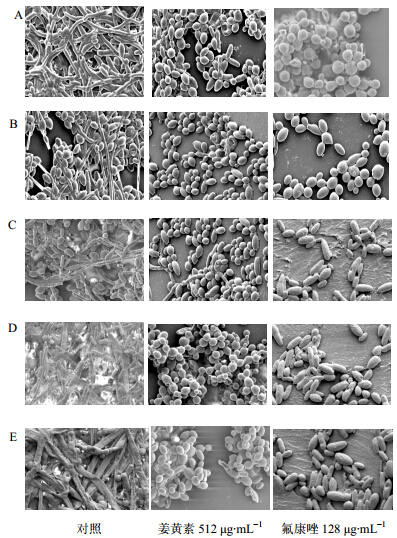 | 图 3 姜黄素对5种非白念珠菌生物膜形态的影响(电镜)Fig. 3 Effectof curcumin on biofilm formation of five kinds of non-C. albicans (SEM) |
白色念珠菌虽是导致念珠菌病的主要菌种,但据统计,1998—2007年,我国部分地区白色念珠菌在念珠菌病中的分离率已由65.2%降至57.8%,而各种非白念珠菌所占的比例有所上升,其中热带念珠菌12.8%,近平滑念珠菌10.8%,光滑念珠菌10.8%,其他非白念珠菌16.8%,且呈持续上升的趋势[8]。由此可见,念珠菌病的病原谱已经发生较大的改变,加之念珠菌对常用的抗真菌药物如氟康唑、伊曲康唑等的耐药性也不断上升,因此寻找新的毒副作用低的治疗念珠菌病药物是一个重要趋势。
念珠菌的耐药性与其形成生物膜密切相关。念珠菌生物膜是由大量念珠菌细胞不可逆地与生物或非生物组织表面接触后由自身产生的细胞外基质包裹着活菌细胞形成的微生态,以生物膜状态存在的念珠菌对抗菌药物的敏感性要下降几十倍甚至上千倍。念珠菌生物膜的发育过程大致经过黏附、微菌落形成、菌丝发育、生物膜成熟、生物膜细胞分散并再定植等阶段[9],其中菌丝是念珠菌生物膜结构的重要组成部分,且念珠菌一般在由酵母相转化为菌丝相时才具有致病性。菌丝相细胞不仅可避免宿主吞噬细胞的作用,其分泌的细胞壁黏附素也有助于侵袭组织细胞,进而引起感染[10]。
本实验结果显示,姜黄素对这5种非白念珠菌中的热带念珠菌、光滑念珠菌、季也蒙念珠菌的MIC分别是64、128、128 μg/mL,对另外2种念珠菌的MIC均为256 μg/mL,姜黄素对热带念珠菌、光滑念珠菌、季也蒙念珠菌的SMIC50均为512 μg/mL,对另外两种念珠菌的SMIC50均大于512 μg/mL,表明姜黄素对浮游状态及生物膜状态的热带念珠菌、光滑念珠菌、季也蒙念珠菌的抑制效果要强于另外2种念珠菌,提示姜黄素对这5种非白念珠菌尤其是热带念珠菌、光滑念珠菌、季也蒙念珠菌的生长具有较强的抑制作用。
在形态学上,倒置显微镜观察发现,512 μg/mL姜黄素能够对这5种非白念珠菌的菌丝形成产生抑制,势必会影响下一步生物膜的形成。扫描电镜观察也显示,对照组中5种非白念珠菌生物膜完整,其中菌丝互相交织并伴有酵母相,在512 μg/mL姜黄素作用下,这5种念珠菌只能形成单层或简单复层的只有酵母相细胞构成的生物膜,已完全失去了作为生物膜骨架的菌丝,这样的生物膜结构不牢固。在对照组即未加入姜黄素的固体YPD培养基上,这5种非白念珠菌的菌落表面粗糙,有丝化现象,且周围有大量菌丝延伸,与培养基结合牢固[11],而在加入姜黄素的固体培养基上,这5种非白念珠菌的菌落呈光滑圆形,周围界限分明,没有菌丝形成。
结合前述Garcia-Gomes等[7]的发现及本实验的结果,提示姜黄素具有一定的抑制念珠菌的效果。沃兴德等[12]报道,以500 mg/kg的姜黄素对大鼠进行长期毒性实验,结果显示其对大鼠各项生理指标无任何影响,表明姜黄素是一种安全的中药活性成分,因而具有一定的治疗念珠菌病的潜在价值。多项研究已明确,姜黄素具有抗癌作用,其作用机制与通过某些信号传导通路诱导癌细胞凋亡有关[13, 14]。姜黄素对念珠菌菌丝及生物膜的抑制是否也通过一定的信号传导途径发挥作用,值得进一步研究。
| [1] | Pfaller M A, Diekema D J, Rinaldi M G, et al. Results from the artemis disk global antifungal surveillance study: a 6. 5-year analysis of the worldwide susceptibility of yeasts to fluconazole and voriconazole using standardized disk diffusion testing[J]. J Clin Microbiol, 2005, 41(12): 5848-5849. |
| [2] | Antoniadou A, Torres H A, Lewis R E, et al. Candidemia in a tertiary care cancer center: in vitro susceptibility and its association with outcome of initial antifungal therapy[J]. Medicine, 2003, 82(5): 309-321. |
| [3] | Barchiesi F, Falconi D, Francesco L, et al. In vitro activities of terbinafine in combination with fluconazole and itraconazole against isolate of Candida albicans with reduced susceptibility to azoles[J]. Antimicrob Agents Chemogther, 1997, 41(8): 1812-1814. |
| [4] | Finkel J S, Mitchell A P. Genetic control of Candida albicans biofilm development[J]. Nat Rev Microbiol, 2011, 9(2): 109-118. |
| [5] | Kumar A, Dhamgaye S, Maurya I K, et al. Curcumin targets cell wall integrity via calcineurin-mediated signaling in Candida albicans[J]. Antimicro Agents Chemother, 2014, 58(1): 167-175. |
| [6] | Hiller E, Heine S, Brunner H, et al. Candida albicans Sun41, a putatively cosidase, is involved in morphogenesis, cell wall biogenesis, and biofilm formation[J]. Eukaryot Cell, 2007, 6(11): 2056-2065. |
| [7] | Garcia-Gomes A S, Curvelo J A R, Soares R M A, et al. Curcumin acts synergistically with fluconazole to sensitize a clinical isolate of Candida albicans showing a MDR phenotype[J]. Med Mycol, 2012, 50(1): 26-32. |
| [8] | Wu J Q, Zhu L P, Ou X T, et al. Epidemiology and risk factors for non-Candida albicans candidemia in non-neutropenic patients at a Chinese teaching hospital[J]. Med Mycol, 2011, 49(5): 552-555. |
| [9] | Bonhomme J, d'Enfert C. Candida albicans biofilms: building a heterogeneous, drug-tolerant environment[J]. Curr Opin Microbiol, 2013, 16(4): 398-403. |
| [10] | Dovigo L N, Carmello J C, de Souza Costa C A, et al. Curcumin-mediated photodynamic inactivation of Candida albicans in a murine model of oral candidiasis[J]. Med Mycol, 2013, 51(3): 243-251. |
| [11] | Tsang P W K, Wong A P K, Yang H P. Purpurin Triggers Caspase-Independent Apoptosis in Candida dubliniensis Biofilms[J]. PloS One, 2013, 8(12): e86032. |
| [12] | 沃兴德, 洪行球, 高承贤, 等. 姜黄素长期毒性试验[J]. 浙江中医学院学报, 2000, 24(1): 61-65. |
| [13] | 李小江, 贾英杰, 张文治, 等. 姜黄素对A549细胞亚群SP及NON-SP细胞凋亡的诱导作用[J]. 中草药, 2013, 44(18): 2581-2584. |
| [14] | Abouzeid A H, Patel N R, Sarisozen C, et al. Transferrin-targeted polymeric micelles co-loaded with curcumin and paclitaxel: efficient killing of paclitaxel-resistant cancer cells[J]. Pharm Res, 2014, 31(8): 1-8. |
 2015, Vol. 46
2015, Vol. 46


