毛蕊花糖苷(verbascoside,VER)又名麦角甾苷、毛蕊花苷、阿克苷、类叶升麻苷,是苯丙素苷类化合物。目前,关于VER在不同植物中的量分布的报道较多,主要存在于地黄叶、肉苁蓉等植物中。VER对骨质疏松症、神经系统及免疫系统等具有明显的防治及治疗作用[1, 2]。VER通过体液输送到达靶位才发挥药效功能,其中血液输送是重要途径。
血清白蛋白(serum albumin,SA)是血浆中量最丰富的蛋白质,具有贮运内源代谢产物和外源药物分子等重要生理功能[3]。与其他的蛋白质相比,SA相对分子质量较小、溶解性较大、稳定性较好、与配体具有较好的亲和性,比较易于分离、提纯,可大量制备,且其三级结构已被人类所探知,是理想的模型蛋白质分子,常作为药物与蛋白质分子相互作用研究中的模型大分子。牛血清白蛋白[4, 5, 6](bovine serum albumin,BSA)是由582个氨基酸残基组成的单肽链蛋白质,BSA的空间结构由3个结构域组成,每个结构域由2个亚结构域以槽口相对的方式形成圆筒结构,几乎所有的疏水性氨基酸残基都分布于圆筒的内部,构成3个疏水腔,且在134及213位各含有一个色氨酸残基。分析生理条件下药物与BSA的相互作用不仅可以获得药物的药效学信息,深入阐明药物的输送机制,也可以为药物分析提供理论参考,VER与BSA的相互作用研究尚未见文献报道。
本研究利用光谱法结合分子模拟技术研究了VER结合BSA的相互作用机制[7],由获得的光谱数据得出了它们的结合反应参数、热力学参数及药物对蛋白质构象的影响,并从分子水平上阐释VER与BSA相互作用的机制,为分析VER的药效作用机制提供一定参考。
1 材料 1.1 药品与试剂BSA(质量分数≥98%,上海华美生物工程公司);VER(质量分数为96%,百灵威科技有限公司,批号ASB-00022390-010);三羟甲基氨基甲烷(Tris,GR,百灵威科技有限公司);其他试剂均为分析纯试剂,实验用水为亚沸蒸馏去离子水。配制0.1 mol/L,pH 7.4的Tris-HCl缓冲溶液,用此缓冲液配制1.0×10-5 mol/L的BSA溶液,乙醇配制1.0×10-3 mol/L VER溶液。
1.2 仪器F-7000型荧光光度计(日本Hitachi公司);UV-2450型紫外-可见分光光度计(日本Shimadzu公司);ZD-2型精密酸度计(上海雷磁仪器厂);SGI O2计算机图形工作站,DOCK软件(4.02版本)。
2 方法 2.1 分子模拟利用SGI O2工作站上的DOCK 4.02程序包建立药物与蛋白质相互作用模型,进行分子模拟计算。受体蛋白BSA的晶体结构从PDB蛋白质晶体数据库获得,编码4F5S。ChemDraw工具构建VER的分子结构,然后基于分子力学MM2力场优化后生成实验分子模型,分子对接预处理时使用AutoDock Toolkit(ADT)进行受体与配体的优化处理。分子对接技术对配体的不同取向进行定位,以经验势能函数作为评价函数,找到配体与受体的最佳结合方式进而确认BSA活性部位。确定活性部位步骤:(1)确定VER结合活性位点;(2)在配体结合位点填充球簇以映射受体结合腔穴的性质;(3)尝试匹配不同小球中心的距离和配体中不同原子的距离,进行配体在受体活性位点处的构象搜索;(4)对配体的不同取向进行定位,以经验势能函数作为评价函数,找到配体与受体的最佳结合方式[8]。
2.2 荧光光谱与紫外光谱测定 2.2.1 BSA与VER溶液的荧光光谱测定移取2.5 mL BSA溶液于1 cm的石英比色皿中,微量进样器逐次加入1.0×10-3 mol/L VER溶液进行荧光滴定,每次加入的量分别为10、10、5、15、20、20、20 μL,Tris-HCl缓冲溶液做荧光空白校正,测定时,荧光发射与激发狭缝宽度均为2.5 nm,波长扫速1 200 nm/min,固定激发波长282 nm,室温下绘制250~900 nm的发射光谱;荧光光谱仪扫描激发波长和发射波长之间的波长差(Δλ)分别为15和60 nm的上述溶液体系的同步荧光光谱。发射与激发狭缝宽度同上,扫速240 nm/min,Tris-HCl缓冲溶液做荧光空白校正。
2.2.2 荧光偏振光谱测定固定激发波长为282 nm,先以垂直偏振光激发样品,分别检测荧光的垂直偏振分量(IVV)和水平偏振分量(IVH);再以水平偏振光激发样品,检测荧光的垂直偏振分量(IHV)和水平偏振分量(IHH),室温下绘制250~900 nm的发射光谱。
2.2.3 VER溶液的紫外光谱测定移取2.5 mL Tris-HCl缓冲溶液于1 cm石英比色皿中,用微量进样器加入1.0×10-3 mol/L VER溶液25 μL,使其终浓度为1.0×10-5 mol/L,测定500~190 nm紫外吸收光谱,中速扫描,狭缝宽度2.5 nm,缓冲溶液定基线。
3 结果与讨论 3.1 分子模拟研究分子模拟建立VER与BSA相互作用的结合反应模型时,分别考虑BSA的Sudlow’s sites I、sites II[9]、6个脂肪酸结合位点及triethylene glycol药物结合位点进行VER分子对接的模拟计算工作。分子对接VER与BSA的结合模型见图 1。
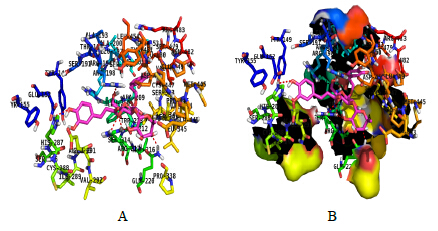 | 图 1 VER-BSA相互作用的分子对接图 (A) 及疏水表面图 (B)Fig.1 Molecular docking (A) and hydrophobic surface map (B) of VER-BSA |
由图 1可见,VER分子结合在BSA的表面活性口袋处,整个分子处于被包围状态。VER分子距BSA色氨酸残基(Trp213)、酪氨酸残基(Tyr149、Tyr155和Tyr451)及苯丙氨酸残基(Phe205)很近,这在一定程度上解释了VER能够猝灭BSA内源荧光的现象。同时,VER分子与BSA结合过程中,VER的A环上的羟基氧与His287发生氢键相互作用;VER的B环上-CH3的邻位羟基氧与Gln220发生氢键相互作用,对位羟基氧与Arg217发生氢键相互作用;C环上氧原子的间位氧(C环与B环连接位的邻位)与Arg217发生氢键相互作用,间位羟基氧与Arg194发生氢键相互作用。另一方面,VER非共价结合在BSA活性位点域,其结合口袋周围主要由Ala193、Ala200、Ala209、Ala212、Ala216、Ala290、Ala341、Leu197、Leu210、Leu345、Leu346、Leu454、Leu480、Phe205、Trp213、Ile289、Val292、Val342、Val344、Val481、Pro338、Pro446氨基酸残基形成一个疏水区域。分子模拟结果可知VER与蛋白质分子结合的主要驱动力是氢键及范德华力,同时也有疏水作用的存在,为验证VER与BSA的键合机制和键合方式,通过设计不同的光谱实验来进一步证实分子模拟的合理性。
3.2 BSA-VER的荧光光谱及结合反应机制图 2为BSA、VER及二者以等物质的量混合体系的荧光光谱。在282 nm激发波长下,VER的最大发射波长为315 nm,BSA最大发射波长为342 nm,而由VER-BSA体系的荧光光谱可以看出,VER的加入使BSA的荧光强度降低,表明VER与BSA之间存在着相互作用,发生了能量转移。
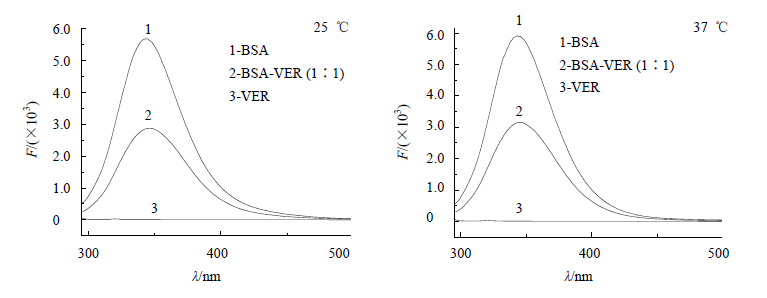 | 图 2 BSA-VER体系中各试样的荧光图谱Fig.2 Fluorescence emission spectra of each sample in BSA-VER solution system |
图 3为VER-BSA的紫外吸收差谱,可知VER-BSA等物质的量混合物与VER的差谱与BSA的紫外吸收曲线几乎完全重合,表明VER的加入并未使BSA的紫外吸收发生变化。可以初步确定VER与BSA分子的荧光猝灭机制为静态猝灭,且可见,VER在282 nm激发波长及342 nm发射波长下没有吸收,因此,可不考虑内滤光效应。
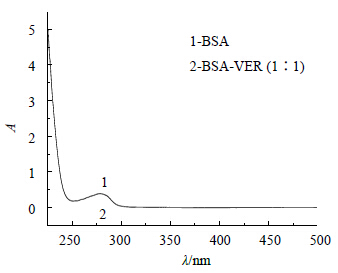 | 图 3 VER-BSA的紫外吸收差谱Fig.3 UV Absorption difference spectrum of VER-BSA |
图 4为BSA荧光发射谱随VER浓度的变化图。由图 4可知,a峰为BSA的一级荧光峰,从图中可以看出随着VER的加入,a峰逐渐降低;b峰为VER的一级荧光发射峰;c峰为Tris-HCl的二级倍频荧光峰;d峰为VER的二级倍频荧光峰。在固定BSA浓度的条件下,随着体系中VER浓度增大,BSA的荧光强度呈规律性降低,这表明VER对BSA有猝灭作用。
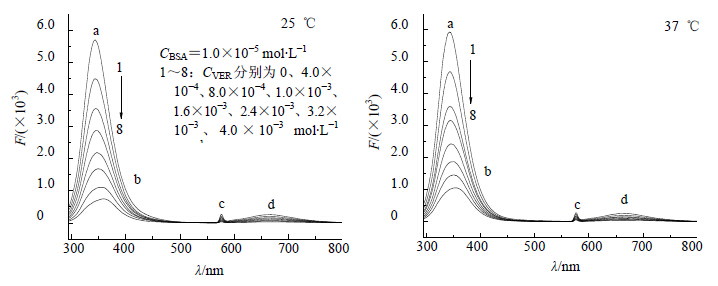 | a-BSA的一级荧光峰 b-VER的一级荧光发射峰 c-Tris-HCl的二级倍频荧光峰 d-VER的二级倍频荧光峰 a-The first level of fluorescent peak of BSA b-The first level of fluoresce emission peak of VER c-The secondary frequency doubling 图 4 BSA-VER相互作用的荧光图谱 Fig.4 Fluorescence spectra in interaction of BSA-VER |
蛋白质与药物分子相互作用的荧光猝灭过程通常包括静态猝灭与动态猝灭,动态猝灭过程遵循Stern-Volmer方程。静态猝灭是猝灭剂与荧光体分子在基态时生成不发光的复合物,由静态猝灭的实验数据可以求取结合参数。为确定VER对血清蛋白荧光的机制,首先按Stern-Volmer[10]方程处理上述体系。

由实验测得VER与BSA相互作用的荧光光谱数据,按Stern-Volmer方程处理可得图 5。
 | 图 5 VER对BSA荧光猝灭的Stern-Volmer图Fig.5 Stern-Volmer curves of BSA fluorescence quenching by VER |
由于无猝灭剂时τ0为1×10-8 s[11],则由实验数据可以通过Stern-Volmer方程计算不同温度下VER-BSA相互作用的猝灭常数KSV、Kq,计算结果见表 1。
| 表 1 BSA-VER相互作用的猝灭参数 Table 1 Quenching parameters of VER-BSA interaction |
目前生物大分子与活性小分子相互作用的荧光猝灭机制研究中,常用2种方法判定荧光猝灭机制,一种方法是比较双分子猝灭过程速率常数与猝灭剂对生物大分子最大扩散碰撞猝灭速率常数来间接判断荧光猝灭机制[12];另一种方法是通过变温实验直接推断荧光猝灭机制。本实验中,Kq值远大于2.0×1010 L/(mol∙s),说明VER对BSA的猝灭是由于形成了复合物而引起的静态猝灭。另外,为确定VER对BSA的猝灭机制,在不同温度下作VER对BSA荧光猝灭的Stern-Volmer图。从图 5可见,VER对BSA荧光猝灭的Stern-Volmer曲线有良好的线性关系,在选定浓度范围内,随着温度升高,猝灭常数呈减小趋势,进一步表明VER对BSA的猝灭机制为静态猝灭。由此2个结果可以确定VER与BSA的荧光猝灭机制为静态猝灭。另外,也有文献报道离子强度是影响猝灭机制的重要因素[13],需要考虑实验体系为离子溶液时,Kq增大很可能是离子强度影响的结果,这需要在后续研究中展开进一步验证。
3.3 VER与BSA相互作用的结合常数(K)及结合位点数(n)由实验数据分析得到VER与BSA相互作用的静态荧光猝灭机制,由荧光分子荧光强度-猝灭剂浓度关系可以得出结合参数的理论计算公式[14]。
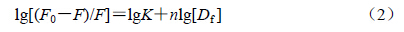
F0与F分别为猝灭剂加入前后荧光分子的相对强度,K是结合常数,n是结合位点数,[Df]为VER的游离浓度
因为加入的VER溶液体积远小于比色皿中溶液体积,可以合理采用猝灭剂的总浓度 [D] 代替[Df]。以lg[D]对lg[(F0-F)/F] 作双对数图(图 6),求得K和n,结果见表 2。
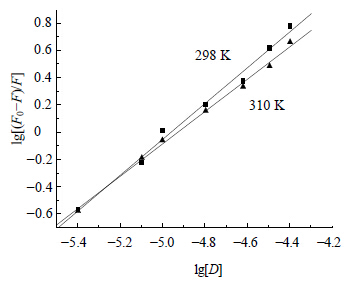 | 图 6 VER-BSA体系荧光变化线性拟合图Fig.6 Fluorescence change linear fitting of VER-BSA system |
| 表 2 BSA-VER的结合参数 Table 2 Binding parameters of VER-BSA |
图 6结合表 2可见,VER与BSA之间存在结合强度较强的相互作用,VER与BSA存在一个结合位点,说明VER分子与BSA形成了较稳定的复合物。需要说明的是,表 2中结合常数的倒数为BSA-VER结合复合物的解离参数,该解离参数的值很小,仅说明理论上BSA-VER结合较为稳固,但若在体内实际运输过程中,BSA与VER的结合或解离过程是在动态环境中进行的,会受到许多因素的影响,BSA-VER结合物的实际稳定情况需要根据具体影响因素进一步由综合实验获得,该内容有待进一步深入研究。
3.4 VER与BSA相互作用力分析药物分子与生物大分子的相互作用力类型包括氢键、范德华力、静电引力、疏水相互作用,在一定温度变化范围内,相互作用过程的ΔH可视为常数,则可以计算相互作用的热力学参数。根据(3)、(4)、(5)热力学公式[15]及式(2)求出结合常数K,求得VER与BSA结合反应的热力学函数变化值。

求得的ΔG(吉布斯自由能变)、ΔH(焓变)及ΔS(熵变)值见表 3。药物与蛋白质的分子作用机制可根据药物-生物大分子的相互作用模式判定,药物与蛋白质相互作用的类型可由如下规则确定[16]:ΔS>0时为疏水和静电作用力;ΔS<0时为氢键和范德华力;ΔH>0、ΔS>0时为典型的疏水作用力;ΔH<0、ΔS<0时为氢键和范德华力。由表 3的结果可知,VER与BSA的相互作用主要为氢键和范德华力。
| 表 3 VER-BSA的热力学参数 Table 3 Thermodynamic parameters of VER-BSA |
按照Förster非辐射能量转移机制可以求出猝灭剂分子-蛋白质分子间的能量转移效率及猝灭剂与蛋白质分子中荧光发射残基的结合距离。据此理论,荧光发射体和荧光猝灭体之间的能量转移效率(E)和两者之间的距离(r)及临界能量转移距离(R0)相关。

E为能量转移效率,R0为E=50%时的临界能量距离

K2为偶极空间取向因子,N为介质的折射指数,Φ为授体的光量子效率,J(cm3∙L/mol)为授体(蛋白)荧光发射光谱与受体(药物)吸收光谱间的光谱重叠积分
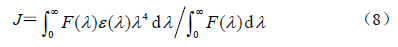
F(λ)为荧光授体在波长λ处的荧光强度,ε(λ)为受体在波长λ处的摩尔吸收系数[L/(mol∙cm)]
E则可以根据式(9)测得,由获得的UV谱及荧光光谱作重叠光谱图,见图 7。

 | 图 7 BSA的荧光发射谱 (a) 与VER的紫外吸收谱 (b) 的重叠图Fig.7 Overlap between fluorescence emission spectra of BSA (a) and UV absorption spectra of VER (b) |
从图 7可见,BSA的荧光发射谱与VER的紫外吸收谱确有部分重叠。Förster的偶极-偶极非辐射能量转移理论[17]指出,当供能体与受能体足够靠近,距离在7 nm范围内时,被激发的供能体分子将会与近邻受能体分子发生非辐射能量转移现象。如果供能体发射荧光,供能体的荧光发射光谱将与受能体的吸收谱有足够的重叠,导致供能体荧光猝灭,并由此可以求出受能体分子和供能体分子的结合距离。本实验根据公式(8)计算出BSA-VER结合反应的光谱重叠积分J=1.43×10-14 cm3∙L/mol,由公式(9)求得E=0.31。在本实验条件下,取偶极空间取向因子K2=2/3,光量子效率取色氨酸标准值Φ=0.118,折射指数N=1.336,将以上各量代入公式(7),可得到BSA的临界能量距离R0=2.72 nm,再代入公式(6)求得结合距离r为2.79 nm。r<7 nm,即BSA的氨基酸残基与VER的距离小于7 nm,符合非辐射能量转移理论,氨基酸残基可将能量以非辐射方式转移至VER,引起BSA的荧光猝灭。 3.6 VER对BSA构象的影响
蛋白质的同步荧光光谱中,Δλ=15 nm显示酪氨酸残基的荧光光谱特性,Δλ=60 nm显示色氨酸残基的荧光光谱特性。蛋白质中氨基酸残基的最大发射波长与其所处环境的极性有关,故由最大发射波长的变化可判断蛋白质构象的变化,固定BSA浓度,逐渐增加VER的浓度,可得到BSA-VER体系的同步荧光光谱(图 8)。
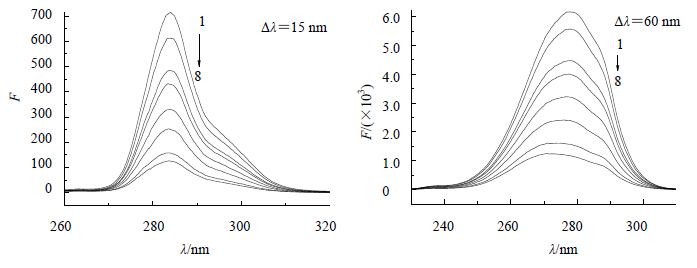 |
CBSA=1.0×10-5 mol∙L-1 1~8-CVER分别为0、4.0×10-6、8.0×10-6、1.0×10-5、1.6×10-5、2.4×10-5、3.2×10-5、4.0×10-5 mol∙L-1 CBSA=1.0×10-5 mol∙L-1 1—8-CVER is equivalent to 0、4.0×10-6、8.0×10-6、1.0×10-5、1.6×10-5< span style='font-family:宋体;letter-spacing:-.1pt'>、2.4×10-5、3.2×10-5、4.0×10-5 mol∙L-1,respectively 图 8 BSA-VER体系的同步荧光光谱Fig.8 Synchronous fluorescence spectra of VER-BSA systems |
从图 8可见,BSA的荧光主要由酪氨酸残基、色氨酸残基、苯丙氨酸残基所贡献。随着药物浓度的增大,酪氨酸残基的最大发射波长基本保持不变,图 8在290 nm处形成了一个峰,这个峰并非BSA蛋白质峰,而是VER峰,Δλ=60 nm时,色氨酸残基的最大发射波长出现了轻微蓝移现象。药物分子嵌入BSA亚结构域IIA中导致肽链的伸展势必会压缩邻近微区位域,使其肽链受到挤压,分析BSA结构,推测由于蛋白质分子的别构效应,亚结构域IIA微区肽链的伸展会影响其相邻亚结构域IIB微区的构象,致使亚结构域IIB的肽链趋于折叠,处于亚结构域IIB内的色氨酸残基会受到影响,疏水性增加,组成疏水腔的肽链处于部分紧缩状态,进而引起BSA构象发生了一定程度的变化。
3.7 BSA-VER结合反应对BSA构象型态变迁的影响为了进一步了解VER与BSA结合反应对BSA构象型态变迁的动力学机制,采用荧光相图法作进一步分析。荧光相图法是在发射波长λ1和λ2下测定蛋白质在不同实验条件下荧光强度I(λ1)和I(λ2)的变化来描述蛋白质的结构变化结果。荧光强度是一种广度性质,因此存在以下关系:
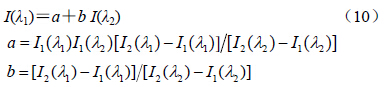
I(λ1)和I(λ2)为不同实验条件下,测定发射波长λ1和λ2的荧光强度。若式(10)表现为线性,则表示相应的蛋白质构象型态变迁过程符合“二态模型”;反之若为非线性,表明蛋白质的构象型态转变过程是一个序变过程;若式(10)表现为两条或多条直线,其中每一条直线都描述一个“全或无”的蛋白质结构变化过程,则符合“多态模型”。
本实验以I320-I365的相图反应结果最准确,图 9为根据实验数据作出的相应荧光相图。
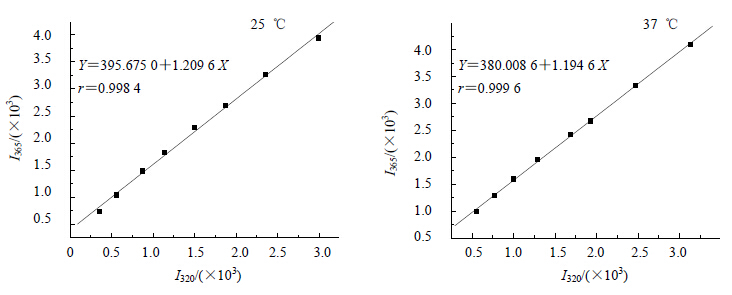 | 图 9 VER-BSA体系的荧光相图Fig.9 Fluorescence phase diagrams of VER-BSA systems |
从图 9可以看出,VER与BSA结合反应的荧光相图呈线性,说明VER与BSA发生非共价结合作用时,BSA中构象型态变迁过程不是一个序变过程,而是一个“二态”模型。
3.8 VER对BSA色氨酸微区的影响偏振荧光光谱反映的是荧光体分子在激发波长下发射波长变化的偏振光谱。偏振荧光光谱可用偏振度(P)与各向异性(r)来度量,其中P可根据下式计算[10]:

其中G为校正因子(G=IHV/IHH),IVV和IVH分别为垂直偏振光激发下的垂直偏振的发射光强度和水平偏振的发射光强度,IHV和IHH分别为水平偏振光激发下的垂直偏振发射光强度和水平偏振发射光强度。r计算公式如下:

固定BSA浓度,加入不同浓度的VER后,读取偏振荧光数据并按公式(11)、(12)计算各溶液体系的P及r,结果见表 4。
| 表 4 VER-BSA体系荧光偏振参数 Table 4 Fluorescence polarization parameters of VER-BSA systems |
荧光体的P及r与荧光体的转动速度成反比。荧光体越小,转动速度越快,其P及r就越小。由表 4数据可见,在水溶液中荧光体分子BSA转动速度较快,消偏现象严重,偏振度及各向异性较小。而BSA与VER发生相互作用后,BSA的P及r均有提高,说明药物与蛋白质分子之间存在分子间作用力,形成复合物后荧光体体积变大,分子转动受阻,旋转速度变慢,体系的黏度变大,因而荧光偏振度随之变大。实验数据定量证明了BSA与VER发生相互作用,生成了非共价复合物。
4 结论本实验利用光谱法结合分子模拟技术研究了中药活性成分VER与BSA的相互作用。分子模拟揭示了药物在BSA上的结合部位,综合实验得到热力学参数的结果,确定了两者间的作用力主要是氢键和范德华力。光谱法的结果显示VER与BSA之间的反应机制为静态猝灭。根据能量转移理论,求得VER与BSA的距离小于7 nm,说明发生了非辐射能量转移现象。VER的加入可以引起BSA构象型态的转变,且BSA的构象型态变迁符合“二态模型”。根据荧光偏振分析证明了BSA与药物确实发生了相互作用,生成了非共价复合物。实验结果与理论计算机模拟相一致。本研究不仅可为中药活性成分VER与BSA相互作用的深入研究提供有益结果,而且对于以后药物与蛋白质组,中药中多种有效成分与蛋白质分子的研究也具有一定的参考意义。同时,需要进一步说明的是人血清白蛋白与动物的血清白蛋白分子有差异,但不同种类的动物血清白蛋白与药物的实验不可或缺,本实验选择BSA为靶标蛋白质分子因其成本较低,且其与人血清白蛋白高度同源,而对于VER与人血清白蛋白的分子作用机制的研究将在后续的工作中深入开展。
| [1] | 陈微娜, 李 飞, 朱盼盼, 等. 毛蕊花糖苷对新生大鼠体外培养成骨细胞增殖与分化作用研究[J]. 海峡药学, 2012, 24(4): 23-24. |
| [2] | 高 莉, 彭晓明, 霍仕霞, 等. 毛蕊花糖苷改善D-半乳糖致亚急性衰老小鼠脑损伤的作用[J]. 中草药, 2014, 45(1): 81-85. |
| [3] | 刘 敏, 朱兰英, 曲秀葵, 等. 丹皮酚及其两种同分异构体与牛血清白蛋白相互作用的热力学研究[J]. 化学学报, 2007, 65(16): 1555-1560. |
| [4] | Wu A, Lin C, Zhai Y, et al. Investigation of the interaction between two phenylethanoid glycosides and bovine serum albumin by spectroscopic methods[J]. J Pharm Anal, 2013, 3(1): 61-65. |
| [5] | Bourassa P, Kanakis C D, Tarantilis P, et al. Resveratrol, genistein, and curcumin bind bovine serum albumin[J]. J Phys Chem B, 2010, 114(9): 3348-3354. |
| [6] | 吕 华, 单晓辉, 陈 娇, 等. 碳量子点的制备及与牛血清蛋白的相互作用[J]. 新型炭材料, 2013, 28(4): 307-312. |
| [7] | 郭 明, 许建婷, 范文翔. 松果菊苷的血清蛋白质结合机制研究[J]. 中草药, 2014, 45(9): 1270-1277. |
| [8] | 赵 琦. 基于分子对接技术的小分子-蛋白质相互作用研究[D]. 无锡: 江南大学, 2009. |
| [9] | Hu Y J, Yue H L, Li X L, et al. Molecular spectroscopic studies on the interaction of morin with bovine serum albumin[J]. J Photochem Photobiol B: Biology, 2012, 2(112): 16-22. |
| [10] | Lakowicz J R. Principles of Fluorescence Spectroscopy[M]. 3rd. Beijing: Science Press, 2008. |
| [11] | 闫晓东, 李 萍, 钱正明, 等. 三种抗氧化物质与牛血清白蛋白的相互作用[J]. 化学学报, 2007, 65(5): 421-429. |
| [12] | 王 春, 吴秋华, 王 志, 等. 槲皮素与牛血清白蛋白相互作用的研究[J]. 光谱学与光谱分析, 2006, 26(9): 1672-1675. |
| [13] | 张晓威, 赵凤林, 李克安. 环丙沙星与牛血清白蛋白相互作用的研究[J]. 高等学校化学学报, 1999, 20(7): 1063-1067. |
| [14] | 卞 伟, 卫艳丽, 王亚萍, 等. 荧光法研究咖啡因和茶碱与牛血清白蛋白相互作用[J]. 光谱学与光谱分析, 2006, 26(3): 505-508. |
| [15] | 颜承农, 张华新, 刘 义, 等. 百草枯与牛血清白蛋白结合作用的荧光光谱[J]. 化学学报, 2005, 63(18): 1727-1732. |
| [16] | Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3112. |
| [17] | Lin H, Lan J F, Guan M, et al. Spectroscopic investigation of interaction between mangiferin and bovine serum albumin[J]. Spectrochim Acta Part A, 2009, 73(5): 936-941. |
 2015, Vol. 46
2015, Vol. 46

