2. 天津市现代中药重点实验室, 天津 300193
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin 300193, China
细胞色素P450(cytochrome P450,CYP450)酶是肝脏中重要的I相药物代谢酶,在外源性及内源性物质的生物转化过程中发挥着重要作用。CYP450酶活性的改变会直接影响经其代谢的药物的药效和用药安全性。药物主要通过3种机制改变CYP450酶的活性:可逆性抑制(reversible inhibition)、基于机制抑制(mechanism-based inhibition,MBI)和诱导(induction)[1]。MBI是指药物经CYP450酶代谢生成代谢产物,该代谢产物与CYP450酶的活性中心结合,从而抑制CYP450酶的活性[2]。通过MBI介导的药酶抑制剂能够较长时间抑制CYP450酶的活性,可能引起严重的药物-药物相互作用(drug-drug interaction,DDI)[3],因此基于MBI的药酶抑制类型及其机制研究有助于预测药物在体内潜在的DDI,对中药多成分及其配伍合理性研究具有重要意义。
延胡索乙素(tetrahydropalmatine,THP)是罂粟科多年生草本植物延胡索Corydalis yanhusuo W. T. Wang的主要活性成分,具有显著的镇痛、镇静、催眠、抗心律失常、抗肿瘤等药理作用[4, 5, 6, 7, 8, 9]。THP在临床上用于治疗痉挛性疼痛、痛经、癌症疼痛等[10]。THP分子结构中有一个手性中心,分为左旋延胡索乙素[(-)-tetrahydropalmatine,(-)-THP]和右旋延胡索乙素[(+)-tetrahydropalmatine,(+)-THP]。由于药物是通过与体内的某些靶分子之间严格的手性匹配和分子识别而发挥药理作用,并以不同的途径被吸收、活化或者降解,从而导致对映体药物在体内的药理活性、代谢过程存在显著差异。正如THP对映体的药理活性不尽相同,(-)-THP阻断中枢神经系统的多巴胺受体,(+)-THP则是选择性的多巴胺受体耗竭剂,因此 (-)-THP比 (+)-THP的止痛作用更强[11]。(-)-THP又名罗通定,有良好的止痛作用,已在临床应用40多年[12]。还有研究表明,由于 (-)-THP对中枢神经系统的多巴胺受体有阻断作用,可以治疗药物成瘾性[13]。可见对手性药物对映体的深入研究与评价,有助于临床安全、有效、合理用药。
在THP代谢研究方面,THP对重组人CYP2D6有较强的抑制作用[IC50为(3.04±0.26)μmol/L],对重组人CYP3A4有一定的抑制作用[IC50为(41.5±3.8)μmol/L][14];大鼠连续ig THP( 100 mg/kg)7 d后,THP对CYP1A2的酶活性有抑制作用,对CYP3A4、CYP2E1和CYP2C9酶活性有诱导作用[15]。而THP对映体有立体选择性代谢行为。如THP对映体在大鼠肝微粒体中主要被CYP3A1/2和CYP1A2代谢,CYP3A1/2对 (+)-THP的代谢能力更强,而CYP1A2对 (-)-THP的代谢能力更强[16];THP对映体在人肝微粒体中主要被CYP3A4和CYP1A2代谢,但CYP1A2对 (+)-THP的代谢能力强于 (-)-THP,(-)-THP对CYP2D6的酶活性有抑制作用[10]。然而,THP对映体对人肝微粒体中主要的I相药物代谢酶的抑制类型及其机制尚不清楚。本研究应用Cocktial探针药物法考察THP对映体对人肝微粒体中CYP450酶活性的影响,应用人肝微粒体两步孵育法研究其对CYP450酶的抑制机制,应用时间依赖性实验考察其对CYP450酶的酶动力学参数,旨在阐明THP对映体对CYP450酶的抑制类型及其机制。
1 材料 1.1 仪器液质联用系统(API 4000 Qtrap,SER. N:AR26221101,岛津LC-20AD泵;SIL-20AC恒温自动进样器,CTO-20A柱温箱,CBM-20A控制器,ESI离子源;Analyst Software 1.5.2色谱工作站,美国应用生物系统公司);ALLEGRA-64R高速离心机(美国BECKMAN公司);WH-3微型旋涡混合仪(上海沪西分析仪器厂有限公司);AX205十万分之一天平(瑞士Mettler Toledo公司);DKB-501A型超级恒温水槽,上海精宏实验设备有限公司。
1.2 药品与试剂(-)-THP、(+)-THP、非那西丁(phenacetin,PHE)、对乙酰氨基酚(paracetamol,PAR)、甲苯磺丁脲(tolbutamide,TOL)、4-羟基甲苯磺丁脲(4-hydroxytolbutamide,OHTOL)、右美沙芬(dextromethorphan,DEXM)、去甲右美沙芬(dextrorphan,DEXP)、咪达唑仑(midazolam,MDZ)、1-羟基咪达唑仑(1-hydroxymidazolam,OHMDZ)、氯唑沙宗(chlorzoxazone,CHL)、6-羟基氯唑沙宗(6-hydroxychlorzoxazone,OHCHL)、美芬妥因(mephenytoin,MEP)、4-羟基美芬妥因(4-hydroxymephenytoin,OHMERP)、卡马西平(内标)均购自中国食品药品检定研究院;还原型辅酶II(NADPH)和二甲基亚砜(DMSO)购自于美国Sigma公司;人肝微粒体,购自瑞德肝脏疾病研究(上海)有限公司,批号SUBK;甲醇、乙腈为色谱纯,购于天津康科德科技发展有限公司;其他溶剂和化学试剂均为分析纯或以上。
2 方法 2.1 THP对映体对人肝微粒体CYP450酶活性的影响 2.1.1 Cocktail探针药物法的建立根据文献报道方法[17],本实验室对其方法进行了改进[18],其中CYP1A2的底物为PHE,CYP2C9的底物为TOL,CYP2C19的底物为MEP,CYP3A4的底物为MDZ,CYP2E1的底物为CHL,CYP2D6的底物为DEXM。色谱柱为Agilent Zorbax XDB-C18(50 mm×2.1 mm,3.5 μm,SN:USHP004037);进样量10 μL;检测波长280 nm;体积流量0.45 mL/min;流动相为0.1%甲酸(A)-甲醇(B),梯度洗脱程序:0~0.5 min,98% A;0.5~1 min,98%~2% A;1~2.5 min,2% A;2.5~2.51 min,2%~98% A;2.51~4.0 min,98% A。离子源:电子轰击式离子源(ESI);气帘气体为137.9 kPa(20 psi);离子喷射电压(IS):5 000 V(ESI+)、-4 200 V(ESI-);源内气体1(Gas 1)和源内气体2(Gas 2)分别为379.225 kPa(55 psi)和344.75 kPa(50 psi),离子源温度为550 ℃。待测成分和内标的质谱检测参数见表 1。
| 表 1 CYP450酶各亚型代谢产物和内标卡马西平的质谱检测参数 Table 1 MS parameters for CYP450 enzyme metabolites of each subtype and internal standard carbamazepine |
所有的孵育反应均在37 ℃水浴上进行。预孵育体系的总体积为200 μL,包含0.1 mol/L的磷酸盐缓冲液(pH 7.4),2 mg/mL人肝微粒体蛋白,(-)-THP(终浓度50、5 μmol/L)或 (+)-THP(终浓度50、5 μmol/L),在加入NADPH[(+)NADPH]1 mmol/L或者不加入NADPH[(-)NADPH](用同等体积的PBS代替)的情况下分别预孵育30 min。然后对预孵育30 min的样品进行10倍稀释,即取20 μL预孵育样品加入到含有100 μL NADPH(1 mmol/L)和80 μL混合探针底物[PHE、TOL、DEXM、CHL、MDZ、MEP(10、100、2.5、20、5、20 μmol/L)]的体系中,孵育15 min后,加 入400 μL冰甲醇(含有内标卡马西平,75 ng/mL)终止反应。10 000×g离心5 min,取上清液,应用本实验室建立的Cocktail探针药物法定量分析相应的6种代谢产物PAR、OHTOL、DEXP、OHCHL、OHMDZ、OHMERP。
2.2 (-)-THP对人肝微粒体CYP2D6抑制机制研究 2.2.1 LC-MS/MS法测定DEXM的代谢产物(DEXP)色谱柱为Agilent Zorbax XDB-C18(50 mm×2.1 mm,3.5 μm,SN:USHP00403 7);进样量10 μL;体积流量0.5 mL/min;流动相为0.1%甲酸(A)-甲醇(B),梯度洗脱程序:0~0.8 min,90% A;0.8~1.3 min,90%~2% A;1.3~2.5 min,2% A;2.5~2.51 min,2%~90% A;2.51~4.0 min,90% A。离子源:电子轰击式离子源(ESI);气帘气体为103.425 kPa(15 psi);离子喷射电压(IS):5 000 V(ESI+);源内气体1(Gas 1)和源内气体2(Gas 2)分别为379.225 kPa(55 psi)和344.75 kPa(50 psi),离子源温度为500 ℃。待测成分DEXP和内标的质谱检测参数见表 1。
2.2.2 人肝微粒体孵育反应所有的孵育反应均在37 ℃水浴上进行。预孵育体系的总体积为100 μL,包含0.1 mol/L的磷酸盐缓冲液(PBS,pH 7.4),2 mg/mL人肝微粒体蛋白,(-)-THP(终浓度0、0.027 4、0.082 3、0.246 9、0.740 7、2.222 1、6.666 7、20.000 0 μmol/L),在 (+)-NADPH 1 mmol/L或者 (-)NADPH(用同等体积的PBS代替)的情况下预孵育30 min。然后对预孵育的样品进行10倍的稀释,即取20 μL预孵育样品加入到含有100 μL NADPH(1 mmol/L)和80 μL DEXM(5 μmol/L)的体系中,孵育15 min后,加入400 μL冰甲醇(含有内标卡马西平,75 ng/mL)终止反应。10 000 ×g离心5 min,取上清,用LC-MS/MS法定量分析DEXP。
2.3 (-)-THP对人肝微粒体CYP2D6的时间依赖性抑制研究所有的孵育反应均在37 ℃水浴上进行。预孵育体系的总体积为100 μL,包含0.1 mol/L的PBS(pH 7.4),2 mg/mL人肝微粒体蛋白,(-)-THP(终浓度0、0.25、5、10 μmol/L),1 mmol/L NADPH,预孵育0、2、4、8、16、30 min。对预孵育的样品进行10倍稀释,即取20 μL预孵育样品加入到含有100 μL NADPH(1 mmol/L)和80 μL DEXM(50 μmol/L)的体系中,孵育15 min后,加入400 μL冰甲醇(含有内标卡马西平,75 ng/mL)终止反应。10 000 ×g离心5 min,取上清,用LC-MS/MS法定量分析DEXP。
2.4 数据处理代谢速率(v)计算公式:v=(V孵育×C产物)/ (V孵育×C肝微粒体),其中V孵育为孵育体系的体积;C产物为测定的代谢产物浓度;C肝微粒体为孵育体系中人肝微粒体蛋白的质量浓度。代谢速率百分数(relative activity,RA)计算公式:RA=v药物/v对照,其中v药物和v对照分别为加入受试药物的代谢速率及未加入受试药物的代谢速率;抑制百分数(inhibition percent,IP)计算公式:IP=100-RA。
通过GraphPad Prism version 5.0(GraphPad software Inc,CA,美国)软件拟合出药物对酶活性的IC50值。根据文献报道[19],获得酶抑制动力学参数。Kobs为抑制剂浓度为 [I] 时的抑制速率常数,Kinact为最大抑制速率常数,Ki为最大抑制速率常数一半时的抑制剂浓度,Ki值越小,表明药物对酶的抑制能力越强。P<0.05表明经统计学分析有显著性差异。
1/Kobs=Ki/Kinact×1/[I]+1/Kinact
3 结果 3.1 THP对映体对人肝微粒体CYP450酶的抑制作用实验结果表明,(-)-THP体外对人肝微粒体CYP2D6有明显的抑制作用,并表现出一定的浓度依赖性(图 1)。未加入NADPH预孵育组,(-)-THP在50、5 μmol/L对CYP2D6的IP分别为53.27%、26.80%;加入NADPH预孵育组,(-)-THP在50、5 μmol/L对CYP2D6的IP分别为87.38%、71.30%。可以看出,在加入NADPH预孵育后,(-)-THP对CYP2D6的抑制能力明 显增强,且(-)-THP代谢产物的抑制能力明显大于 (-)-THP,预测 (-)-THP对CYP2D6可能是MBI[19]。(+)-THP体外对人肝微粒体CYP2C9、CYP1A2、CYP2D6、CYP2E1、CYP3A4和CYP2C19的抑制作用均不明显(图 2)。
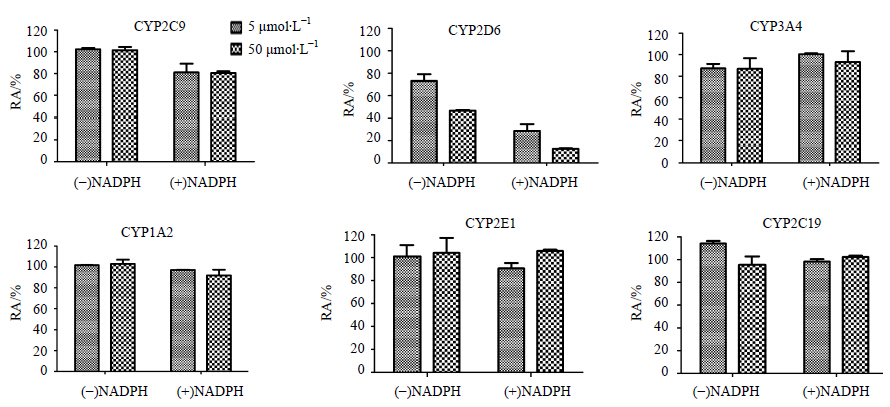 | 图 1 (-)-THP对6种CYP450酶各亚型酶活性的影响 (x±s,n=3)Fig.1 Effect of (-)-THP on enzyme activities of six kinds of CYP450 in each subtype (x±s,n=3) |
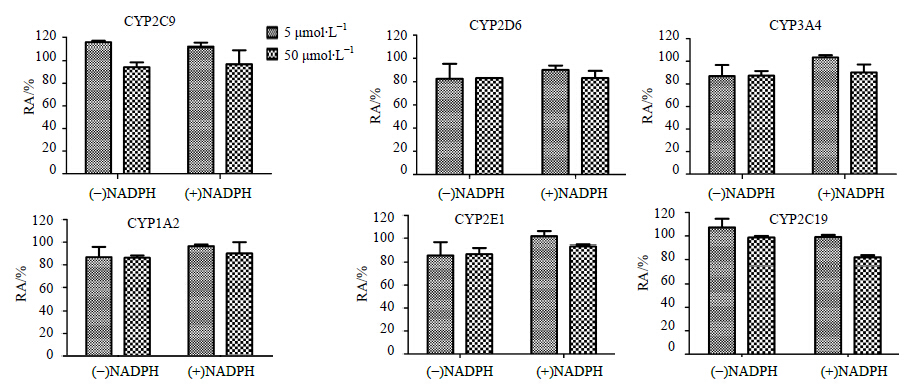 | 图 2 (+)-THP对6种CYP450酶各亚型酶活性的影响 (x±s,n=3)Fig.2 Effect of (+)-THP on enzyme activities of six kinds of CYP450 in each subtype (x±s,n=3) |
根据文献报道[1, 20],研究抑制剂对CYP450酶的抑制机制是否为MBI,主要通过(+)NADPH或(-)NADPH分别预孵育后,该抑制剂对CYP450酶IC50值的变化进行判断。若 (+)NADPH或 (-)NADPH预孵育后IC50值无差异变化,则表明其抑制类型为直接抑制,即该抑制剂本身直接抑制CYP450酶的活性;反之,若IC50值显著改变(IC50(-)NADPH/IC50(+)NADPH>3),则表明其抑制类型为MBI,即该抑制剂通过产生的代谢产物抑制CYP450酶的活性。如图 3所示,(+)NADPH预孵育时,(-)-THP对CYP2D6的抑制曲线有明显的左移现象;(-)NADPH、(+)NADPH预孵育后 (-)-THP对CYP450酶的IC50值分别为(2.40±0.12)、(0.46±0.15)μmol/L(P<0.05,配对t检验),IC50(-)NADPH/IC50(+)NADPH比值为5.22,表明 (-)-THP对CYP2D6的抑制类型为MBI。
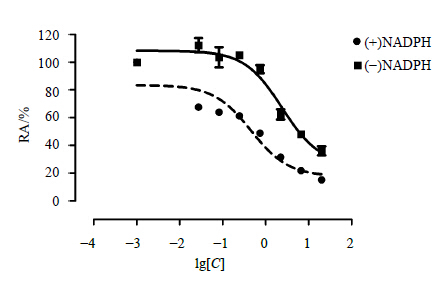 | 图 3 (-)-THP对CYP2D6的抑制曲线 (x±s,n=3)Fig.3 Inhibition curve of (-)-THP on CYP2D6 (x±s,n=3) |
为了进一步研究(-)-THP对人肝微粒体CYP2D6的抑制特性,进行了时间依赖性研究。结果见图 4,各直线的负斜率为不同浓度下的Kobs,随着抑制剂 (-)-THP浓度的增加,Kobs随之增加。在 (-)-THP浓度为0 μmol/L时,Kobs接近为零,进行双倒数作图,求得酶抑动力学参数Ki和Kinact分别为0.690 μmol/L、0.084 6 min-1。
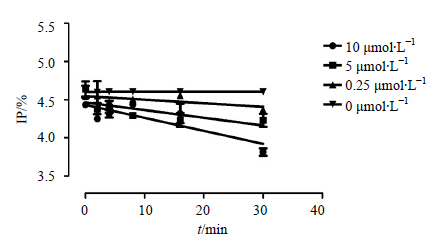 | 图 4 (-)-THP对CYP2D6的时间依赖性抑制作用Fig.4 Time-dependent inhibition of (-)-THP on CYP2D6 |
临床使用的药物中很多为手性药物的外消旋体。在生物体内,药物将处于由生物大分子构成的高度复杂的手性环境中。药物在体内吸收、分布、代谢、排泄过程中大多涉及到与这些生物大分子的相互作用,导致对映体药物在体内的药理活性、代谢过程、药物相互作用等方面存在显著差异。由药物代谢引起的DDI发生率较高,药物对CYP450酶的抑制作用已经成为最常见的导致严重DDI原因之一[21, 22]。
MBI介导的药酶抑制剂能够与细胞内或者线粒体蛋白形成共价键结合,与其他药物联合应用时会产生DDI,严重者甚至引起药物性肝损伤[23, 24]。例如咪拉地尔是钙通道阻滞剂,是CYP3A4的MBI抑制剂,由于其在临床上与他汀类药物、调血脂药物联合应用时产生严重的DDI,1988年在美国市场上撤销[25];帕罗西汀是选择性5-羟色胺抑制剂,广泛应用于抗抑郁症,是CYP2D6的MBI抑制剂,其对CYP2D6的酶抑动力学参数Ki和Kinact分别为4.84 μmol/L和0.17 min-1,在临床应用过程中引起急性肝炎[26, 27]。有文献报道 (-)-THP在临床应用上有毒副作用,例如儿童应用会出现抑制神经中枢、呼吸系统等毒副作用,成年人常规应用会引起急性或者慢性肝炎[28, 29]。健康志愿者单次口服 (-)-THP 60 mg后血浆中 (-)-THP的达峰浓度(Cmax)为1.12 μmol/L(397.7 μg/L);单次口服 (-)-THP 50 mg后血浆中 (-)-THP的Cmax为0.85 μmol/L(300 ng/mL)[30, 31]。本研究结果显示,(-)-THP对CYP2D6的抑制机制是MBI,酶抑动力学参数Ki和Kinact分别为0.69 μmol/L和0.08 min-1,提示 (-)-THP可能是比帕罗西汀更强的CYP2D6的MBI抑制剂,其潜在的临床DDI不容忽视;并且 (-)-THP在人体中的血药浓度可能已达到抑制CYP2D6酶活性水平(成人常用量:一次30~60 mg,3次/d),因此推测 (-)-THP对肝脏的毒副作用机制很可能与其对CYP2D6的MBI有关,提示在临床 (-)-THP的应用中,应强烈关注其与CYP2D6的底物、抑制剂或者诱导剂同时使用诱发潜在DDI的可能性。
| [1] | Venkatakrishnan K, Obach R S, Rostami-Hodjegan A. Mechanism-Based inactivation of human cytochrome P450 enzymes and the prediction of drug-drug interactions[J]. Xenobiotica, 2007, 37(10/11): 1225-1256. |
| [2] | Watanabe A, Nakamura K, Okudaira N, et al. Risk assessment for drug-drug interaction caused by metabolism-based inhibition of CYP3A using automated in vitro assay systems and its application in the early drug discovery process[J]. Drug Metab Dispos, 2007, 35(7): 1232-1238. |
| [3] | Nishiya Y, Hagihara K, Ito T, et al. Mechanism-based inhibition of human cytochrome P450 2B6 by ticlopidine, clopidogrel, and the thiolactone metabolite of prasugrel[J]. Drug Metab Dispos, 2009, 37(3): 589-593. |
| [4] | Gao J L, He T C, Li Y B, et al. A traditional Chinese medicine formulation consisting of Rhizoma corydalis and Rhizoma Curcumae exertssynergistic anti-tumor activity[J]. Oncol Rep, 2009, 22(5): 1077-1083. |
| [5] | Choi J G, Kang S Y, Kim J M, et al. Antinociceptive Effect of Cyperi rhizoma and Corydalis tuber extracts on neuropathic pain in rats[J]. Korean J Physiol Pharmacol, 2012, 6(6): 387-392. |
| [6] | Ling H, Wu L, Li L. Corydalis yanhusuo rhizoma extract reduces infarct size and improves heart function during myocardial ischemia/reperfusion by inhibiting apoptosis in rats[J]. Phytother Res, 2006, 20(6): 448-453. |
| [7] | 王 萍, 窦志英, 孙 巍, 等. 延胡索炮制工艺规范[J]. 天津中医药大学学报, 2009, 28(1): 27-29. |
| [8] | 贺 凯, 高建莉, 赵光树. 延胡索化学成分、药理作用及质量控制研究进展[J]. 中草药, 2007, 38(12): 1909-1912. |
| [9] | 廖正根, 万彦婷, 梁新丽, 等. 延胡索与白芷组分配伍对延胡索乙素在大鼠肝微粒体中酶促反应动力学的影响[J]. 中草药, 2011, 42(9): 1783-1787. |
| [10] | Sun S Y, Wang Y Q, Li L P, et al. Stereoselective interaction between tetrahydropalmatine enantiomers and CYP enzymes in human liver microsomes[J]. Chirality, 2013, 25(1): 43-47. |
| [11] | Zhu X Z. Development of natural products as drugs acting on central nervous system[J]. Mem Inst Oswaldo Cruz, 1991, 86(2): 173-175. |
| [12] | 林庆辉, 庄笑梅, 邓婧婷, 等. 罗通定和羟考酮体外代谢的相互作用[J]. 中国药理学与毒理学杂志, 2009, 23(5): 404-410. |
| [13] | Yue K, Ma B, Ru Q, et al. The dopamine receptor antagonist levo-tetrahydropalmatine attenuates heroin self-administration and heroin-induced reinstatement in rats[J]. Pharmacol Biochem Behav, 2012, 102(1): 1-5. |
| [14] | Zhao Y, Hellum B H, Liang A, et al. The in vitro inhibition of human CYP1A2, CYP2D6 and CYP3A4 by tetrahydropalmatine, neferine and berberine[J]. Phytother Res, 2012, 26(2): 277-283. |
| [15] | 张寅瑛. 四氢原小檗碱同类物手性药代动力学及代谢研究[D]. 上海: 第二军医大学, 2012. |
| [16] | Zhao M, Li L P, Sun D L, et al. Stereoselective metabolism of Tetrahydropalmatine enantiomers in rat liver microsomes[J]. Chirality, 2012, 24(5): 368-373. |
| [17] | He F, Bi H C, Xie Z Y, et al. Rapid determination of six metabolites from multiple cytochrome P450 probe substrates in human liver microsome by liquid chromatography/mass spectrometry: application to high-throughput inhibition screening of terpenoids[J]. Rapid Commun Mass Spectrom, 2007, 21(5): 635-643. |
| [18] | 马叶涛, 俸 珊, 赵谨怡, 等. 单探针与混合探针底物法在细胞色素酶底物酶促动力学中的比较研究实验研究[J]. 天津中医药大学学报, 2013, 32(4): 206-210. |
| [19] | Obach R S, Walsky R L, Venkatakrishnan K. Mechanism-based inactivation of human cytochrome P450 enzymes and the prediction of drug-drug interactions[J]. Drug Metab Dispos, 2007, 35(2): 246-255. |
| [20] | Grimm S W, Einolf H J, Hall S D, et al. The conduct of in vitro studies to address time-dependent inhibition of drug-metabolizing enzymes: A perspective of the pharmaceutical research and manufacturers of America[J]. Drug Metab Dispos, 2009, 37(7): 1355-1370. |
| [21] | 刘彦卿, 洪燕君, 曾 苏. 代谢性药物-药物相互作用的研究进展[J]. 浙江大学学报, 2009, 38(2): 215-224. |
| [22] | Sun M, Tang Y, Ding T, et al. Inhibitory effects of celastrol on rat liver cytochrome P450 1A2, 2C11, 2D6, 2E1 and 3A2 activity[J]. Fitoterapia, 2014, 92: 1-8. |
| [23] | Zhou S F, Chan E, Duan W, et al. Drug bioactivation, covalent binding to target proteins and toxicity relevance[J]. Drug Metab Rev, 2005, 37(1): 41-213. |
| [24] | Walgren J L, Mitchell M D, Thompson D C. Role of metabolism in drug-induced idiosyncratic hepatotoxicity[J]. Crit Rev Toxicol, 2005, 35(4): 325-361. |
| [25] | Watanabe A, Nakamura K, Okudaira N, et al. Risk assessment for drug-drug interaction caused by metabolism-based inhibition of CYP3A using automated in vitro assay systems and its application in the early drug discovery process[J]. Drug Metab Dispos, 2007, 35(7): 1232-1238. |
| [26] | Pompili M, Tittoto P, Mascianà R, et al. Acute hepatitis associated with use of paroxetine[J]. Intern Emerg Med, 2008, 3(3): 275-277. |
| [27] | Bertelsen K M, Venkatakrishnan K, Von Moltke L L, et al. Apparent mechanism-based inhibition of human CYP2D6 in vitro by paroxetine: comparison with fluoxetineand quinidine[J]. Drug Metab Dispos, 2003, 31(3): 289-293. |
| [28] | Li L, Ye M, Bi K, et al. Liquid chromatography-tandem mass spectrometry for the identification of L-tetrahydropalmatine metabolites in Penicillium janthinellum and rats[J]. Biomed Chromatogr, 2006, 20(1): 95-100. |
| [29] | Wang C, Zhou J, Wang S, et al. Shotgun approach based comparative proteomic analysis of levo-tetrahydropalmatine-induced apoptosis in hepatocytes[J]. Toxicol Lett, 2010, 194(1/2): 8-15. |
| [30] | 唐 裕, 余 勤, 南 峰, 等. 液相色谱-串联质谱法同时测定人血浆中罗通定、舒必利浓度[J]. 质谱学报, 2008, 29(1): 13-17. |
| [31] | 陈 燕, 郝光涛, 高洪志, 等. HPLC-MS/MS测定人体血浆和尿液中罗通定的浓度[J]. 中南药学, 2012, 10(4): 279-283 |
 2015, Vol. 46
2015, Vol. 46



