2. 中国中医科学院西苑医院, 北京 100091;
3. 中央民族大学生命与环境科学学院, 北京 100081;
4. 中国中医科学院中医药信息研究所, 北京 100700
2. Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China;
3. College of Life and Environmental Sciences, Minzu University of China, Beijing 100081, China;
4. Institute of Information on Traditional Chinese Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China
血管性痴呆(vascular dementia,VD)是由一系列脑血管因素引起的脑组织血液循环障碍、脑部机能减退而致的一种认知功能缺损综合征。流行病调查结果显示,到2040年全世界发展中国家痴呆患者将达到8.11千万人,其中VD患者约占30%[1]。在西方发达国家VD的发病率在1%~4%,在中国VD的发病率也达到0.8%,且65岁以上老人VD发病率正在以指数形式增长[2]。
天珠散是土家族常用补脑方剂,由头顶一颗珠(延龄草)与天麻组成,具补虚强体、镇静安神、祛风散痰、补脑安神之效。土家族医学在“毒气”理论指导下,认为“玍毒内生,脑筋不用”是VD的发病机制[3],天珠散以“治病先除毒”“毒去则体安”为治则,属土家族“治毒药”范畴。前期研究已证实天珠散对D-半乳糖致拟痴呆小鼠具有一定治疗作用,表现为增强模型小鼠学习记忆能力,增加脑组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力[4]。本实验拟在脑缺血所致学习记忆障碍大鼠模型上进一步评价天珠散药效,并初步分析其作用机制。
1 材料 1.1 药物天珠散超微粉由天麻、延龄草组成,药材购于河北省安国市药材市场,由北京中医药大学中药生药系杨瑶珺教授鉴定分别为兰科天麻属多年生草本植物天麻Gastrodia elata Bl. 的干燥块茎、百合科植物延龄草Trillium tschonoskii Maxim. 的干燥根茎,药材由济南倍力粉技术有限公司制备超微粉(300目);尼莫地平片(批号130355),亚宝药业集团股份有限公司。
1.2 实验动物SD大鼠,体质量190~210 g,雄性,北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001,常规饲养,适应性喂养3 d后用于实验。
1.3 仪器Morris水迷宫视频跟踪分析系统、Morris水迷宫跟踪分析系统2.0,成都泰盟科技有限公司;Olympus IX81倒置荧光显微镜,奥林巴斯株式会社;KEDEE KD-BM生物组织包埋机,浙江省金华市科迪仪器设备有限公司;LEICA RM2016组织切片机,德国徕卡公司;Image-Pro Plus 6.0图像处理软件。
1.4 试剂突触素-1(SYN-1)、微管相关蛋白2(MAP-2)小鼠IgG免疫组化试剂盒SABC即用型、兔IgG免疫组化试剂盒SABC即用型,武汉博士德生物工程有限公司。
2 方法 2.1 脑缺血所致学习记忆障碍大鼠模型制备实验动物禁食不禁水12 h,10%水合氯醛ip麻醉(0.35 mL/100 g,0.35 g/kg),双侧颈总动脉永久结扎复制脑缺血所致学习记忆障碍大鼠模型,假手术组大鼠只分离颈总动脉,不结扎[5]。
2.2 分组及给药除假手术组大鼠外,其他动物随机分为5组:模型组、尼莫地平组(20 mg/kg)[6]、天珠散超微粉低、中、高剂量(按体质量换算法依据临床用量折算,分别为312、625、1 250 mg/kg)组,造模2 d后,给药组ig给予相应药物(1 mL/100 g),假手术组与模型组给予等体积蒸馏水。每天1次,共63 d。
2.3 Morris水迷宫实验给药第56天,进行Morris水迷宫实验,水温21~22 ℃、空气湿度44%、室温25 ℃保持不变。隐藏平台获得实验:水池分为4个象限,平台放于第3象限,分别于第1、2、4象限入水,记录大鼠在60 s内成功进驻平台并滞留其上5 s所需时间和游泳路径;共计训练12次,分5 d进行,计算大鼠逃避潜伏期及游泳路径平均值。空间搜索实验:撤除平台后观察并记录60 s内各组大鼠的平台象限游泳时间与总游泳时间比值、平台象限游泳距离占总游泳距离比值、穿过原平台所在位置次数。
2.4 取材 第63天给药结束1h后,大鼠以10%水合氯醛麻醉(0.35 g/kg),经10%甲醛溶液心脏灌注固定,取全脑保存于10%甲醛溶液中。
2.5 HE、Nissl染色大鼠脑冠状位取视交叉向尾端3~4 mm组织块,依次采用60%、75%、85%、95%、100%乙醇脱水,二甲苯透明,65 ℃恒温下,浸蜡,包埋。切片厚5 mm,脱蜡复水,HE染色切片苏木精液染色10 min,0.5%伊红液染色2 min,Nissl染色液5 min,切片脱水透明,中性树胶封固。
2.6 免疫组织化学染色大鼠脑冠状切片,梯度乙醇脱蜡入水,3% H2O2室温避光10 min,0.01 mol/L枸橼酸缓冲盐溶液内用微波炉中高火加热7 min,共2次,进行抗原修复,自然冷却,PBS清洗2次,5% BSA、37 ℃、20 min,甩干;一抗(MAP-2稀释比例1∶300,SYN-1稀释比例1∶200)4 ℃过夜,二抗37 ℃、20 min,SABC 37 ℃、20 min,DAB室温染色(MAP-2染色90 s,SYN-1染色2 min),苏木素2 min,脱水固封。Image-Pro Plus 6.0进行图像分析处理。
2.7 统计学分析数据以x±s表示,采用IBM SPSS Statistics 20.0软件进行单因素方差分析,数据方差不齐时,将数据进行对数处理后,再进行单因素方差分析。
3 结果 3.1 对大鼠学习记忆能力的影响Morris水迷宫训练第2~5天,与假手术组比较,模型组大鼠逃避潜伏期明显增加(P<0.05、0.01),且第4、5天模型组大鼠逃避路程明显长于假手术组(P<0.01),提示模型大鼠学习记忆能力下降。与模型组比较,尼莫地平和天珠散能明显缩短大鼠的逃避潜伏期(P<0.05、0.01),且第4天各给药组大鼠的逃避路程也明显缩短(P<0.01),结果见表 1和2。天珠散中剂量组与模型组比较,空间搜索实验大鼠穿过原来平台位置的次数明显增加(P<0.05),结果见表 3。
| 表 1 天珠散对脑缺血所致学习记忆障碍大鼠Morris水迷宫实验逃避潜伏期的影响 (x±s) Table 1 Effect of TZS on escape latent period of rats with learning and memory impairment induced by cerebral ischemia in Morris water maze experiment (x±s) |
| 表 2 天珠散对脑缺血所致学习记忆障碍大鼠Morris水迷宫实验逃避路程的影响 (x±s) Table 2 Effect of TZS on escape distances of rats with learning and memory impairment induced by cerebral ischemia inMorris water maze experiment (x±s) |
| 表 3 天珠散对脑缺血所致学习记忆障碍大鼠空间搜索实验的影响(x±s) Table 3 Effect of TZS on spatial probe experiment of ratswith learning and memory impairment induced by cerebral ischemia (x±s) |
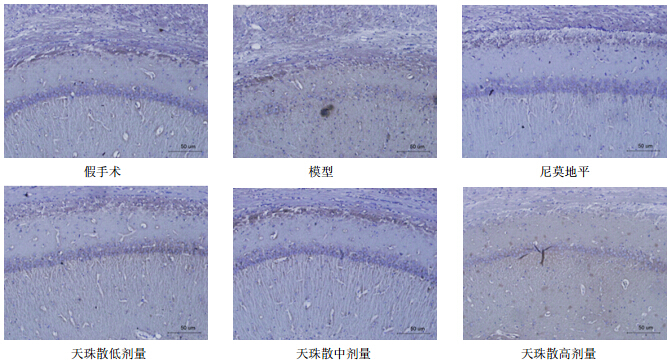
HE染色表明,假手术组大鼠海马区神经细胞排列紧密,细胞结构完整;模型组大鼠海马区神经细胞排列不规则,可见细胞破裂,海马CA1区、CA3区完整神经细胞数明显减少(P<0.05、0.01);与模型组比较,尼莫地平组与天珠散中、高剂量组大鼠海马CA1区、CA3区的完整神经细胞数明显增加(P<0.05、0.01),见表 4和图 1。
| 表 4 各组大鼠海马区完整神经细胞数量比较(x±s) Table 4 Comparision on number of intact neuronal cells in hippocampus of rats in each group (x±s) |
 | 图 1 天珠散对脑缺血所致学习记忆障碍大鼠海马组织CA1区神经细胞的影响Fig. 1 Effect of TZS on neuronal cells in hippocampus CA1 area of rats with learning and memory impairment induced by cerebral ischemia |
Nissl染色显示,与假手术组比较,模型组大鼠海马区可见细胞散乱堆积,大小不一,出现破裂,尼氏体积分吸光度明显减少(P<0.01);与模型组比较,尼莫地平组大鼠尼氏体积分吸光度明显增加(P<0.01),天珠散高剂量也能增加大鼠海马区尼氏体积分光密度(P<0.01),天珠散低剂量、中剂量可使大鼠海马CA1区尼氏体积分吸光度增加(P<0.05、0.01),见表 5和图 2。
| 表 5 各组大鼠海马区尼氏体积分吸光度值比较 (x±s) Table 5 Comparision on integral optical density of Nissl bodies in hippocampus of rats in each group (x±s) |
 | 图 2 天珠散对脑缺血所致学习记忆障碍大鼠海马组织CA1区尼氏体量的影响Fig. 2 Effect of TZS on level of Nissl bodies in hippocampus CA1 area of rats with learning and memory impairment induced |
与假手术组比较,模型组大鼠海马区MAP-2蛋白在CA3区、齿状回区的表达面积和积分吸光度均明显下降(P<0.05、0.01),CA1区表现为降低趋势;与模型组比较,尼莫地平能显著增加大鼠海马组织CA1区MAP-2的量(P<0.05),天珠散则能增加MAP-2表达趋势,结果见表 6和图 3。
| 表 6 各组大鼠海马区MAP-2表达面积和积分吸光度值 (x±s) Table 6 Expression area and integral optical density of MAP-2 in hippocampus of rats in each group (x±s) |
 | 图 3 各组大鼠海马区MAP-2表达Fig. 3 Expression of MAP-2 in hippocampus of rats in each group |
与假手术组相比,模型组大鼠SYN-1表达面积与积分吸光度在CA1区、齿状回的表达增加,其他给药组略有下降,CA3区模型组大鼠SYN-1的表达面积和积分吸光度低于假手术组,而给药组较模型组有增加趋势,与模型组相比,在齿状回区天珠散中、高剂量SYN-1的积分吸光度值明显增加(P<0.05、0.01),见表 7和图 4。
| 表 7 各组大鼠海马区SYN-1表达面积和积分吸光度(x±s) Table 7 Expression area and integral optical density of SYN-1 in hippocampus of rats in each group (x±s) |
 | 图 4 各组大鼠海马区SYN-1表达Fig. 4 Expression of SYN-1 in hippocampus of rats in each group |
在我国,民族药可定义为我国少数民族使用的,以本民族传统医药理论和实践为指导的植物、动物及矿物类药材,其也包括少数民族习惯使用的天然药物,具有鲜明的地域性和民族传统[7]。民族药研究应尊重民族药形成的规律和特点,充分考虑到民族药所蕴含的医学理论与经验内核,并积极寻找民族医药理论与现代疾病认识的契合,本研究从以土家族医学“脑衰”病“玍毒内生,脑筋不用”病机与VD病理特征关联分析切入,实现土家族医学理论对现代疾病的认识溯源,作为天珠散药效研究方向的基础。
本研究发现,天珠散能改善脑缺血所致学习记忆障碍大鼠的非陈述性记忆能力[8],抑制其海马区神经细胞损伤,表现为缩短大鼠Morris水迷宫逃避潜伏期,增加大鼠单位时间内通过原平台位置次数;减少海马区神经细胞破裂、肿胀,使细胞排列更加紧密、规则;且能通过增加尼氏体量,促进神经递质的合成,保护脑组织,降低脑缺血所致学习记忆障碍的发生率。
MAP-2主要是神经生长和修复相关蛋白,是研究神经再塑的分子标志物,在神经细胞成核、微丝或微管的稳定性及细胞器在轴突和树突间的传递中起到重要作用[9],MAP-2免疫活性下降可造成微管性堆积,影响细胞骨架的完整,最终导致神经元死亡[10]。SYN-1是突触前膜的特异性标分子,不仅是突触的结构和功能标志,也对突触发生、成熟起着重要的作用,且海马CA3区突触可塑性与空间辨别性学习记忆活动密切相关[11, 12]。神经细胞的损伤会导致MAP-2和SYN-1蛋白的表达发生变化,天珠散能提高脑缺血所致学习记忆障碍大鼠海马组织MAP-2表达,促进神经发育和轴突再生,促进学习记忆障碍大鼠被破坏的海马组织快速修复,维持正常细胞形态,进而提高其在水迷宫实验中的对空间物体的学习记忆能力;并通过调节SYN-1在CA3及齿状回的表达,增加突触素水平,减轻脑组织因缺血造成的记忆功能损伤,进一步提高大鼠的学习记忆能力。
氧化应激(oxidative stress)在中枢神经系统退行性疾病的发病机制中起重要作用,机体氧化还原失衡引致的活性氧(ROS)体内堆积,产生的细胞毒性可致神经细胞凋亡、退化或变性[13]。前期报道的天珠散通过增加拟痴呆小鼠脑组织SOD和GSH-Px活性,降低脂质过氧化,减少自由基对脑组织损伤,表明天珠散能提高小鼠抗氧化能力[4],清除体内“玍毒”;本研究揭示的天珠散提高神经元MAP-2、SYN-1表达,促进神经递质合成等作用与天珠散恢复“脑筋不用”等病理过程相关。
综上,植根于我国民族医药“土壤”,以民族医药理论为牵引,提出土家族特色复方的研究方向并进行基础验证,基本确认了天珠散防治VD的有效性,为进一步进行物质基础研究和组方优化提供了有力参考。
| [1] | Kalaria R N, Maestre G E, Arizaga R, et al. Alzheimer's disease and vascular dementia in developing countries: prevalence, management, and risk factors [J]. Lancet Neurol, 2008, 7(9): 812-826. |
| [2] | Dong M J, Peng B, Lin X T, et al. The prevalence of dementia in the People's Republic of China: a systematic analysis of 1980-2004 studies [J]. Age Ageing, 2007, 36(6): 619-624. |
| [3] | 李志勇, 赵 晖, 裴凌鹏, 等. 血管性痴呆"玍毒内生"病机初探 [J]. 中华中医药杂志, 2011, 26(7): 1594-1596. |
| [4] | 毕 天, 宋阔魁, 杜文喜, 等. 天珠散对D-半乳糖拟痴呆小鼠的治疗作用 [J]. 时珍国医国药, 2013, 24(11): 2593-2595. |
| [5] | Zhao H, Li Z Y, Wang Y L, et al. Hippocampal expression of synaptic structural proteins and phosphorylated cAMP response element-binding protein in a rat model of vascular dementia induced by chronic cerebral hypoperfusion [J]. Neur Reg Res, 2012, 7(11): 821-826. |
| [6] | Zhang X L, Zheng S L, Dong F R, et al. Nimodipine improves regional cerebral blood flow and suppresses inflammatory factors in the hippocampus of rats with vascular dementia [J]. J Int Med Res, 2012, 40(3): 1036-1045. |
| [7] | 李志勇, 李彦文, 庞宗然, 等. 民族药特色与研究 [J]. 南京中医药大学学报: 自然科学版, 2011, 27(5): 17-19. |
| [8] | 许绍芬. 神经生物学 [M]. 上海: 上海医科大学出版社, 1999. |
| [9] | Sanchez C, Diaz-Nido J, Avila J. Phosphorylation of microtubule-associated protein 2 (MAP2) and its relevance for the regulation of the neuronal cytoskeleton function [J]. Prog Neurobiol, 2000, 61(2): 133-168. |
| [10] | 张玉华, 赵瑞波, 李宗敏, 等. 病变侧亚低温对大鼠局灶脑缺血MAP2表达的影响 [J]. 哈尔滨医科大学学报, 2004, 38(2): 129-134. |
| [11] | 马 隽, 张展翅, 崔慧先, 等. 磁刺激对小鼠原代海马神经元突触素、生长相关蛋白及脑源性神经营养因子表达的影响 [J]. 第二军医大学学报, 2011, 32(10): 1096-1102. |
| [12] | Hasan A, Nitsche M A, Rein B, et al. Dysfunctional long-term potentiation like plasticity in schizophrenia revealed by transcranial direct current stimulation [J]. Behav Brain Res, 2011, 224(1): 15-22. |
| [13] | 李 莉. 五味子酚等三种抗氧化剂对氧化应激损伤中枢神经细胞的保护作用及其作用机理研究 [J]. 生理科学进展, 1998, 29(1): 35-38. |
 2015, Vol. 46
2015, Vol. 46


