2. 南京中医药大学, 江苏 南京 210046
2. Nanjing University of Chinese Medicine, Nanjing 210046, China
宝藿苷I是淫羊藿中特有的黄酮类成分,具有明显的药理活性[1, 2, 3, 4, 5]。但是宝藿苷I的水溶性和膜渗透性较差,在Caco-2细胞转运实验中存在外排现象[6]。维生素E聚乙二醇1000琥珀酸酯(D-α-tocopherol polyethylene glycol 1000 succinate,TPGS)是维生素E的水溶性衍生物,具有两亲性和较大的分子表面积,是良好的非离子性表面活性剂,已载入《美国药典》[7]。也有文献报道,TPGS可用作某些药物的吸收促进剂、P-糖蛋白抑制剂等[8, 9]。
本课题组前期采用Caco-2模型研究TPGS对宝藿苷I吸收转运的影响,发现在应用TPGS后,宝藿苷I的外排比例得到下降,说明TPGS可以显著促进宝藿苷I的吸收[10]。研究表明,宝藿苷I对乳腺癌MCF-7细胞增殖有较好的抑制作用[11],为进一步提高其药效,本实验通过考察宝藿苷I对MCF-7的细胞毒性作用和细胞摄取率,研究TPGS对宝藿苷I抑制乳腺癌细胞MCF-7增殖的影响。
1 材料 1.1 药品与试剂宝藿苷I对照品(自制,质量分数>98%);TPGS(Aladdin,批号L1303022);顺铂(南京制药厂有限公司,批号20140411);RPMI 1640培养基(南京凯基生物科技发展有限公司);胰蛋白酶(Sigma公司);胎牛血清(Gibco);甲醇为色谱纯,水为高纯水,其余试剂均为分析纯。
1.2 仪器Agilent 1200高效液相色谱仪(美国Agilent公司);数显气浴恒温振荡器(金坛市双捷实验仪器厂);BP-211D分析电子天平(德国Sartorius公司);CO2细胞培养箱(美国Thermo公司);酶标仪(美国Bio-Rad公司)。
1.3 细胞人乳腺癌细胞MCF-7(南京凯基生物科技发展有限公司)。
2 方法 2.1 HPLC法测定宝藿苷I方法学考察 2.1.1 对照品溶液的制备精密称取宝藿苷I对照品6.27 mg,置于10 mL量瓶中,甲醇溶解并稀释至刻度,摇匀,得627.0 μg/mL对照品储备液。精密移取宝藿苷I储备液分别加甲醇稀释成质量浓度为62.70、25.08、12.54、6.27、2.51 μg/mL对照品溶液,备用。
2.1.2 色谱条件[1]色谱柱Hedera C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(75∶25);检测波长270 nm;体积流量1.0 mL/min;柱温30 ℃;进样量20 μL。
2.1.3 线性关系考察取“2.1.1”项中配制的系列对照品溶液,按上述色谱条件测定,以对照品溶液的进样质量浓度(C)为横坐标,峰面积积分值(A)为纵坐标,得到标准曲线:A=38.358 C-6.301 7,r=0.999 8,结果显示,宝藿苷I在2.51~62.70 μg/mL线性关系良好。
2.1.4 稳定性试验分别配制宝藿苷I浓度为20 μmol/L,TPGS浓度分别为0、20、40、80 μmol/L的溶液,置37 ℃恒温水浴中,分别于0、2、4、8、12 h进样,测定宝藿苷I峰面积,考察宝藿苷I溶液的稳定性。结果在37 ℃条件下各组宝藿苷I溶液在12 h内保持稳定,没有发生降解或沉淀。
2.1.5 重复性试验平行制备5份供试品溶液,进行测定,结果宝藿苷I质量浓度的平均值为26.17 μg/mL,RSD为0.94%,表明此测定方法重复性良好。
2.1.6 加样回收率试验按照《中国药典》2010年版二部附录XIXA项下方法,分别设计高、中、低3个质量浓度,每个质量浓度各制备3份供试品溶液,进行加样回收率试验。结果平均加样回收率为99.63%,RSD为1.31%,表明此测定方法回收率良好。
2.2 宝藿苷I的溶解度测定按照文献报道的方法[12],测定宝藿苷I及其与TPGS的混合物在水中的溶解度。分别称取过量的宝藿苷I、宝藿苷I和TPGS(浓度比分别为1∶1、1∶2、1∶4)的物理混合物于5 mL双蒸水中,超声至药物不再溶解,放入恒温振荡器中,温度保持(25±2)℃,振摇24 h,3 000 r/min离心15 min,吸取适量饱和上清液,乙醇稀释至线性范围,用0.45 μm微孔滤膜滤过,按“2.1.2”项色谱条件进行HPLC测定。
2.3 细胞毒性实验[13]取状态良好并处于对数生长期的乳腺癌细胞MCF-7,胰酶消化后,用含10% FBS的RPMI 1640培养基稀释至细胞密度为1×105个/mL,吹打均匀后取100 μL细胞悬液于96孔板,置37 ℃培养箱孵育24 h使其贴壁。将宝藿苷I、宝藿苷I-TPGS(1∶2)用少量二甲基亚砜(DMSO)溶解,并以无血清的RPMI 1640培养基分别稀释成系列浓度(DMSO体积分数低于0.1%),顺铂注射液以无血清的RPMI 1640培养基稀释成系列浓度,将所配制的各试药分别加入96孔板中,每孔加100 μL,每个浓度6个平行孔,以正常培养基为对照,将培养板继续置于培养箱中孵育24 h后,每孔加入10 μL MTT溶液,置培养箱中孵育4 h。甩板,吸干孔内残留液体,每孔加入100 μL DMSO,于振荡器上振荡10 min以溶解蓝紫色结晶物。在570 nm波长下,用酶标仪测定吸光度(A)值,计算细胞存活率[14]。
细胞存活率=A样品/A对照
考察宝藿苷I与不同比例TPGS的混合物对MCF-7细胞抑制作用时,TPGS单用的浓度设为80 µmol/L,宝藿苷I的浓度设为20 µmol/L,宝藿苷I与TPGS比例设为1∶1、1∶2、1∶4;考察TPGS对不同浓度宝藿苷I对MCF-7细胞增殖抑制的促进作用时,宝藿苷I的浓度设为10、20、40 µmol/L,宝藿苷I与TPGS的比例固定为1∶2,其他操作同上。
2.4 细胞摄取实验将MCF-7细胞接种于6孔培养板中,细胞培养箱中培养24 h,使其贴壁移去原有培养基,分别加入经无血清培养基稀释的宝藿苷I(20 μmol/L)或宝藿苷I-TPGS(1∶1)、宝藿苷I-TPGS(1∶2)、宝藿苷I-TPGS(1∶4)混合物,孵育2 h,孵育结束后,快速弃去培养基,加入冷的PBS终止细胞摄取,并冲洗细胞3遍。加入1 mL蒸馏水,刮取细胞,将细胞悬液收集并置于冰浴下超声破碎细胞,离心,吸取上清液于另一干净离心管中,用氮气吹干,甲醇溶解,用0.45 μm微孔滤膜滤过,定容至1 mL,供HPLC测定宝藿苷I[15]。
考察摄取率与宝藿苷I浓度的关系时,宝藿苷I的浓度分别设为10、20、40 μmol/L,宝藿苷I与TPGS的浓度比固定为1∶2;考察摄取率与摄取时间的关系时,宝藿苷I的浓度设为20 μmol/L,宝藿苷I与TPGS的浓度比固定为1∶2,分别孵育1、2、4 h,其他操作同上。
2.5 统计学方法结果均以x ± s表示,采用SPSS 16.0软件处理数据,组间比较行单因素方差分析。
3 结果 3.1 宝藿苷I的溶解度结果显示,宝藿苷I、宝藿苷I-TPGS(1∶1)、宝藿苷I-TPGS(1∶2)、宝藿苷I-TPGS(1∶4)在水中的表观溶解度分别为(12.72±0.32)、(69.41±0.95)、(113.43±2.18)、(152.21±3.46)μg/mL,提示TPGS的加入能提高宝藿苷I在水中的溶解度,并且随着TPGS比例的增加,宝藿苷I在水中的溶解度也逐渐增大,说明TPGS能显著提高宝藿苷I的水溶性,改善其理化性质。原因可能是TPGS本身是一种非离子性表面活性剂,当TPGS达到一定浓度时,会通过胶束增溶作用,改善难溶性药物的溶解性能。
3.2 细胞毒性比较宝藿苷I、宝藿苷I-TPGS(1∶2)以及阳性药顺铂孵育MCF-7细胞24 h后的半数生长抑制浓度(IC50)值分别为(18.51±0.31)、(12.18±0.22)、(4.3±0.27)μmol/L,发现与宝藿苷I相比,加入TPGS的药物组的IC50值降低,差异具有显著性。MCF-7细胞用宝藿苷I(20 μmol/L)、TPGS(80 μmol/L)和宝藿苷I-TPGS(1∶1)、宝藿苷I-TPGS(1∶2)、宝藿苷I-TPGS(1∶4)孵育24 h的细胞抑制率见图 1。空白辅料TPGS在MCF-7细胞中孵育24 h,80 μmol/L时细胞抑制率在5%以下,说明TPGS是安全无毒的药用辅料。宝藿苷I与不同比例TPGS的混合物对MCF-7细胞增殖的抑制作用均高于宝藿苷I原料药组,且差异具有显著性(P<0.05、0.001)。
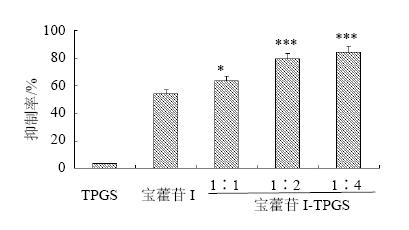 | 与宝藿苷I组比较:*P<0.05 ***P<0.001,下同*P < 0.05 ***P < 0.001 vs baohuoside I group,same as below图 1 TPGS、宝藿苷I、宝藿苷I与不同比例TPGS的混合物对MCF-7细胞的增殖抑制作用(x±s , n=6)Fig. 1 Inhibition of TPGS,baohuoside I,and mixtures of baohuoside I and TPGS in different ratios on proliferation of MCF-7 cells(x±s , n=6) |
图 2反映了TPGS(宝藿苷I与TPGS的浓度比固定为1∶2)对不同浓度宝藿苷I(10、20、40 μmol/L)抑制MCF-7细胞增殖的促进作用,结果显示,TPGS促进低浓度的宝藿苷I抑制细胞增殖的作用更强,即当宝藿苷I浓度分别为10、20、40 μmol/L时,TPGS使其对MCF-7细胞增殖抑制率分别提高55.08%、43.92%、11.95%。
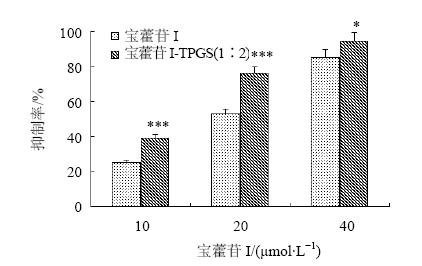 | 图 2 TPGS对不同浓度宝藿苷I抑制MCF-7细胞增殖的促进作用(x±s , n=6)Fig. 2 Promotion of TPGS on inhibition of baohuoside I at different concentration on proliferation of MCF-7 cells(x±s , n=6) |
细胞摄取实验结果见表 1~3,相比宝藿苷I原料药,宝藿苷I与不同比例TPGS的混合物作用后MCF-7细胞对宝藿苷I的摄取率均有所提高,且随着TPGS比例的增加,宝藿苷I也更容易被MCF-7细胞摄取,并且宝藿苷I、宝藿苷I-TPGS(1∶2)作用后细胞对宝藿苷I的摄取率在1~4 h内有一定的浓度和时间相关性。
| 表 1 宝藿苷I、宝藿苷I与不同比例TPGS的混合物作用MCF-7细胞2 h后细胞对宝藿苷I的摄取率(x±s , n=3) Table 1 Uptake ratesof baohuoside I in MCF-7 cells treated with baohuoside I and mixtures of baohuoside I and TPGS in different ratios for 2 h(x±s , n=3) |
| 表 2 不同浓度宝藿苷I、宝藿苷I-TPGS (1∶2) 作用MCF-7 细胞2 h后细胞对宝藿苷I的摄取率(x±s , n=3) Table 2 Uptake ratesof baohuoside I in MCF-7 cells treated with baohuoside I at different concentration and mixtures of baohuoside I and TPGS (1∶2)for 2 h(x±s , n=3) |
| 表 3 宝藿苷I (20 μmol/L)、宝藿苷I-TPGS (1∶2) 作用MCF-7 细胞不同时间后细胞对宝藿苷I的摄取率(x±s , n=3) Table 3 Uptake rates of baohuoside I in MCF-7 cells treated with baohuoside I (20 μmol/L) and mixtures of baohuoside I and TPGS (1∶2) for different times(x±s , n=3) |
TPGS在制剂中可作为增溶剂[16]、吸收促进剂[17]以及固体分散体的载体等,还可以抑制P-糖蛋白的外排作用,提高受P-糖蛋白阻滞的药物的生物利用度,对于难溶性药物是一种良好的非离子性表面活性剂。与其他表面活性剂相比,TPGS具有的生育酚酯结构,具有一定的抗氧化性,有助于增加制剂的稳定性[18]。
本研究通过细胞毒性实验和细胞摄取实验考察了TPGS对宝藿苷I抑制乳腺癌细胞MCF-7增殖的影响,MTT实验结果表明在应用TPGS后,宝藿苷I对MCF-7增殖的抑制作用增强,对这一现象的研究显示,TPGS能通过胶束增溶作用改善宝藿苷I的溶解性能;另外,已有的研究表明,宝藿苷I在Caco-2细胞转运实验中存在明显的外排现象[5],而低浓度的TPGS可以通过抑制ATP-酶而抑制ATP-酶介导的P-糖蛋白外排[19],因此能提高宝藿苷I被MCF-7细胞的摄取率。相比宝藿苷I原料药,宝藿苷I与不同比例TPGS的混合物的细胞摄取率均有所提高,这一实验结果进一步证实了TPGS能促进宝藿苷I的抗乳腺癌细胞MCF-7增殖的作用。
| [1] | 金晓勇, 贾晓斌, 蔡宝昌, 等. 炙淫羊藿炮制过程中5种黄酮类成分变化规律研究 [J]. 中国中药杂志, 2009, 34(21): 2738-2742. |
| [2] | Song J, Shu L, Jia X B, et al. Reactive oxygen species-mediated mitochondrial pathway is involved in baohuoside I-induced apoptosis in human non-small cell lung cancer [J]. Chem Biol Interact, 2012, 199(1): 9-17. |
| [3] | 贾晓斌, 兰雪莲, 陈 彦, 等. 淫羊藿黄酮类成分抗骨质疏松作用及其机制研究进展 [J]. 中国药房, 2010, 21(3): 269-270. |
| [4] | 刘晓霞, 张永泽, 李振红, 等. 宝藿苷I对食道癌细胞Eca-109 Wnt/β-catenin信号转导通路的影响 [J]. 中草药, 2011, 42(1): 124-126. |
| [5] | 韩 惠, 单 淇, 周福军, 等. 箭叶淫羊藿中化学成分及其体外抗肿瘤活性研究 [J]. 现代药物与临床, 2013, 28(3): 269-273. |
| [6] | 陈 彦, 贾晓斌. Caco-2细胞单层研究淫羊藿黄酮类成分的吸收转运 [J]. 中草药, 2009, 40(2): 220-224. |
| [7] | 杜广盛, 李德馨, 魏振平. 聚乙二醇1000维生素E琥珀酸酯在纳米制剂中应用进展 [J]. 沈阳药科大学学报, 2012, 29(12): 981-987. |
| [8] | 金朝辉, 徐 珽, 马 音, 等. 口服吸收促进剂研究进展概述 [J]. 华西医学, 2008, 23(4): 940-942. |
| [9] | Dintaman J M, Sliverman J A. Inhibition of P-glycoprotein by D-α-tocopheryl polyethylene glycol 1000 succinate (TPGS) [J]. Pharm Res, 1999, 16(10): 1550-1556. |
| [10] | 金 鑫, 张振海, 贾晓斌, 等. 维生素E 聚乙二醇1000琥珀酸酯对Caco-2细胞模型转运宝藿苷I的影响 [J]. 中草药, 2011, 42(12): 2474-2478. |
| [11] | Huang C Q, Chen X G, Guo B L, et al. Induction of apoptosis by IcarisideⅡthrough extrinsic and intrinisic signaling pathways in human breast cancer MCF7 cells [J]. Biosic Biotechnol Biochem, 2012, 76(7): 1322-1328. |
| [12] | 贾东升, 赵江丽, 贾晓斌, 等. 淫羊藿苷元磷脂复合物的制备及其固体分散体研究 [J]. 中草药, 2010, 41(9): 1449-1453. |
| [13] | 刘艳华, 孙 进, 王文苹, 等. 包载紫杉醇的透明质酸聚合物胶束细胞毒性及细胞摄取研究 [J]. 中国实验方剂学杂志, 2012, 18(21): 271-274. |
| [14] | Taetz S, Bochot A, Surace C, et al. Hyaluronic acidmodified DOTAP/DOPE liposomes for the targeted delivery of anti-telomrase si RNA to CD44-expressing lung cancer cells [J]. Oligonucleotides, 2009, 19(2): 103-116. |
| [15] | 黄 灿, 许杜鹃, 夏 泉, 等. HPLC法测定肿瘤细胞中5-氟尿嘧啶的浓度 [J]. 安徽医药, 2012, 16(2): 173-174. |
| [16] | Gao Y, Li L B, Zhai G X. Preparation and characterization of Pluronic/TPGS mixed micelles for solubilization camptothecin [J]. Colloid Surf Biointerfaces, 2008, 64(2): 194-199. |
| [17] | Shien M J, Hsu C Y, Huang L Y. Reveesal of doxorubicin-resistance by multifunctional nanoparticles in MCF-7/ADR cells [J]. J Controlled Release, 2011, 152(3): 418-425. |
| [18] | 于永新, 俞红凯, 王中彦, 等. 聚乙二醇1000维生素E琥珀酸酯应用进展 [J]. 沈阳药科大学学报, 2006, 23(6): 407-412. |
| [19] | Collnot E M, Baldes C, Schaefer U F, et al. Vitamin E TPGS P-glycoprotein inhibition mechanism: influence on conformational flexibility, intracellular ATP levels, and role of time and site of access [J]. Mol Pharm, 2010, 7(3): 642-651. |
 2015, Vol. 46
2015, Vol. 46


