2. 中国人民解放军第三○二医院, 北京 100039
2. 302 Military Hospital of China, Beijing 100039, China
小菜蛾抗菌肽[antibacterial peptides from Plutella xylostella(pxCECA1),CA]属于天蚕素抗菌肽大家族中的一种,是从昆虫小菜蛾幼虫体内提取分离而得,具有抗菌活性高,抗菌谱广的特点[1]。它是一种相对分子质量为4 500的α螺旋形的阳离子抗菌肽,能选择性与带负电荷多的细胞膜结合,如肿瘤细胞细胞膜,破坏肿瘤细胞膜结构的完整性并产生穿孔现象,使肿瘤细胞内液外流而凋亡[2, 3]。但CA易受温度、pH值等外界因素的影响而变性失活,也能发生自身聚集,或者与其他粒子无法逆转的结合而失去生物活性[4],所以其半衰期特别短,限制了这类多肽药物的临床应用。
纳米给药系统(nano drug delivery system)具有降低药物毒性和刺激性、延缓药物降解、延长药物释放时间、靶向释放等优点[5, 6, 7, 8],将药物包封于其中,可实现调节药物释放速率,改变药物在体内的分布、提高药物生物利用度等目的,具有巨大的应用前景。目前,可生物降解的合成聚合物材料聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA[由于其无毒、成球性好、化学稳定性高、具有控制释放能力等特点被广泛用作纳米给药系统的载体[9, 10, 11]。
本研究选用PLGA为载体材料,CA为模型药物,以S/W/O/W结合高压均质法制备小菜蛾抗菌肽PLGA纳米粒(CA-PLGA-NPs),通过正交试验,以2、6、14 d累积释放率为评价指标对处方工艺进行优化筛选,对其粒径、多分散指数(PDI)、电位等理化性质进行表征,以透射电镜(TEM)观察其基本形态,并对其进行体外释药行为考察。
1 仪器与材料Agilent 1100高效液相色谱仪,含在线脱气机、四元梯度泵、自动进样器、DAD检测器、HP Chemstation化学工作站,Agilent公司;S-4800扫描电镜,日本日立;NanoZS90粒径分析仪,Malvern公司;JS94W温控型Zeta电位测量仪,北京中仪科信科技有限公司;GYB40-10S高压均质机,Nano Bee公司;JHBE-20A高速探头超声仪,河南金鼐科技发展有限公司;旋转蒸发仪,上海医械专机厂;冷冻干燥机,美国Labconco公司。
CA原料药,98.6%,批号20140421,由解放军第三○二医院药学部制剂研究室自制;CA对照品,99.8%,批号20140405,由武汉大学提供;PLGA,2单体比例1∶1,相对分子质量15 000,山东省医疗器械研究所;羟丙基-β-环糊精(HP-β-CD),上海谱振生物科技有限公司;聚乙烯醇(PVA),广州伟伯化工有限公司;聚乙二醇2000(PEG 2000),上海酶联生物科技有限公司;甘露醇,天津市科密欧化学试剂有限公司;色谱甲醇,瑞典Oceanpak;重蒸水;其余试剂均为分析纯。
2 方法与结果 2.1 CA-PLGA-NPs的制备取0.5 g CA,PEG 2000与HP-β-CD的等比例混合物加入到去离子水溶液中,冷冻干燥得到CA的多肽微粉[8]。将含有50 mg CA的多肽微粉加入到20 mL PLGA的二氯甲烷中,高压乳均,充分乳化后加入含氯化钠的PVA溶液200 mL[9, 10],高速探头超声5 min,将其加入到高压均质机中高压均质(100.0 MPa)循环5次,得复乳,减压旋转除去有机溶剂,高速离心取沉淀后蒸馏水洗涤3次,收集纳米粒,加入3%甘露醇,冷冻干燥(-50 ℃、10 Pa),即得。
2.2 HPLC法测定CA方法建立[11] 2.2.1 色谱条件色谱柱为Agilent Alltima C18(250 mm×4.6 mm,5 μm),流动相为0.05%三氟乙酸(TFA)水溶液-甲醇-乙腈(95∶2.5∶2.5),体积流量1.0 mL/min,进样量10 μL,检测波长275 nm,柱温25 ℃。
2.2.2 对照品溶液的制备精密称取CA对照品10 mg,置50 mL量瓶中,加水溶解并稀释至刻度,即得200 μg/mL CA对照品储备液。
2.2.3 供试品溶液的制备精密称定CA-PLGA- NPs冻干粉10 mg,分别置于25 mL量瓶中,加90%乙腈稀释并定容至25 mL,即得供试品溶液。
2.2.4 线性关系考察精密吸取200 μg/mL CA对照品储备液适量,用流动相稀释配制成8、16、32、48、80 μg/mL的CA对照品溶液,分别吸取上述溶液,按“2.2.1”项下色谱条件测定,以峰面积为纵坐标(Y),进样量为横坐标(X),得线性回归方程为Y=3.959×104 X+1.017×103,r=0.999 1。结果表明CA在8~80 μg/mL线性关系良好。
2.2.5 精密度试验分别取低、中、高3个质量浓度(16、48、80 μg/mL)的CA对照品溶液,于同日内重复测定5次,计算日内精密度;连续测定5 d,计算日间精密度,结果其日内精密度RSD为1.21%、1.34%、1.22%;其日间精密度RSD分别为1.64%、2.11%、1.23%。
2.2.6 重复性试验取CA-PLGA-NPs冻干粉6份,用90%乙腈溶解后,按“2.2.3”项下方法制备供试品溶液,分别进样10 μL,记录抗菌肽色谱峰的峰面积值,代入“2.2.4”项下回归方程,计算其量。结果冻干粉中抗菌肽的量平均值为10.48%,RSD为1.30%,表明该方法重复性良好。
2.2.7 稳定性试验精密吸取供试品溶液,按“2.2.1”项下色谱条件分别于0、1、2、4、6、8 h测定,记录抗菌肽峰面积值,计算其RSD为1.54%。结果表明,供试品溶液在8 h内稳定。
2.2.8 加样回收率试验精密称取已测定的CA原料药6份,分别精密加入一定量的抗菌肽CA对照品(约相当于样品中各量的50%、100%、150%),按“2.2.3”项下方法制备供试品溶液,进样10 μL,测定抗菌肽CA的量,计算得加样回收率100.7%,RSD为1.49%。
2.3 体外释放度测定采用摇瓶培养法。精密称取CA-PLGA-NPs冻干粉10 mg,置于25 mL量瓶中,加入pH 7.4的磷酸盐缓冲液[含0.5%十二烷基硫酸钠(SDS)]25 mL,置于温度为(37.0±1.0)℃,速率为75 r/min的恒温振荡仪中,于0、1、2、3、4、6、8、10、12、14 d取样0.4 mL,同时补充介质0.4 mL,立即滤过,取续滤液,按“2.2.1”项下色谱条件测定介质中药物的量,计算累积释放率。
累积释放率=∑Ct/C0
其中Ct为t时已释放的CA质量浓度,C0为完全释放时CA的质量浓度
2.4 制备工艺的优选Lee等[8]研究发现用PEG 2000混合物制备的多肽微粉能有效地增强复乳法制备微球时蛋白药物的稳定性,PLGA的质量浓度因为影响初乳的黏度所以对微球的大小和形态有着重要影响,而由于氯化钠质量分数影响复乳的渗透压和PVA影响复乳的稳定性,故二者对包封率和载药量有决定性的意义。所以本实验选取CA与PEG 2000混合物的比例(A)、PLGA质量浓度(B)、氯化钠质量分数(C)及PVA质量分数(D)为考察因素,按L9(34) 正交表进行试验,因素水平见表 1。采用综合评分法对正交试验数据进行分析,以CA在2、6、14 d的累积释放率为综合评价指标,综合评分(Y)=(Y2-20)(40-Y2)+(Y6-50)(70-Y6)+(Y14-80)(100-Y14),Y2、Y6、Y14分别为2、6、14 d 3个时间点的累积释放率,同时2、6、14 d的累积释放率应分别满足Y2在20%~40%、Y6在50%~70%、Y14在80%~100%,当释放率偏离区间外,表示对Y的贡献为负,Y值越大,因素水平越好。试验安排及结果见表 1,方差分析见表 2。
| 表 1 CA-PLGA-NPs处方工艺正交试验设计及结果 Table 1 Orthogonal design and results for optimization of CA-PLGA-NPs prescription process |
| 表 2 综合评分方差分析 Table 2 Analysis of variance for comprehensive score |
由直观分析可知,影响CA-PLGA-NPs释药性质的因素顺序为A>C>B>D。以极值最小的D因素为误差项进行方差分析,结果显示因素A、C具有极显著意义,C因素无明显影响,结合实际工艺要求,确定最佳处方工艺为 A2B1C2D2,即CA与PEG 2000混合物的比例为1∶1,PLGA质量浓度为10 mg/mL,氯化钠质量分数和PVA质量分数分别为4.0%、0.2%。
2.5 验证试验按上述最佳工艺进行3批验证试验,取50 mg CA,50 mg PEG 2000与HP-β-CD的等比例混合物加入到去离子水溶液中,冷冻干燥得到CA的多肽微粉,然后加入到20 mL 10 mg/mL的PLGA的二氯甲烷溶液中,高压乳均,充分乳化后加入到200 mL的含4.0%氯化钠的0.2% PVA溶液中,高速探头超声和高压均质,得CA-PLGA-NPs冻干粉,累积释放曲线见图 1。结果表明,3批样品的累积释放率符合要求,此制备工艺稳定可行。CA-PLGA-NPs释放缓慢且均均,在2、6、14 d内的累积释放率分别为(26.41±0.35)%、(65.67±0.70)%、(90.52±0.74)%,具有良好的缓释效果。
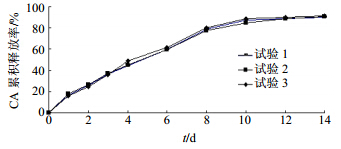 | 图 1 3批CA-PLGA-NPs的体外释放曲线Fig. 1 In vitro drug release profiles of three batches of CA- PLGA-NPs |
将CA- PLGA-NPs冻干粉复溶后,稀释,摇均,经激光散射粒度分析仪和表面电位分析仪测定粒径、PDI和Zeta电位。由测定结果可知,CA-PLGA-NPs粒径分布均一,粒径为(358.76±22.51)nm,PDI值为0.168 1±0.012 2,见图 2。Zeta电位为-21.7 mV。
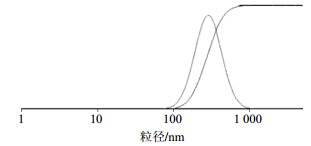 | 图 2 CA-PLGA-NPs粒径图Fig. 2 Profiles of particle size of CA-PLGA-NPs |
精密称定CA-PLGA-NPs冻干粉10 mg,分别置于25 mL容量瓶中,加90%乙腈稀释并定容至25 mL,不断振摇至完全溶解,按“2.2.1”项下测定CA的量,计算包封率、载药量。
载药量=CCAVCA/M0
包封率=CCAVCA/M1
其中CCA为HPLC测定的CA质量浓度,VCA为CA-PLGA- NPs溶液体积,M0为CA-PLGA-NPs冻干粉取样量,M1为CA-PLGA-NPs冻干粉理论CA量
测得结果表明,CA-PLGA-NPs中CA的载药量为(10.50±0.28)%,包封率为(60.92±1.58)%。按“2.3”项下考察CA-PLGA-NPs体外释药度,计算0、1、2、3、4、6、8、10、12、14 d的累积释放率,累积释放曲线见图 3。由体外释药曲线结果可知,制备的CA- PLGA-NPs突释现象不明显,具有良好的缓控释效果。CA为水溶性多肽,原料药能快速分散溶解于水中,累积释放曲线见图 3。
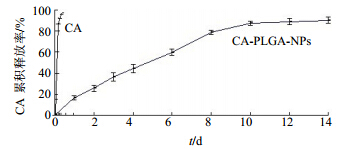 | 图 3 CA-PLGA-NPs的体外释放曲线Fig. 3 In vitro drug release profiles of CA-PLGA-NPs |
制备的CA-PLGA-NPs冻干粉适量溶于水,将溶液滴于TEM铜网上,置于蜡板上风干,经TEM检测(扫描电压为200 kV)。由TEM图可看出CA- PLGA-NPs为网状球形或类球形,见图 4。由图 4可知,CA微粉分散于CA-PLGA-NPs的网状结构内部,形成了许多储药小室,这些小室不仅能防止CA的大量聚集,也能避免CA长时间与外界环境的接触,从而提高CA的稳定性,增加其体内的半衰期。
 | 图 4 CA-PLGA-NP在TEM下的形态图Fig. 4 TEM image of CA-PLGA-NPs |
在本制剂处方中选用等比例的PEG 2000与羟丙基-β-环糊精的混合物作为保护剂[8],在制备初乳时,保护剂迅速进入初乳的水相液滴内部,从而减少CA与二氯甲烷的接触时间。同时,PEG 2000能减小乳滴的油相与水相表面张力,减少乳滴破裂从而保护水滴中的CA分子。PLGA用量对CA-PLGA- NPs理化性质影响较小。由于高压均质机对流体的粘度有一定的要求,本实验中PLGA的最大质量浓度设定在30 mg/mL。溶液黏度过大将降低高压均质机的工作性能,实验结果表明,10 mg/mL的PLGA能满足本处方的要求。处方中的氯化钠[9]不仅能提高外水相的渗透压,防止因内水相压力过大而破乳,也能加速内水相的水分子向外迁移,提高包封率,还能使CA-PLGA-NPs更加致密,延长释药时间。PVA常作为表面活性剂用于CA- PLGA-NPs的制备,其质量分数对CA-PLGA-NPs的制备影响较小,提高PVA的质量分数能增加初乳的稳定性,从而减少CA的泄漏,达到提高包封率、减少突释的效果。
通过本研究采用S/W/O/W结合高压均质法制备的CA-PLGA-NPs粒径较小且均一,工艺稳定可行,为抗菌肽类药物的新型给药系统研究提供制剂学基础。
| [1] | Wang H, Meng X L, Xu J P, et al. Production, purification, and characterization of the cecropin from Plutella xylostella, pxCECA1, using an intein-induced self-cleavable system in Escherichia coli [J]. Appl Microbiol Biotechnol, 2012, 94(4): 1031-1039. |
| [2] | Chang W T, Pan C Y, Rajanbabu V, et al. Tilapia(Oreochromis mossambicus) antimicrobial peptide, hepcidin 1-5, shows antitumor activity in cancer cells [J]. Peptides, 2011, 32(2): 342-352. |
| [3] | Li J G, Liu S P, Lakshminarayanan R, et al. Molecular simulations suggest how a branched antimicrobial peptide perturbs a bacterial membrane and enhances permeability [J]. Biochim Biophys Acta, 2013, 1828(3): 1112-1121. |
| [4] | Laquintana V, Denora N, Lopalco A, et al. Translocator protein ligand-PLGA conjugated nanoparticles for 5-fluorouracil delivery to glioma cancer cells [J]. Mol Pharm, 2014, 11(3): 859-871. |
| [5] | 陈 婷, 鲁 莹. 包裹多烯紫杉醇 PLGA-PEG 纳米粒的制备及体外释放度考察 [J]. 第二军医大学学报, 2011, 32(3): 295-298. |
| [6] | 华 苏, 许向阳, 周建平. 复乳法制备蛋白质药物PLGA微球的影响因素 [J]. 药学进展, 2009, 33(10): 451-457. |
| [7] | Lee E S, Kwon M J, Lee H, et al. Stabilization of protein encapsulated in poly(lactide-co-glycolide) microspheres by novel viscous S/W/O/W method [J]. Int J Pharm, 2007, 331(1): 27-37. |
| [8] | Gomes A L, Bochot A, Doyle A, et al. Sustained release of nanosized complexes of polyethylenimine and ant-iTGF-beta 2 oligonucleotide improves the out come of glaucoma surgery [J]. J Controlled Release, 2006, 112(3): 369-381. |
| [9] | Chi E Y, Krishnan S, Randolph T W, et al. Physical stability of proteins in aqueous solution: mechanism and driving forces in nonnative protein aggregation [J]. Pharm Res, 2003, 20(9): 1325-1336. |
| [10] | Freitas S, Merkle H P, Gander B. Microencapsulation by solvent extraction/evaporation: reviewing the state of the art of microsphere preparation process technology [J]. J Controlled Release, 2005, 102(2): 313-332. |
| [11] | 徐 和, 靳世英, 徐平华, 等. 高效液相色谱法测定小菜蛾中抗菌肽CA含量 [J]. 中国药学杂志, 2013, 48(6): 470-472. |
 2015, Vol. 46
2015, Vol. 46


