2. 中国医学科学院 北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
白及为兰科(Orchidaceae)珍稀植物白及Bletilla striata(Thunb.) Rchb. f. 的干燥根茎,又名苷根、白根、白芨等。据文献报道,白及的化学成分主要为联苄类[1, 2]、菲类[3, 4]、苹果酸异丁酯类[5]等。此外,白及中还含有一定量的甾体类化合物[6],如β-谷甾醇[7]、胡萝卜苷、bletilnoside A和bletilnoside B[8],而本课题组此前对白及的化学成分研究中发现了特殊的C-31、C-32环菠萝蜜烷型三萜[9],在已报道的甾体和三萜化合物中,C-3位均被氧化为羟基或羰基。本实验进一步对白及醋酸乙酯部位的低极性成分进行研究,意外发现1个新的氯代甾体人工产物:4-氯-β-谷甾酮,产生原因可能为含有α,β-不饱和酮结构的甾体化合物长时间放置于三氯甲烷溶剂中,经强光照射诱导自由基取代反应产生的[10]。本实验运用高分辨质谱和核磁共振波谱鉴定出新化合物的结构,并对该化合物的生物活性进行测定,发现其对正常的293A人胚肾细胞具有一定的毒性。
1 仪器与材料Bruker AVIIIHD-600核磁共振波谱仪,Waters Synapt G2高分辨质谱仪。薄层色谱硅胶GF254、柱色谱硅胶(200~300目),制备薄层预制板均为青岛海洋化工厂生产。Sephadex LH-20为瑞典Amershan Pharmacia公司生产。酶标仪(Thermo 3001)为Thermo Fisher Scientific公司生产;超净台[MCV-B161F (T)] 为日本SANYO公司生产;显微镜(Primo Vert,AxioCam ERc 5s)为ZEISS公司生产;CO2培养箱(HH. CP-T)为上海齐欣科学仪器有限公司生产。DMEM、RPMI 1640培养基、胎牛血清均为Hyclone公司生产;胰蛋白酶由美国Gibco公司生产;MTT为美国Amresco公司生产;DMSO为美国Sigma公司生产。所用其他试剂均为分析纯。肺癌细胞A549、黑素瘤细胞A375、人肝癌细胞HEPG-2、人非小细胞肺癌细胞H1975、人胚肾细胞293A均来源于美国ATCC公司。
白及药材于2012年8月采自四川省内江市,经成都中医药大学李敏教授鉴定为白及Bletilla striata (Thunb.) Rchb. f. 的块茎。
2 提取与分离干燥的白及药材粗粉(3 kg),以95%乙醇回流提取3次(30 L×3),每次2 h。乙醇提取液经减压浓缩干燥得半固体流浸膏510 g,将流浸膏混悬于水中,以醋酸乙酯萃取,回收溶剂得醋酸乙酯部位160 g。醋酸乙酯部位以硅胶柱色谱进行分离,石油醚-丙酮(0∶1→1∶0)进行梯度洗脱,洗脱液经薄层色谱法检测,合并得25个洗脱部分Fr. 1~25。Fr. 7部分经Sephadex LH-20柱色谱分离,石油醚-三氯甲烷-甲醇(5∶5∶1)为洗脱剂,共洗脱得到4个洗脱部分Fr. 7-1~7-4。Fr. 7-4部分再经过反复的硅胶柱色谱(石油醚-醋酸乙酯0∶1→1∶0)、Sephadex LH-20柱色谱(石油醚-三氯甲烷-甲醇5∶5∶1)、制备薄层色谱(石油醚-醋酸乙酯15∶1)等进行分离,制备薄层板刮板后以重蒸三氯甲烷溶剂洗脱,得到化合物1(3 mg)。在此分离纯化过程中,均使用了大量的三氯甲烷溶剂,并在强阳光照射下进行过储存。
3 结构鉴定化合物1:淡黄色针状结晶(三氯甲烷),从质谱图中可以明显看到m/z 447的准分子离子峰及其m/z 449的同位素峰,推测该化合物分子结构中可能含有氯原子。进一步经高分辨质谱HR-ESI-MS表明分子式为C29H47OCl(m/z 447.339 7 [M+H]+,计算值为C29H48OCl,447.339 4),不饱和度为6。化合物1的1H-NMR显示2个单峰甲基信号(δH 0.71,1.23)、3个双峰甲基信号(δH 0.81,J = 6.6 Hz;0.84,J = 7.2 Hz;0.92,J = 6.6 Hz)、1个三重峰甲基信号(δH 0.85,J = 7.2 Hz)以及多个脂肪族亚甲基和次甲基信号。化合物的13C-NMR显示29个碳信号,其中δC 191.1,165.4和127.4的13C-NMR信号表明分子中可能存在1个α,β-不饱和酮片段。综合以上MS和NMR信息,推测化合物1为β-谷甾酮的类似物[11]。仔细比较两者的1H-NMR信号,发现化合物1低场区未见β-谷甾酮在δ 5.72附近的特征性烯氢单峰信号,而且在13C-NMR和DEPT谱中,化合物1的双键均为季碳信号,表明化合物1的C-4位被取代。进一步结合δC 127.4的双键季碳化学位移以及化合物的元素组成,推断化合物1为4-氯-β-谷甾酮。
为确证化合物1的结构,进行了2D NMR测试。根据HSQC谱推断氢与相邻碳原子之间的连接关系。另外,在化合物的HMBC谱中,18-CH3与C-12、C-13、C-14、C-17相关;19-CH3与C-1、C-5、C-9、C-10相关;21-CH3与C-17、C-20、C-22相关;26-CH3和27-CH3同时与C-24、C-25相关; 29-CH3与C-24、C-28相关;H-8与C-6、C-7、C-9、C-10、C-11、C-13、C-14、C-15相关;H-17与C-13、C-14、C-15、C-16、C-18、C-20、C-21、C-22相关。以上信号证实化合物1具有谷甾烷骨架。此外,HMBC谱中显示H-1与C-2、C-3、C-5、C-10、C-19相关;H-2与C-1、C-3、C-4、C-10相关;H-6与C-4、C-5、C-7、C-8、C-10相关(图 1),表明α,β-不饱和酮片段位于C-3、C-4和C-5位。综合以上NMR信息,确定化合物1的结构为4-氯-β-谷甾酮。具体核磁数据见表 1。
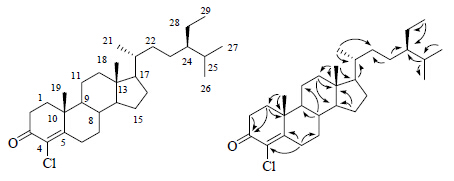 | 图 1 化合物1的化学结构和主要的HMBC相关图Fig.1 Structure and key HMBC correlations of compound 1 |
| 表 1 化合物1的1H-NMR (600 MHz,CDCl3) 和13C-NMR (150 MHz,CDCl3) 数据 Table 1 1H-NMR (600 MHz,CDCl3) and 13C-NMR (150 MHz,CDCl3) data of compound 1 |
分别取处于对数生长期、状态良好的A549、A375、HEPG-2、H1975肿瘤细胞和293A人胚肾细胞,制成单个细胞悬液,使细胞密度为3×103个/mL,接种于96孔板,每孔加入细胞悬液100 μL,置于37 ℃、5% CO2培养箱内培养24 h。然后将1 mg样品溶于10 μL的DMSO溶液中,以培养基稀释样品,再以质量浓度为50、25、12 μg/mL每孔加药100 μL,每个质量浓度设3个复孔。阴性对照组为含有适量DMSO的培养基溶液,空白对照组为不含细胞的培养基和溶媒。72 h后,避光条件下每孔加入MTT溶液(5 g/L)15 μL,继续温育培养4 h后,弃掉上清,每孔加入100 μL DMSO,置于摇床上慢速振摇10 min,使甲臜充分溶解后,用酶标仪测量570 nm波长处的吸光度(A)值,按下列公式计算细胞增殖抑制率。
抑制率=1-(A给药-A空白)/(A阴性-A空白)
结果表明,化合物1对4种肿瘤细胞A549、A375、HEPG-2、H1975无明显抑制活性,但在50、25和12 μg/mL质量浓度下,对正常人胚肾细胞293A具有抑制作用,抑制率分别为50%、40%和29%,表明该化合物具有一定的肾毒性。
5 讨论在对中药化学成分进行研究时,从原药材到获得具有固定化学性质和物理性质的化合物,期间经历了各种物理和化学环境的变化,尤其在化学溶剂和试剂的作用下,一些中药成分就不可避免发生变化,产生人工产物。
正如本实验结果一样,新人工产物4-氯-β-谷甾酮的生成也有其必然的原因:(1)白及药材中含有一定量的甾体类化合物,在三氯甲烷中溶解性很好。(2)三氯甲烷不稳定,在长时间强阳光照射和氧气存在下易被氧化分解为氯化氢和剧毒的光气(COCl2)。(3)三氯甲烷经强光照射产生的自由基与白及中的α,β-不饱和甾酮化合物发生了自由基取代反应[10]。由于本实验中使用了大量三氯甲烷,而且在该溶剂中进行过长时间的强光下放置。因此,可以初步确定该新化合物应为人工产物,其在白及中的原始天然成分应为β-谷甾酮。
本研究的发现表明:(1)在天然药物研究中要注意溶剂的使用和样品的贮存,以避免样品被破坏。尤其是在氯仿作为提取分离溶剂时,更应注意避光等操作;(2)在天然成分提取分离过程中,应避免高温、强光、强氧化等条件。(3)若样品因一些客观原因发生了变化,也不能忽视变质后的人工产物。因为可能在某些未知因素下,一些化合物因结构改变而变得有价值或者产生毒性,进一步影响药材的作用;(4)本实验还提示含氯的甾体化合物可能对正常的肾细胞有毒性,在甾体化合物的结构修饰时应注意。
| [1] | Takagi S, Yamaki M, Inoue K. Antimicrobial agents from Bletilla striata [J]. Phytochemistry, 1983, 22(4): 1011-1015. |
| [2] | 韩广轩, 王立新, 张卫东, 等. 中药白及化学成分研究 (II) [J]. 第二军医大学学报, 2002, 23(9): 1029-1031. |
| [3] | Yamaki M, Bai L, Inoue K, et al. Benzylphenanthrenes from Bletilla striata [J]. Phytochemistry, 1990, 29(7): 2285-2287. |
| [4] | Yamaki M, Kato T, Bai L, et al. Phenanthrene glucosides from Bletilla striata [J]. Phytochemistry, 1993, 34(2): 535-537. |
| [5] | Feng J Q, Zhang R J, Zhao W M. Novel bibenzyl derivatives from the tubers of Bletilla striata [J]. Helv Chim Acta, 2008, 91(3): 520-525. |
| [6] | Yamaki M, Honda C, Kato T, et al. The steroids and triterpenoids from Bletilla striata [J]. Nat Med, 1997, 51(5): 493. |
| [7] | 韩广轩, 王立新, 王麦莉, 等. 中药白及化学成分的研究 [J]. 药学实践杂志, 2001, 19(6): 360-361. |
| [8] | Park J E, Woo K W, Choi S U, et al. Two new cytotoxic spirostane-steroidal saponins from the roots of Bletilla striata [J]. Helv Chim Acta, 2014, 97(1): 56-63. |
| [9] | Yang L, Meng C W, Peng C, et al. A new macrolide and six cycloartane triterpenoids from the tubers of Bletilla striata [J]. Biochem Syst Ecol, 2014, 57: 238-241. |
| [10] | 闻 韧. 药物合成反应 [M]. 第3版. 北京: 化学工业出版社, 2010. |
| [11] | Prachayasittikul S, Suphapong S, Worachartcheewan A, et al. Bioactive metabolites from Spilanthes acmella Murr. [J]. Molecules, 2009, 14(2): 850-867. |
 2015, Vol. 46
2015, Vol. 46



