蔓荆子Viticis Fructus始载于《神农本草经》,具有疏散风热、清利头目之功效,临床主要用于外感风热、头风头痛、齿龈肿痛、目赤多泪等症。《中国药典》2015年版第一部规定其基原植物为马鞭草科植物单叶蔓荆Vitex trifolia L. var. simplicifolia Cham. 或蔓荆Vitex trifolia L. 的干燥成熟果实。其主要分布于我国山东、浙江、福建、广东等省,生长于海边、河湖盐碱沙地,是一种优良的固沙植物。近年来对于蔓荆各部位的化学成分和药理作用有诸多研究报道,结果表明其化学成分结构类型多样,生物活性显著,在一定程度上阐明了其临床应用的理论依据。本文就《中国药典》2015年版收录的蔓荆子2种基原植物的化学成分和药理学研究进展进行综述。
1 化学成分目前从蔓荆中分离得到包括萜类、黄酮类、蒽醌类、木脂素类、酚酸类、甾醇及挥发油等多种类型化学成分。
1.1 萜类文献报道蔓荆含有多种类型的萜类化合物,其中以二萜类化合物数量最多,该类化合物在蔓荆的果实及叶片中均有发现,结构类型包括半日花烷型(labdane-type,1~23)、halimane型(24~29)、松香烷型(abietane-type,30~31)以及降二萜(32~36)。二萜类化合物名称和结构见表 1和图 1。
| 表 1 从蔓荆和单叶蔓荆中分离得到的二萜类化合物 Table 1 Diterpenoids isolated from V. trifolia and V. trifolia var. simplicifolia |
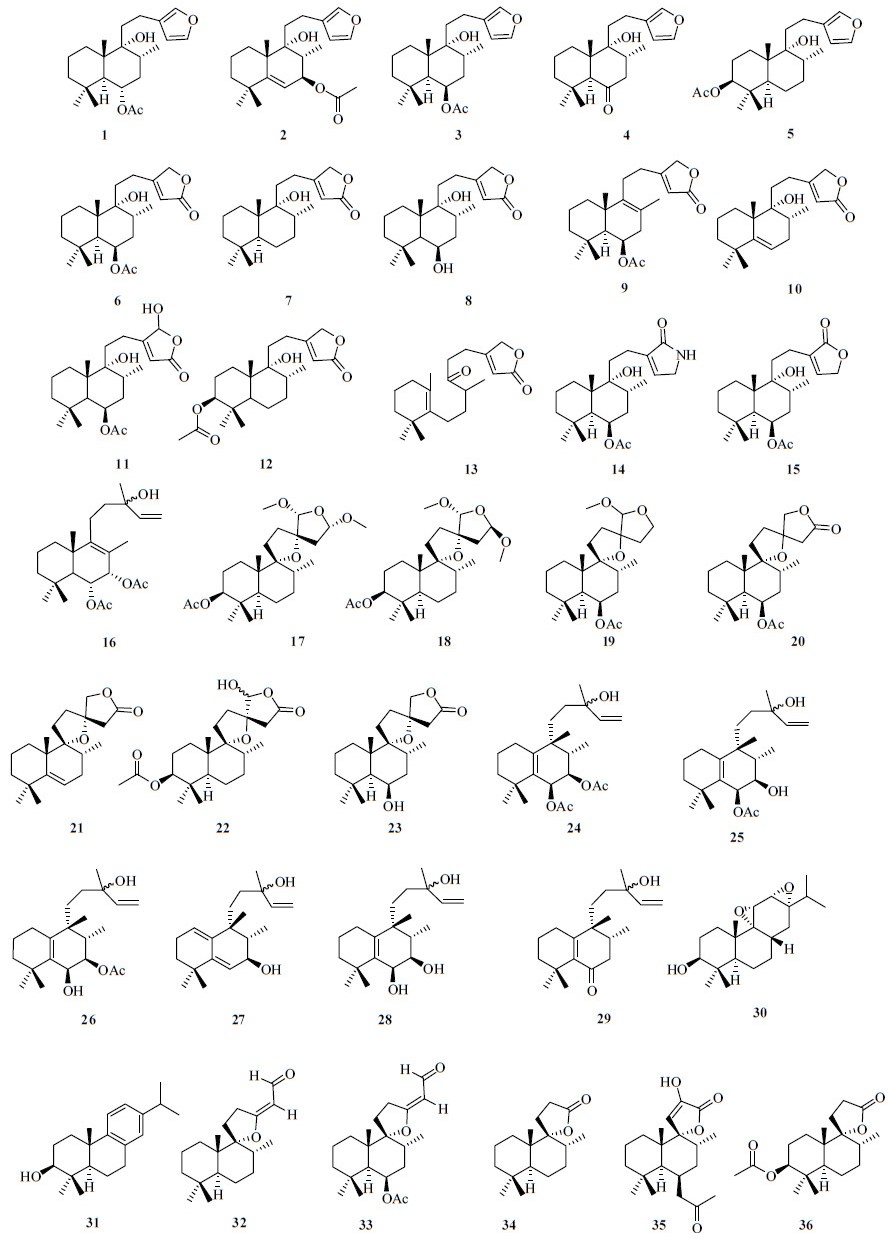 | 图 1 从蔓荆和单叶蔓荆中分离得到的二萜类化合物结构Fig.1 Structures of diterpenoids isolated from V. trifolia and V. trifolia var. simplicifolia |
三萜类化合物均为五环三萜,属于齐墩果烷型(oleanane-type)三萜的有齐墩果酸(oleanolic acid,37)[12]、2α,3β,24-三羟基-12-烯-28-齐墩果酸(38)[13]、,2α,3α,24-三羟基-12-烯-28-齐墩果酸(39)[13]、夏枯草皂苷A(vulgarsaponin A,40)[13]、蒲公英赛醇(taraxerol,41)[14]、蒲公英赛酮(taraxerone,42)[15]、3-oxotaraxer-14-en-30-al(43)[15];属于乌苏烷型(ursane-type)三萜的有α-香树精(α-amyrin,44)[9]、熊果醇(uvaol,45)[13]、熊果酸(乌苏酸,ursolic acid,46)[8, 9, 14]、科罗索酸(corosolic acid,47)[9]、3-表乌苏酸(3-epiursolic acid,48)[13, 15]、3β-乙酰氧基-12-烯-28-乌苏酸(49)[8]、2α,3α-二羟基-12-烯-28-乌苏酸(50)[14]、2α,3α,24-三羟基-12-烯-28-乌苏酸(51)[13]、2α,3β,19α-三羟基-12-烯-28-乌苏酸(52)[14];属于羽扇豆烷型(lupane-type)三萜的有羽扇豆醇(lupeol,53)[15]和白桦脂酸(betulinic acid,54)[8, 15]。三萜类化合物见图 2。
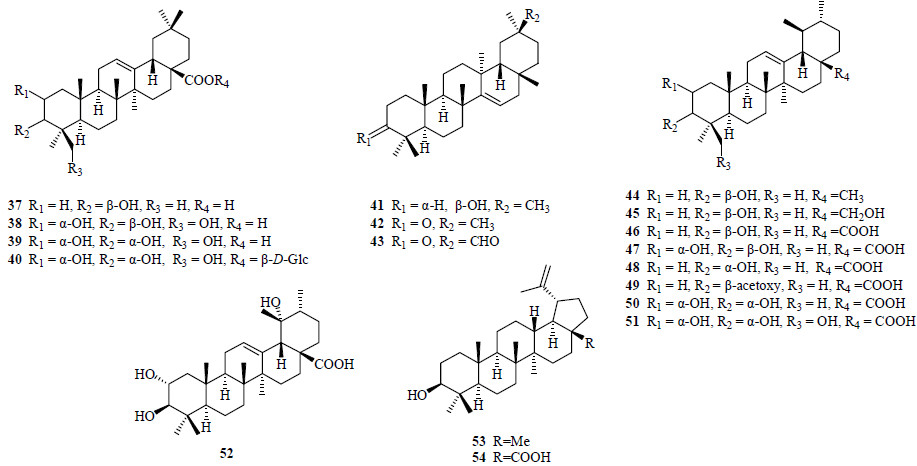 | 图 2 从蔓荆和单叶蔓荆中分离得到的三萜类化合物结构 Fig.2 Structures of triterpenoids isolated from V. trifolia and V. trifolia var. simplicifolia |
其他类型萜类化合物还包括单萜类和倍半萜类,单萜类包括环烯醚萜及其苷,如穗花牡荆苷(agnuside,55)[4, 7, 9, 16]、10-O-vanilloylaucubin(56)[16]、mussaenosidic acid(57)[9]、negundoside(58)[9]、6′-p-hydroxybenzoyl mussaenosidic acid(59)[9]、nishindaside(60)[16]、杜仲醇(eucommiol,61)[17];桉树脑型单萜苷,如 (1S,2S, 4R)-2-endo-hydroxyl-1,8-cineole-β-D-glucopyranoside(62)[16]和 (1R,2R,4S)-2-endo-hydroxyl-1,8-cineole-β-D- glucopyranoside(63)[16]。倍半萜类包括aromadendrane型的spathulenol(64)[7]和ent-4α,10β-dihydroxyaroma- dendrane(65)[7]。单萜类和倍半萜类化合物见图 3。
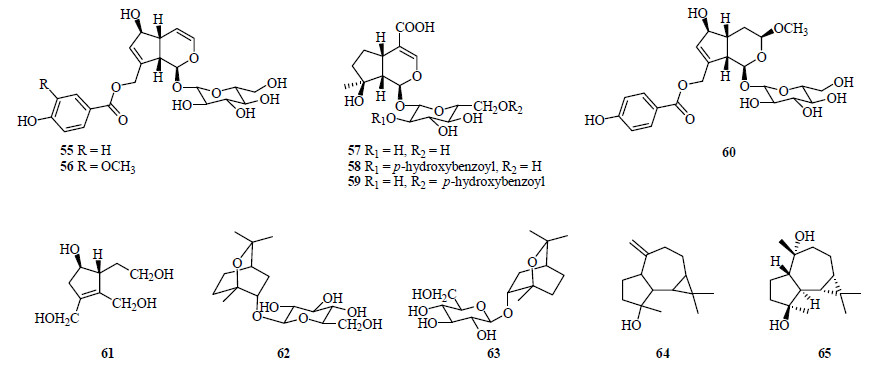 | 图 3 从蔓荆和单叶蔓荆中分离得到的单萜和倍半萜类化合物结构Fig.3 Structures of monoterpenoids and sesquiterpenoids isolated from V. trifolia and V. trifolia var. simplicifolia |
从蔓荆中分离得到的黄酮类化合物包括黄酮、黄酮醇以及二氢黄酮,其中黄酮类有木犀草素(luteolin,66)[4, 12, 15, 16, 17, 18, 19]、芹菜素(apigenin,67)[12]、5,7,2′,5′-四羟基黄酮(68)[4]、牡荆素(vitexin,69)[9]、木犀草素-7-O-β-D-葡萄糖醛酸苷(70)[20]、木犀草素-3′-O-β-D-葡萄糖醛酸苷(71)[20]、异荭草素(isoorientin,72)[20];黄酮醇类有3,6,7-三甲基槲皮万寿菊素(chrysosplenol D,73)[9, 17, 21, 22]、紫花牡荆素(蔓荆子黄素,vitexicarpin,casticin,74)[4, 9, 15, 16, 17, 18, 19, 21, 22, 23]、蒿亭(artemetin,75)[4, 15, 17, 21, 24]、7-desmethyl artemetin(76)[24]、penduletin(77)[17]、槲皮素(quercetin,78)[12, 16]、山柰酚(kaempferol,79)[16]、3′,5-二羟基- 3,4′,7-三甲氧基黄酮(80)[23]、4′,5-二羟基-3,6,7-三甲氧基黄酮(81)[23]、山柰酚-3-O-葡萄糖苷(82)[23];二氢黄酮类有persicogenin(83)[17]、5,3′-二羟基- 6,7,4′-三甲氧基二氢黄酮(84)[19]。上述黄酮类化合物多数为黄酮苷元,黄酮苷仅有5个,包括2个黄酮碳苷牡荆素(69)和异荭草素(72)。全部黄酮类化合物共同特点是C-7位均为羟基取代。黄酮B环的取代模式以C-4′位单取代或C-3′, 4′位双取代为主,其他取代模式仅有5,7,2′,5′-四羟基黄酮(68)。黄酮类化合物结构及名称见图 4和表 2。
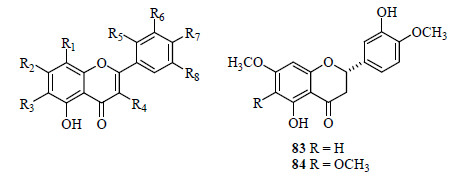 | 图 4 黄酮类化合物母核及化合物83 和84 的结构Fig.4 Stem-nucleus of flavonoids and structures of compounds 83 and 84 |
| 表 2 从蔓荆和单叶蔓荆中分离得到的黄酮类化合物 Table 2 Flavonoids isolated from V. trifolia and V. trifolia var. simplicifolia |
从云南西双版纳产的蔓荆果实中分离得到大黄素甲醚(physcion,85)[7]。从同样产自西双版纳的蔓荆茎和叶中分离得到大黄素(emodin,86)[18]、大黄酚(chrysophanol,87)[19]和大黄素甲醚(85)[18]。蒽醌类化合物结构见图 5。
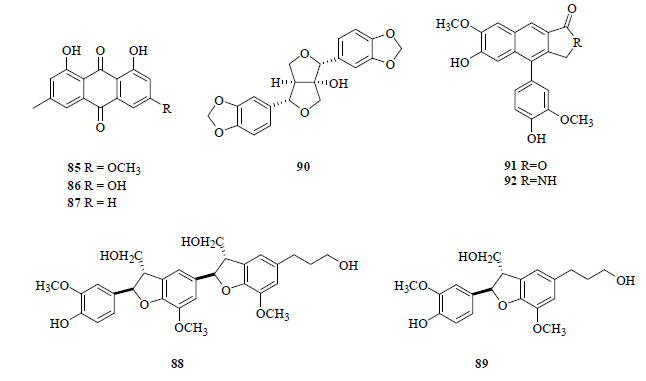 | 图 5 从蔓荆和单叶蔓荆中分离得到的蒽醌和木脂素类化合物结构Fig.5 Structures of anthraquinones and lignans isolated from V. trifolia and V. trifolia var. simplicifolia |
从蔓荆中分离得到的木脂素类化合物有苯并呋喃类型的vitrifol A(88)和dihydrodehydrodiconifenyl alcohol(89)[25],双四氢呋喃类型的泡桐素(paulownin,90)[7],以及芳基萘类型的去四氢铁杉脂素(detetrahydroconidendrin,91)[18]和黄荆胺A(vitedoamine A,92)[18]。木脂素类化合物结构见图 5。
1.5 酚酸类蔓荆中含有较多的酚酸类化合物,包括对羟基苯甲酸(93)[4, 7, 8, 9, 12, 15, 16, 21, 22]、对甲氧基苯甲酸(94)[9]、2-羟基-3-甲氧基苯甲酸(95)[9]、2,3-二羟基苯甲酸(96)[9]、3,4-二羟基苯甲酸(97)[4, 12]、香草酸(vanillic acid,98)[12]、对羟基苯甲酸乙酯(99)[12]、咖啡酸(caffeic acid,100)[12]、顺式对羟基肉桂酸乙酯(101)[12]、反式对羟基肉桂酸乙酯(102)[12]以及松柏醛(coniferyl aldehyde,103)[12]。酚酸类化合物的结构见图 6。
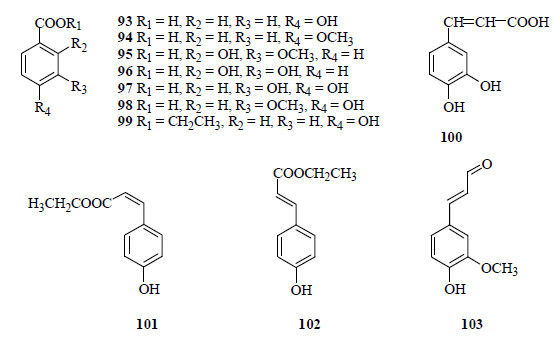 | 图 6 从蔓荆和单叶蔓荆中分离得到的酚酸类化合物结构Fig.6 Structures of phenolic acid compounds isolated from V. trifolia and V. trifolia var. simplicifolia |
从蔓荆中分离得到的甾类化合物包括β-谷甾醇(β-sitosterol,104)[4, 7, 8, 15, 19]、β-胡萝卜苷(β- daucosterol,105)[15]、豆甾醇(stigmasterol,106)[4]、豆甾-3,7-二酮(107)[4]、扶桑甾醇棕榈酸酯(108)[13]、过氧麦角甾醇(peroxyergosterol,109)[7]以及stigmast-4- en-6β-ol-3-one(110)[25]。甾体类化合物的结构见图 7。
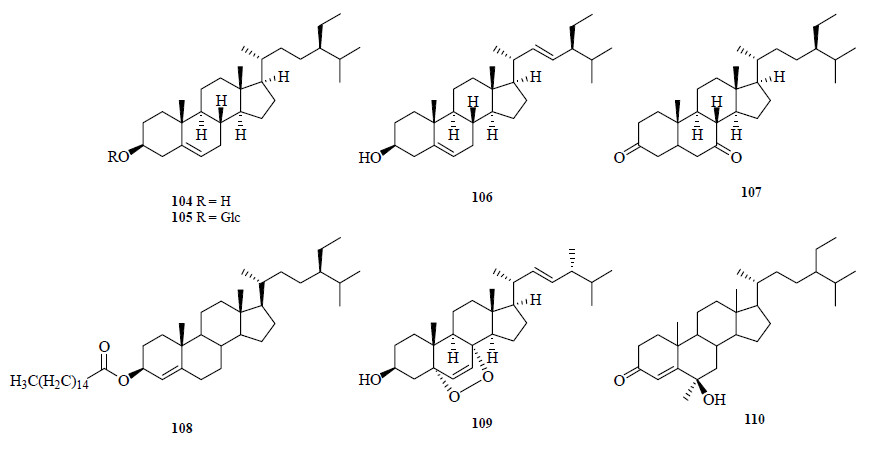 | 图 7 从蔓荆和单叶蔓荆中分离得到的甾体类化合物结构Fig.7 Structures of steroids isolated from V. trifolia and V. trifolia var. simplicifolia |
蔓荆中还含有多种氨基酸、脂肪酸、维生素和矿物质[26, 27]。此外,新鲜蔓荆果实中含有大量的挥发油成分[28, 29],炮制品挥发油的量明显少于生品[30]。
2 药理作用 2.1 抗炎作用Matsui等[31, 32]研究发现,在RAW 264.7细胞中,蔓荆叶水提物能够抑制脂多糖诱导的细胞因子表达和诱导型一氧化氮合成酶(iNOS)mRNA的合成,从而发挥抗炎作用。林珊等[33]发现ig紫花牡荆素对于乙酸致小鼠腹膜毛细管通透性增加具有显著的抑制作用,对于二甲苯致小鼠耳廓肿胀、鸡蛋清致大鼠足肿胀的抑制作用可能与抑制炎症因子释放有关。
2.2 抗氧化作用刘红燕等[34, 35, 36]提取蔓荆果实的挥发油、总黄酮和粗生物碱,分别进行体外化学模拟抗氧化活性研究,3类成分对羟基自由基和超氧自由基的清除能力与药物浓度均呈明显的量效关系,挥发油和总黄酮对羟基自由基和超氧自由基清除能力与其浓度呈正相关;生物碱对羟基自由基清除能力与其浓度呈正相关,对超氧自由基清除能力与其浓度呈负相关。Tiwari等[37]从蔓荆中分离得到的环烯醚萜苷negundoside、agnuside和6′-p-hydroxybenzoyl mussaenosidic acid对DPPH自由基和NO自由基具有较强的清除活性。上述3个化合物对DPPH自由基清除活性的IC50值分别为9.96、9.81和10.31 μg,对NO自由基的清除活性的IC50值分别为16.25、12.90和13.51 μg。
2.3 解热镇痛作用孙蓉等[38]采用小鼠热板法测试单叶蔓荆不同炮制品、所含组分和用药部位的镇痛效果。结果显示,炒焦蔓荆子效果最强;挥发油和总黄酮是主要镇痛成分,且总黄酮作用优于挥发油;其果实可以镇痛,宿萼则无效果。隋在云等[39]采用大鼠sc 2,4-二硝基酚建立发热模型,以云南、山东产蔓荆子生品和山东蔓荆子不同炒制品的水煎液ig给药,结果显示两地蔓荆子生品均可以显著降低大鼠体温,山东蔓荆子的微炒、炒焦、炒炭炮制品均可降低大鼠体温,其中微炒品效果最持久。
2.4 抑制组胺释放作用Ikawati等[40]选取印度尼西亚民间用于治疗哮喘疾病的12种植物药,分别测试各植物乙醇和正己烷提取物对大鼠嗜碱性粒细胞性白血病RBL-2H3细胞免疫球蛋白IgE依赖的组胺释放的抑制作用。其中蔓荆叶乙醇和正己烷提取物的组胺释放抑制率分别为(81.58±0.24)%和(80.13±3.95)%。Alam等[41]发现蔓荆叶片的正己烷提取物对气管挛缩具有抑制作用,采用液-液萃取法将正己烷提取物分离得到4个部分,从活性最强的部分分离得到viteosin A和vitexicarpin。活性测试显示2个化合物对于组胺释放引起的雄性几内亚猪气管收缩均有抑制作用。只有vitexicarpin浓度达到13 μmol/L时才对由卵清蛋白致敏几内亚猪气管引起的收缩有抑制作用。
2.5 抗肿瘤作用Li等[2, 17]从蔓荆中发现的5个半日花烷型二萜和6个黄酮类化合物对于人慢性髓性白血病K562细胞和小鼠乳腺癌tsFT210细胞均具有不同程度的细胞周期抑制作用,能够诱导肿瘤细胞凋亡。王海燕等[42]发现蔓荆中的vitexicarpin对人多种癌细胞均有较强的抑制作用,其中K562细胞加药处理后呈典型凋亡状态,机制研究表明其是通过激活线粒体调控的凋亡通路诱导K562细胞凋亡。曹晓诚等[43]研究发现蔓荆子总黄酮能抑制人小细胞肺癌NCI-H466细胞干细胞的自我更新,其机制与下调p-Akt蛋白表达和抑制细胞自我更新转录因子Bmil有关。
2.6 其他作用蔓荆不同部位提取物还有其他多种药理作用,蔓荆叶乙醇提取物能够促进小鼠伤口愈合[44],蔓荆叶有机溶剂提取物还具有抗真菌[45]和抗菌活性[46, 47],地上部分的水提物具有HIV-1逆转录酶抑制活性[48]。此外,蔓荆叶有机溶剂提取物还具有拒食作用[49]和杀虫活性[50, 51, 52, 53]。
3 结语蔓荆子是传统中药,具有祛风止痛、清利头目之功效,从《中国药典》2015年版收录的蔓荆子基原植物各部位化学成分和药理活性的研究情况来看,化学成分研究以叶和果实为主,化合物结构类型主要包括萜类、黄酮类、蒽醌类、木脂素类及挥发油。药理研究涉及多种药理活性模型,且均具有较为显著的生物活性。但从总体研究情况是化学成分研究与药理研究结合不紧密,药理活性研究以提取物为主,单体化合物研究相对较少。因此,建议对于蔓荆的研究应更加注重化学成分和药理研究相结合,特别是单体化学成分的药理活性及其作用机制的研究,阐明临床疗效的物质基础,为临床合理用药提供理论依据。
| [1] | Ono M, Sawamura H, Ito Y, et al. Diterpenoids from the fruits of Vitex trifolia[J]. Phytochemistry, 2000, 55(8): 873-877. |
| [2] | Li W X, Cui C B, Cai B, et al. Labdane-type diterpenes as new cell cycle inhibitors and apoptosis inducers from Vitex trifolia L[J]. J Asian Nat Prod Res, 2005, 7(2): 95-105. |
| [3] | Zheng C J, Zhu J Y, Yu W, et al. Labdane-type diterpenoids from the fruits of Vitex trifolia[J]. J Nat Prod, 2013, 76(2): 287-291. |
| [4] | 辛海量, 胡 园, 张巧艳, 等. 蔓荆子的化学成分研究[J]. 第二军医大学学报, 2006, 27(9): 1038-1040. |
| [5] | Wu J, Zhou T, Zhang S W, et al. Cytotoxic terpenoids from the fruits of Vitex trifolia L.[J]. Planta Med, 2009, 75(4): 367-370. |
| [6] | Kiuchi F, Matsuo K, Ito M, et al. New norditerpenoids with trypanocidal activity from Vitex trifolia[J]. Chem Pharm Bull, 2004, 52(12): 1492-1494. |
| [7] | 顾 琼, 张雪梅, 姜志勇, 等. 蔓荆的化学成分研究[J]. 中草药, 2007, 38(5): 656-659. |
| [8] | 闫利华, 张启伟, 王智民, 等. 三叶蔓荆化学成分研究 (II)[J]. 中草药, 2010, 41(10): 1622-1624. |
| [9] | Tiwari N, Thakur J, Saikia D, et al. Antitubercular diterpenoids from Vitex trifolia[J]. Phytomedicine, 2013, 20(7): 605-610. |
| [10] | Ono M, Ita Y, Nohara T. Four new halimane-type diterpenes, vitetrifolins D-G, from the fruit of Vitex trifolia[J]. Chem Pharm Bull, 2001, 49(9): 1220-1222. |
| [11] | Zhang T, Zhang C X, Xie W D, et al. Vitrifolin A: A norlabdane diterpenoid from the fruits of Vitex trifolia Linn. var. simplicifolia Cham[J]. J Chin Chem Soc, 2013, 60(5): 542-545. |
| [12] | 陈永胜, 林小燕, 钟林静, 等. 三叶蔓荆的化学成分研究[J]. 天然产物研究与开发, 2011, 23(6): 1011-1013. |
| [13] | 刘全裕, 陈永胜, 王 菲, 等. 蔓荆的化学成分[J]. 中国中药杂志, 2014, 39(11): 2024-2028. |
| [14] | 陈永胜, 谢捷明, 姚 宏, 等. 蔓荆三萜类成分研究[J]. 中药材, 2010, 33(6): 908-910. |
| [15] | Huang M Y, Zhou L J, Xie J M, et al. A new taraxastane-type triterpene from Vitex trifolia var. simplicifolia[J]. Helv Chim Acta, 2013, 96(11): 2040-2045. |
| [16] | 吴 闯, 张 健, 殷志琦. 蔓荆子化学成分研究[J]. 药物生物技术, 2010, 17(6): 504-507. |
| [17] | Li W X, Cui C B, Cai B, et al. Flavonoids from Vitex trifolia L. inhibit cell cycle progression at G2/M phase and induce apoptosis in mammalian cancer cells[J]. J Asian Nat Prod Res, 2005, 7(4): 615-626. |
| [18] | 闫利华, 徐丽珍, 林 佳, 等. 三叶蔓荆化学成分研究 (I)[J]. 中草药, 2009, 40(4): 531-533. |
| [19] | 陈柳生, 康大力. 蔓荆子中化学成分的研究[J]. 海峡药学, 2008, 20(7): 90-92. |
| [20] | Ramesh P, Nair A G R, Subramanian S S. Flavone glycosides of Vitex trifolia[J]. Fitoterapia, 1986, 57(4): 282-283. |
| [21] | 管仁军, 王岱杰, 于宗渊, 等. 高速逆流色谱分离纯化蔓荆子中的活性成分[J]. 色谱, 2010, 28(11): 1043-1047. |
| [22] | 曽宪仪, 方乍浦, 吴永忠, 等. 蔓荆子化学成分研究[J]. 中国中药杂志, 1996, 21(3): 167-168. |
| [23] | 陈鸿雁, 程伟贤, 冯 宇, 等. 单叶蔓荆子黄酮类化学成分研究[J]. 天然产物研究与开发, 2008, 20(4): 582-584. |
| [24] | Ramachandran A G, Ramesh P, Subramanian S S. Two unusual flavones (artemetin and 7-desmethyl artemetin) from the leaves of Vitex trifolia[J]. Curr Sci, 1975, 44(7): 214-216. |
| [25] | Gu Q, Zhang X M, Zhou J, et al. One new dihydrobenzofuran lignan from Vitex trifolia[J]. J Asian Nat Prod Res, 2008, 10(6): 499-502. |
| [26] | 陈体强, 朱金荣, 吴锦忠, 等. 单叶蔓荆子化学成分研究初报[J]. 中国野生植物资源, 2006, 25(5): 50-52. |
| [27] | 杨 洁, 姚毅臣. 蔓荆籽营养成分的研究[J]. 江西水利科技, 1994, 20(1): 63-67. |
| [28] | 李智立, 刘淑莹. 单叶蔓荆子挥发油成分的GC/MS分析[J]. 色谱, 1997, 15(4): 344-346. |
| [29] | 彭艳丽, 刘红燕, 张炳桢. 山东不同产地单叶蔓荆子挥发油GC-MS分析[J]. 山东中医药大学学报, 2005, 29(2): 146-155. |
| [30] | 郭长强, 苏德民, 程立方, 等. 蔓荆子不同炮制品挥发油GC-MS分析[J]. 中草药, 1996, 27(9): 521-523. |
| [31] | Matsui M, Kumar-Roine S, Darius H T, et al. Characterisation of the anti-inflammatory potential of Vitex trifolia L. (Labiatae), a multipurpose plant of the Pacific traditional medicine[J]. J Ethnopharmacol, 2009, 126(3): 427-433. |
| [32] | Matsui M, Adib-Conquy M, Coste A, et al. Aqueous extract of Vitex trifolia L. (Labiatae) inhibits LPS-dependent regulation of inflammatory mediators in RAW 264. 7 macrophages through inhibition of nuclear factor kappa B translocation and expression[J]. J Ethnopharmacol, 2012, 143(1): 24-32. |
| [33] | 林 珊, 张 宏, 韩 婷, 等. 紫花牡荆素体内抗炎作用的研究[J]. 中西医结合学报, 2007, 5(5): 573-576. |
| [34] | 刘红燕. 蔓荆子挥发油体外化学模拟抗氧化活性的研究[J]. 抗感染药学, 2014, 11(2): 119-121. |
| [35] | 马艳妮, 刘红燕. 蔓荆子总黄酮的体外抗氧化活性研究[J]. 山东中医杂志, 2014, 33(8): 670-671. |
| [36] | 刘红燕. 蔓荆子生物碱体外化学模拟抗氧化活性的研究[J]. 抗感染药学, 2014, 11(3): 197-199. |
| [37] | Tiwari N, Luqman S, Masood N, et al. Validated high performance thin layer chromatographic method for simultaneous quantification of major iridoids in Vitex trifolia and their antioxidant studies[J]. J Pharm Biomed Anal, 2012, 61: 207-214. |
| [38] | 孙 蓉, 郭长强, 高洪常, 等. 蔓荆子的炮制药效学研究[J]. 中草药, 1997, 29(1): 32-34. |
| [39] | 隋在云, 王爱洁. 蔓荆子解热作用的实验研究[J]. 中药药理与临床, 2007, 23(5): 138-139. |
| [40] | Ikawati Z, Wahyuono S, Maeyama K. Screening of several indonesian medicinal plants for their inhibitory effect on histamine release from RBL-2H3 cells[J]. J Ethnopharmacol, 2001, 75(2/3): 249-256. |
| [41] | Alam G, Wahyunono S, Ganjar I G, et al. Tracheospasmolytic activity of viteosin A and vitexicarpin isolated from Vitex trifolia[J]. Planta Med, 2002, 68(11): 1047-1049. |
| [42] | 王海燕, 蔡 兵, 崔承彬, 等. 蔓荆子活性成分Vitexicarpin诱导K562细胞凋亡的机制[J]. 药学学报, 2005, 40(1): 27-31. |
| [43] | 曹晓诚, 肖立红, 肖 乔, 等. 蔓荆子总黄酮抑制NCI-H446细胞系肺癌干细胞自我更新[J]. 中草药, 2014, 45(9): 1284-1287. |
| [44] | Manjunatha B K, Vidya S M, Krishna V, et al. Comparative evaluation of wound healing potency of Vitex trifolia L. and Vitex[J]. Phytother Res, 2007, 21(5): 457-461. |
| [45] | Hernández M M, Heraso C, Villarreal M L, et al. Biological activities of crude plant extracts from Vitex trifolia L. (Verbenaceae)[J]. J Ethnopharmacol, 1999, 67(1): 37-44. |
| [46] | Hossain M H, Paul N, Sohrab M H, et al. Antibacterial activity of Vitex trifolia[J]. Fitoterapia, 2001, 72(6): 695-697. |
| [47] | Kannathasan K, Senthikumar A, Venkatesalu V. In vitro antibacterial potential of some Vitex species against human pathogenic bacteria[J]. Asian Pac J Trop Med, 2011, 4(8): 645-648. |
| [48] | Woradulayapinij W, Soonthornachareonnon N, Wiwat C. In vitro HIV type 1 reverse transcriptase inhibitory activities of Thai medicinal plants and Canna indica L. rhizomes[J]. J Ethnopharmacol, 2005, 101(1/3): 84-89. |
| [49] | 高 燕, 盛广为, 沈嘉祥, 等. 三叶蔓荆子提取物对小菜蛾的拒食活性[J]. 应用昆虫学报, 2012, 49(5): 1298-1303. |
| [50] | Kannathasan K, Senthilkumar A, Chandrasekaran M, et al. Differential larvicidal efficacy of four species of Vitex against Culex quinquefasciatus larvae[J]. Parasitol Res, 2007, 101(6): 1721-1723. |
| [51] | Kannathasan K, Senthilkumar A, Venkatesalu V. Mosquito larvicidal activity of methyl-p-hydroxybenzoate isolated from the leaves of Vitex trifolia Linn.[J]. Acta Trop, 2011, 120(1/2): 115-118. |
| [52] | Nyamoita M G, Ester I, Zakaria M H, et al. Comparison of the effects of extracts from three Vitex plant species on Anopheles gambiae s. s. (Diptera: Culicidae) larvae[J]. Acta Trop, 2013, 127(3): 199-203. |
| [53] | Tandon S, Mittal A K, Pant A K. Insect growth regulatory activity of Vitex trifolia and Vitex agnus-castus essential oils against Spilosoma oblique[J]. Fitoterapia, 2008, 79(4): 283-286. |
 2015, Vol. 46
2015, Vol. 46


