2. 江西省中药种质资源工程技术研究中心, 江西 南昌 330004;
3. 桂林医学院, 广西 桂林 541004
2. Chinese Medicine Germplasm Resource Engineering Technology Research Center of Jiangxi Province, Nanchang 330004, China;
3. Guilin Medical University, Guilin 541004, China
穿心莲Andrographis paniculata (Burm. f.)Nees为爵床科一年生草本植物,有清热解毒、抗炎、消肿止痛作用。穿心莲内酯是穿心莲的主要活性成分,属于二萜类化合物,国内已经利用穿心莲内酯开发出多种中药产品,包括天津天士力制药股份有限公司研制开发的穿心莲内酯滴丸、哈药集团三精制药股份有限公司生产的穿琥宁注射液等,这些中药制剂在避免滥用抗生素方面发挥了一定的作用[1]。穿心莲属于热带植物,原产于印度半岛和斯里兰卡,由于其野生资源匮乏和重要的药用价值,在印度、斯里兰卡等被列为严禁出口的保护物种。我国的穿心莲系外来引种栽培物种,药用首见于《岭南采药录》(1932年),以“春莲秋柳”之名记载[2],引种栽培至少已有80余年的历史,现广西、广东、福建、海南、安徽、四川、陕西等省份均有种植,除作药材外,也用作穿心莲内酯的生产原料。然而,有研究表明,不同产地穿心莲药材质量差异显著,穿心莲内酯的量相差5~6倍[3]。另一方面,由于各地引种穿心莲的种源单一,穿心莲严格的自花授粉特性也阻碍了其遗传物质交流,使得我国穿心莲的种质遗传多样性水平很低[4],种群适应性较弱。另外,上述各穿心莲种植地的生态环境也存在较大的差异,提示穿心莲中穿心莲内酯的量系受到穿心莲内酯体内生物合成水平和产地生态因子的双重影响。因此,探讨穿心莲内酯的生物合成途径,具有重要意义。
穿心莲内酯在穿心莲的茎、叶片和根系培养物中均可合成[5, 6, 7, 8]。研究表明,穿心莲内酯的生物合成有2条途径,一条为甲羟戊酸(mevalonic acid,MVA)途径,定位在细胞质中;另一条为2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径,发生于质体中。在这2条途径中,香叶基香叶基焦磷酸(geranylgeranyl dilphosphate,GGPP)是穿心莲内酯合成的前体,它是在香叶基香叶基焦磷酸合成酶(geranylgeranyldiphosphate synthase,GGPS)的作用下,由法尼基焦磷酸(farnesyl diphosphate,FPP)加上一个异戊烯基焦磷酸(isopentenyl diphosphate,IPP)基团后产生的。有学者克隆了GGPS基因的片段,进一步检测结果表明,GGPS基因的表达量与穿心莲内酯的合成量呈现高度正相关[9]。本研究利用RACE技术,从穿心莲中克隆了GGPS基因的全长序列,并研究其在穿心莲茎、叶发育不同阶段的表达情况,为穿心莲内酯合成途径的调控奠定基础。
1 材料与仪器 1.1 材料2015年购买穿心莲种子,6月份种植在江西中医药大学神农园中,长成植株后,经江西中医药大学钟国跃研究员鉴定为爵床科植物穿心莲Andrographis paniculata (Burm. f.)Nees。
1.2 仪器PCR 扩增在Bio RadPCR 仪(C1000 Touch)上进行,在Bio Rad化学发光成像系统(ChemiDocXRS+)上检测扩增条带。连接产物的电击转化在BTX电穿孔仪(Gene Pulser Xcell)上进行。基因表达分析在Applied BiosystemsViiA7 Real-Time PCR System上进行。
1.3 试剂CTAB、LiCl、PVPK25、Tris-HCl、EDTA、β-巯基乙醇、DEPC、氯仿、异戊醇、NaAc等总RNA提取所用化学试剂以及核酸电泳所用试剂均为分析纯,购自生工生物工程(上海)股份有限公司。
胶回收试剂盒购自上海捷瑞生物工程有限公司。Roche逆转录试剂盒(TranscriptorcDNA Synth. Kit 2)、Roche FS Universal SYBR Green Master购自南昌东湖强生生物试剂经营部。SYBR Green染料、SMARTerTMRACE cDNA扩增试剂盒、克隆载体、连接酶、大肠杆菌菌株、Tks Gflex DNA聚合酶等其他分子生物学试剂均购自宝生物工程(大连)有限公司。PCR产物和阳性单克隆测序由北京鼎国昌盛生物技术有限责任公司完成。所有引物均由苏州泓迅生物科技有限公司合成(表 1)。
| 表 1 克隆GGPS基因所用的引物 Table 1 Primers used in GGPS gene cloning |
取穿心莲植株地上部分,按文献方法[10]提取总RNA,用1%琼脂糖凝胶电泳检测提取产物,用于克隆全长基因。采用Roche逆转录试剂盒(Transcriptor cDNA Synth.Kit 2)获得cDNA,每个样品的总体积20 μL。首先在12 μL总RNA中加入1 μL Anchored-oligo(dT)18 Primer,轻轻混匀后,在65 ℃反应10 min;然后再加入4 μL Buffer,0.5 μL RNase Inhibitor,2 μL dNTP mix,0.5 μL反转录酶,轻轻混匀,在55 ℃放置30 min后,转为85 ℃反应5 min,4 ℃终止反应。
2.2 克隆保守区段按照文献方法[11]进行2轮PCR扩增,反应总体积20.0 μL,包括cDNA产物1.0 μL,10×Ex Taq buffer 2.0 μL,dNTP mix(10 mmol/L)1.6 μL,上下游引物(第1轮为GGPS-F2和GGPS-R2,第2轮为GGPS-F1和GGPS-R1,10 μmol/L)各5 μL,ExTaq 0.3 μL和5.1 μL ddH2O。第1轮PCR扩增条件为95 ℃、5 min;94 ℃、1 min,30 ℃、3 min,72 ℃、1 min,20个循环;72 ℃、10 min。第2轮PCR扩增条件为95 ℃、5 min;94 ℃、1 min,30 ℃、3 min,72 ℃、50 s,35个循环;72 ℃、10 min。反应结束后,用1%琼脂糖凝胶电泳检测产物。切胶回收清晰的条带后,进行测序。
2.3 反转录获得cDNA按照SMARTerTM RACE cDNA扩增试剂盒说明书,制备5’RACE cDNA和3’RACE cDNA,分别用于5’RACE和3’RACE反应。在配制反转录体系时,根据文献方法[12]使用了海藻糖(trehalose)和甜菜碱(betaine),因而对说明书中的反转录体系略加改动。
2.4 配制引物工作液UPM引物需要配制成10倍混合液。先把UPM Long和UPM Short引物稀释成10 μmol/L,取UPM Long引物4 μL,UPM Short引物20 μL,最后加入76 μL灭菌水,混合即成10×UPM引物工作液。其他引物均配制成10 μmol/L工作液。
2.5 3’RACE反应采用巢式PCR扩增3’端序列。在第1轮扩增反应中,首先配制总体积为40.5 μL的Mastermix,由34.5 μL ddH2O、5.0 μL 10×Advantage 2 PCR buffer、1.0μL 50×Advantage 2 polymerase mix组成。然后在Master mix中分别加入2.5μL 3’RACE cDNA和5.0 μL 10×UPM引物,使得总体积达到50.0 μL。PCR扩增条件为94 ℃、30 s,72 ℃、3 min,5 个循环;94 ℃、30 s,70 ℃、30 s,72 ℃、3 min,5个循环;94 ℃、30 s,68 ℃、30s,72 ℃、3 min,25个循环;72 ℃、10 min。将第1轮PCR产物用TE稀释50倍,取2.5 μL用作模板,分别加入41.5 μL Master mix,1.0 μL 5’Primer II A引物(10 μmol/L)和AP-GGPS-3’引物(10 μmol/L),总体积50.0μL,进行第2轮PCR。扩增条件为94 ℃、30 s;68 ℃、30 s,72 ℃、3 min,20 个循环;72 ℃、10 min。
反应结束后,用1%琼脂糖凝胶电泳检测产物。切胶回收清晰的条带后,进行TA克隆,筛选阳性单克隆后测序。
2.6 5’RACE反应使用TaKaRaTks Gflex DNA聚合酶进行2轮巢式PCR扩增。第1轮扩增的反应总体积为50.0 μL,包括2.5 μL 5’RACE cDNA,25.0 μL 2×GflexPCR buffer(Mg2+,dNTP plus),1.0μL Tks Gflex DNA Polymerase(1.25 U/μL),0.5 μL 10×UPM引物,1.0 μL CTG0074 R1 引物(10μmol/L)和15.5 μL ddH2O;第2轮扩增的反应总体积为50.0 μL,包括1.0 μL第1轮PCR反应液,25.0 μL 2×Gflex PCR buffer(Mg2+,dNTP plus),1.0μL Tks Gflex DNA Polymerase(1.25 units/μL),1.0 μL 5’PCR Primer IIA引物和CTG0074 R2 引物(10 μmol/L),21.0μL ddH2O。2轮PCR扩增条件均为94 ℃、1 min;98 ℃、10 s,55 ℃、15 s,68 ℃、1 min,30个循环。
反应结束后,用1%琼脂糖凝胶电泳检测产物。切胶回收清晰的条带后,进行TA克隆,筛选阳性单克隆后测序。
2.7 GGPS基因的拼接、扩增和生物信息学分析利用CodonCode Aligner软件进行序列拼接。根据拼接后的序列,设计两侧引物,从穿心莲cDNA中进行全长序列的扩增。用1%琼脂糖凝胶电泳检测扩增产物。切胶回收清晰的条带后,进行TA克隆,筛选阳性单克隆后测序。
BioEdit软件进行开放阅读框(open reading frame,ORF)编码氨基酸序列的翻译,NCBI网站上的Conserved Domain Search程序(http://www. ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行保守结构域分析,BlastP程序(http://www.ncbi.nlm. nih.gov/BLAST/)做同源性搜索。采用ProtParam软件(http://au.expasy.org/tools/protparam.html)计算蛋白质的相对分子质量和等电点,预测一级结构。采用DNAMAN软件进行蛋白质的多序列比对,MEGA6.06软件构建系统进化树。用ChloroP 1.1 Server软件(http://www.cbs.dtu.dk/services/ChloroP/)鉴定蛋白质的叶绿体定位信号序列。
2.8 GGPS基因表达分析在花蕾期、初花期、花果混合期、青果期,分别取穿心莲植株的地上部分,分离茎和叶,分别提取总RNA,用于基因表达分析。每个时期各取3株。总RNA提取和反转录方法同上。
采用SYBR Green染料法,进行实时荧光定量RT-PCR反应,总体积为10 μL,GGPS基因的扩增引物为5’-GAGCAGAAATAACCAGCCATCA-3’和5’-CGGTAGAATAGATCAAATCGCAGT-3’,预期产物大小为207 bp;根据穿心莲18S核糖体RNA基因序列(GenBank:FJ002343.1)设计内参引物5’-TTTCTGCCCTATCAACTTTCGA-3’和5’-CTGC-CTTCCTTGGATGTGGT-3’,预期产物大小为125 bp。扩增程序是95 ℃、10 min;95 ℃ 15s,60 ℃、30 s,72 ℃、30 s,40个循环;熔解曲线是95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。
每个模板每次扩增3个复孔。实验重复3次,采用比较CT值法[13]在Excel软件上分析相对表达量,通过单因素方差分析检验数据的差异显著性。
3 结果与分析 3.1 总RNA提取利用无液氮法,提取获得了质量较好的穿心莲总RNA(图 1)。
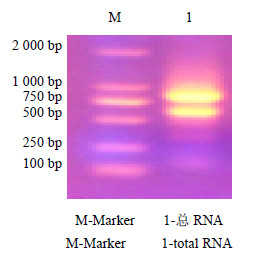 | 图 1 穿心莲总RNAFig.1 Total RNA extracted from A. paniculata |
保守区段扩增后,经琼脂糖凝胶电泳检测产物,略小于500 bp处有一条带。回收后,直接进行测序,获得408 bp保守区段。采用巢式PCR进行3’RACE扩增,在500 bp左右各有一条带;采用巢式PCR进行5’RACE扩增,在约1 kb处有条带。
根据RACE结果,利用两侧引物进行扩增后,获得一条长1 440 bp的DNA序列,包含一个由1 047个核苷酸组成的GGPS基因的完整开放阅读框,编码1条由348个氨基酸组成的蛋白质序列(图 2)。
 | 图 2 GGPS基因编码的氨基酸序列Fig.2 Amino acid sequence of GGPS gene |
ProtParam软件分析结果表明,GGPS蛋白的肽链由20种氨基酸组成,分子式为C1648H2665N449O502S18,理论相对分子质量为37 378,等电点(pI)为5.18,其中Ala(12.4%)和Leu(10.9%)量较高,Trp(0.3%)、Tyr(1.4%)和Gln(1.7%)量较低。Ala、Trp分别为43个(12.4%)和1个(0.3%)。带负电荷的氨基酸(Asp+Glu)共49个,带正电荷的氨基酸(Arg+Lys)有36个。不稳定指数43.91,表明属于不稳定蛋白质。总平均疏水指数为0.078。
保守结构域分析结果表明(图 3),GGPS蛋白序列中包含1个反式-类异戊烯基焦磷酸合成酶(trans-isoprenyl diphosphatesynthase)超家族的保守结构域。
 | 图 3 GGPS基因所编码氨基酸序列的保守结构域Fig.3 Deduced conserved domain of GGPS gene encoding amino acid sequence |
亚细胞定位分析结果表明,GGPS基因所编码氨基酸序列的N端包含1个由47个氨基酸构成的信号肽序列,可能定位于叶绿体或其他质体中。
序列比对结果表明,GGPS蛋白序列的N端保守性较低,中间部分和C端保守性高;133~149位和266~278位分别是2个多聚异戊二烯基合成酶的特异序列LIhDDlpcmDnddlRRG和IGllFQVvDD-IlD(图 4)。
 |
下划线部分表示多聚异戊二烯基合成酶的特异序列 Those highly conserved regions of all poly prenyl diphosphate synthasesare underlined 图 4 穿心莲GGPS基因编码氨基酸的序列比对Fig.4 Comparison on amino acid sequence encoded by GGPS of A. paniculata |
用最大似然法(Maximum likelihood)构建系统发育树,结果表明,穿心莲中的GGPS蛋白与已报道的长春花(Catharanthus roseus)的GGPS蛋白亲缘关系较近(图 5)。
 | 图 5 穿心莲与其他植物GGPS蛋白的系统进化树Fig.5 Phylogenetic tree of GGPS protein in A. paniculata and other plants |
实时荧光PCR检测结果表明(图 6、7),GGPS基因在穿心莲茎和叶片中的表达量有相似的趋势。花蕾期表达量较高,初花期降低;到了花果混合期表达量升高,青果期下降。表明花蕾期和花果混合期相关代谢成分的合成可能更活跃。单因素方差分析结果表明,无论是在茎还是在叶片中,GGPS基因在各发育阶段的表达量差异均不显著。
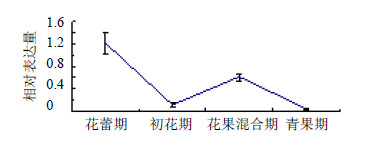 | 图 6 GGPS基因在穿心莲茎片中的表达Fig.6 GGPS gene expression levels in stems of A. paniculata |
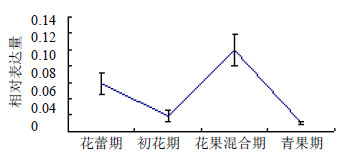 | 图 7 GGPS基因在穿心莲叶片中的表达Fig.7 GGPS gene expression levels in leaves of A.paniculata |
穿心莲内酯大量用作医药原料药。提高穿心莲中的穿心莲内酯的量能够节省成本,提高药效。研究表明,进行穿心莲的细胞培养时,在施加5 μmol/L茉莉酸甲酯(MeJA)的培养物中,GGPS等3个基因的表达量大幅度提高,穿心莲内酯的生物合成量也提高了5.25倍,表明这3个基因高度影响了穿心莲内酯的生物合成,是合成途径中的关键基因[7]。因此,本研究克隆的GGPS基因,对于今后采取基因工程手段生产穿心莲内酯,具有一定的利用价值。
人们已经从辣椒、番茄、西瓜、丹参、烟草和银杏等植物中,分离到了GGPS基因,它们在萜类合成途径中起重要的作用,能够催化合成GGPP[14]。有些植物的GGPS基因还具有双功能,例如,挪威云杉中的GGPS基因,它可以催化合成香叶基焦磷酸(geranyl dilphosphate,GPP)和GGPP2种产物[15]。
在动物体内,GGPP是合成大量生物活性分子的前体,GGPS基因参与了多种蛋白质翻译后的修饰过程,是癌症、神经退行性疾病和心脑血管疾病等疾病的潜在治疗靶点[16, 17]。进一步对植物GGPS基因的功能进行精细研究,发掘该基因在植物体内潜在的作用很有意义。
本研究从穿心莲中克隆了GGPS基因,长1047 bp,编码1条由348个氨基酸组成的蛋白质序列,与长春花的GGPS蛋白亲缘关系较近。它的N端包含1个由47个氨基酸构成的信号肽序列,可能定位于叶绿体等质体中。与叶片相比,GGPS基因在穿心莲的茎中表达更稳定。茎和叶片中,花蕾期表达量较高,初花期降低;到了花果混合期表达量升高,青果期下降。表明花蕾期和花果混合期相关代谢成分的合成可能更活跃。上述研究为进一步开展穿心莲内酯合成途径的调控奠定了基础。
志谢:样品采集工作由中国中医科学院中药资源中心道地药材国家重点实验室完成。
| [1] | 畅 娜, 王学民. “天然抗生素”穿心莲内酯 [J].自我药疗, 2014(10): 33-35. |
| [2] | 谢宗万. 常用中药名与别名手册 [M].北京: 人民卫生出版社, 2001. |
| [3] | 陈 蓉. 基于遗传与环境的穿心莲品质研究 [D].北京: 北京中医药大学, 2015. |
| [4] | 陈 蓉, 王晓云, 宋毓宁, 等. 基于SRAP和SNP分子标记的国内穿心莲遗传多样性分析 [J].中国中药杂志, 2014, 39(23): 12-18. |
| [5] | Sharma S S, Jha Z, Sinha R K. Establishment of in vitro adventitious root cultures and analysis of andrographolide in Andrographis paniculata [J].Nat Prod Commun, 2013, 8(8): 1045-1047. |
| [6] | Chao W W, Lin B F. Isolation and identification of bioactive compounds in Andrographis paniculata (Chuanxinlian) [J].Chin Med, 2010, 5(1): 17-31. |
| [7] | 陈 娟, 谷 巍, 段金廒, 等. 不同生长期穿心莲活性成分及关键酶基因差异表达研究 [J].中草药, 2014, 45(21): 3149-3152. |
| [8] | 靳 鑫, 时圣明, 张东方, 等. 穿心莲化学成分的研究[J].中草药, 2012, 43(1): 47-50. |
| [9] | Sharma S N, Jha Z, Sinha R K, et al. Jasmonate-induced biosynthesis of andrographolide in Andrographis paniculata [J].Physiol Plant, 2015, 153(2): 221-229. |
| [10] | 沈文飚, 汪 仁, 王益华, 等. 从水稻种胚中提取RNA的新方法 [J].遗传, 2003, 25(2): 208-210. |
| [11] | 张 蕾, 戴住波, 崔光红, 等. 丹参牻牛儿基牻牛儿基焦磷酸合酶基因的克隆与分析 [J].中国中药杂志, 2009, 34(21): 2704-2708. |
| [12] | Pinto F L, Lindblad P. A guide for in-house design of template-switch-based 5' rapid amplification of cDNA ends systems [J].Anal Biochem, 2010, 397(2): 227-232. |
| [13] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method [J].Methods, 2001, 25(4): 402-408. |
| [14] | 吕 品, 李 娜, 谷辉辉, 等. 西瓜牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及表达分析 [J].生物技术, 2014, 24(2): 11-15. |
| [15] | Schmidt A, Wächtler B, Temp U, et al. A bifunctional geranyl and geranylgeranyl diphosphate synthase is involved in terpene oleoresin formation in Picea abies [J].Plant Physiol, 2010, 152(2): 639-655. |
| [16] | Park J, Matralis A N, Berghuis A M, et al. Human isoprenoid synthase enzymes as therapeutic targets [J].Front Chem, 2014, 2: 50-56. |
| [17] | Wiemer A J, Wiemer D F, Hohl R J. Geranylgeranyl diphosphate synthase: an emerging therapeutic target [J].Clin Pharmacol Ther, 2011, 90(6): 804-812. |
 2015, Vol. 46
2015, Vol. 46


