2. 江苏省中医药研究院, 江苏 南京 210028;
3. 安徽中医药大学药学院, 安徽 合肥 230031
2. Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China;
3. Anhui University of Chinese Medicine College of Pharmaceutical Sciences, Hefei 230031, China
秋水仙碱为百合科植物丽江山慈菇Iphigenia indica Kunth et Benth. 的球茎中提取到的一种生物碱[1],是治疗急性痛风性关节炎的首选药物。由于秋水仙碱毒性较大,将其制备成透皮制剂,有利于发挥其局部治疗作用,同时可避免口服引起的胃肠道反应、骨髓毒性反应等严重副作用[2, 3, 4]。
醇质体(ethosomes)是一种新型的含有一定量小分子醇且具有囊泡结构的纳米给药载体,具有变形性强、包封率高、刺激性小等优点,用于经皮给药能显著提高透皮吸收速率和药物皮内滞留量,具有延缓药物释放的作用[5, 6, 7]。
聚乙二醇1000维生素E琥珀酸酯(TPGS)是由维生素E琥珀酸和聚乙二醇酯化而成,是一种具有较高安全性的非离子型表面活性剂,可显著提高纳米药物制剂的包封率[8, 9]。本实验通过均匀设计试验优化含TPGS秋水仙碱醇质体处方,并对含TPGS秋水仙碱醇质体、普通秋水仙碱醇质体及秋水仙碱30%乙醇溶液的体外经皮渗透性能进行比较,为秋水仙碱经皮给药制剂的研制提供实验依据[10, 11, 12]。
1 仪器与材料Waters高效液相色谱仪,Alliance2695四元泵及自动进样系统,2996二极管矩阵检测器,Empower色谱工作站;AT201型1/10万电子天平,瑞士梅特勒公司;Milli-Q型纯水器,美国Millipore公司;78-1型磁力加热搅拌器,江苏省金坛市荣华仪器制造有限公司;Zetasizer Nano-ZS 90型马尔文激光散射粒径测定仪,英国马尔文公司;JY92-2D超声波细胞粉碎仪,宁波新芝生物科技股份有限公司;YB-P6智能透皮试验仪,天津市鑫洲科技有限公司,有效扩散面积0.785 cm2,接收池体积10 mL;JEM-2100透射电镜,日本电子公司;Microfuge-16离心机,Beckman公司。
秋水仙碱原料药,批号20140320,质量分数≥98%,南京泽朗医药科技有限公司;秋水仙碱对照品,批号101176-201202,由中国食品药品检定研究院提供,质量分数>98%,供定量测定用。注射用大豆磷脂,上海太伟药业有限公司;葡聚糖凝胶(Sephadex G-50),北京瑞达恒辉科技发展有限公司;TPGS,Sigma公司。甲醇为色谱纯;水为超纯水;其余试剂均为分析纯。
实验动物为昆明种小鼠,雄性,体质量18~22 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2013-0015。
2 方法与结果 2.1 醇质体的制备采用注入超声法制备:称取秋水仙碱20 mg、大豆磷脂350 mg和TPGS 50 mg,加入7.3 mL无水乙醇,置于磁力搅拌器上,完全溶解后,在密闭条件下缓慢细流注入12.7 mL水,保持温度为30 ℃,待水注完后继续磁力搅拌10 min,然后冰水浴条件下探头式超声5 min(200 W,超声5 s,停5 s),将得到的样品冷藏、备用[13],即得含TPGS秋水仙碱醇质体。同法制备不含TPGS的普通秋水仙碱醇质体及不含秋水仙碱的空白含TPGS醇质体。
2.2 秋水仙碱的测定 2.2.1 色谱条件色谱柱为Alltima C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(60∶40);体积流量为1 mL/min;检测波长为254 nm;柱温35 ℃;进样量20 μL。
2.2.2 对照品溶液的制备精密称取秋水仙碱对照品适量,加甲醇超声溶解、定容,制成质量浓度为109.0 μg/mL的对照品储备液。
2.2.3 方法专属性分别取适量秋水仙碱对照品溶液、含TPGS秋水仙碱醇质体溶液和空白含TPGS醇质体溶液,加甲醇稀释,超声破乳,微孔滤膜滤过,取续滤液,按“2.2.1”项色谱条件进样测定。秋水仙碱色谱峰峰形良好,辅料及溶剂对药物测定无干扰(图 1)。
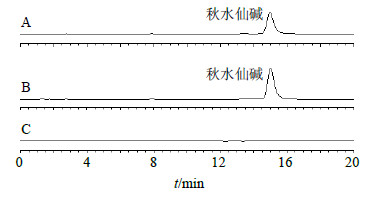 | 图 1 秋水仙碱对照品 (A)、含TPGS秋水仙碱醇质体 (B) 和空白含TPGS醇质体 (C) 的HPLC色谱图Fig.1 HPLC of colchicines (A), ethosomes containing TPGS (B), and blank ethosomes (C) |
精密吸取秋水仙碱对照品储备液,依次稀释成含秋水仙碱109、87.2、65.4、43.6、21.8、10.9 μg/mL的系列对照品溶液,分别取系列对照品溶液20 μL,注入液相色谱仪,测定峰面积。以进样量为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,求得回归方程为Y=1.59×106 X-1.08×105,r=0.999 8,结果表明,秋水仙碱进样量在0.218~2.180 μg与峰面积呈良好的线性关系。
2.2.5 精密度试验取秋水仙碱对照品溶液,连续重复进样6次,其RSD为0.36%,表明仪器精密度良好。
2.2.6 重复性试验取同一批次含TPGS秋水仙碱醇质体6份,加甲醇稀释,超声破乳,微孔滤膜滤过,取续滤液,按“2.2.1”项色谱条件进样检测。结果RSD为2.1%,表明该方法重复性良好。
2.2.7 稳定性试验取同一供试品溶液,分别于0、2、4、6、8、10 h进样检测。结果RSD为1.2%,表明供试品溶液在10 h内稳定性良好。
2.2.8 加样回收率试验制备空白含TPGS醇质体,分别加入不同量的秋水仙碱对照品溶液于量瓶中,用甲醇破乳、稀释定容,使秋水仙碱质量浓度分别为21.08(低)、52.70(中)、84.32(高)μg/mL,每个质量浓度各配制3份。进样检测,结果低、中、高质量浓度的秋水仙碱的平均回收率分别为99.7%、101.5%、100.8%,RSD分别为2.8%、2.2%、2.5%。
2.3 包封率的测定采用微柱离心法测定包封率。取含TPGS秋水仙碱醇质体混悬液0.5 mL,从Sephadex G-50微柱凝胶顶端加入,每次用0.5 mL水在3 000 r/min的条件下离心3 min,洗脱2次,收集带有乳光的洗脱液于25 mL量瓶,甲醇定容,微孔滤膜滤过,进样检测,计算包封药物量(W包)[14]。取含TPGS秋水仙碱醇质体混悬液0.5 mL,不经微柱离心,甲醇稀释相同倍数,微孔滤膜滤过,进样检测,计算醇质体中药物总量(W总),计算包封率(包封率=W包/W总)。
取与含TPGS秋水仙碱醇质体中秋水仙碱质量浓度相同的秋水仙碱溶液0.5 mL,按上述方法过Sephadex G-50微柱凝胶,收集滤液,甲醇定容至25 mL,微孔滤膜滤过,进样检测,峰面积为A后。取秋水仙碱溶液0.5 mL,不经微柱离心,甲醇稀释相同倍数,微孔滤膜滤过,进样检测,峰面积为A前,计算微柱凝胶对游离秋水仙碱的吸附率[(A前-A后)/ A前][15],结果为99.2%,表明微柱凝胶对游离秋水仙碱的吸附性能良好。
由表 1可知,含TPGS秋水仙碱醇质体、普通秋水仙碱醇质体的包封率平均值分别为74.71%、58.26%。含TPGS秋水仙碱醇质体与普通秋水仙碱醇质体比较,包封率显著增加(P<0.01)。
| 表 1 包封率、粒径、多分散指数及Zeta电位测定结果 Table 1Determination of EE, particle size, polydispersity index, and Zeta potential |
根据文献及预试验结果,选择对含TPGS秋水仙碱醇质体制备影响较显著的3个因素:大豆磷脂量用(A)、TPGS用量(B)、乙醇体积分数(C)作为考察对象。上述各因素取5水平,以包封率为考察指标,采用U5(53) 均匀设计表[16]进行试验,因素水平、试验方案及结果见表 2,方差分析结果见表 3。利用SPSS 16.0统计软件对上述均匀设计试验
| 表 2 均匀设计试验方案及结果 Table 2Test and results of uniform design |
| 表 3 方差分析表 Table 3Analysis of variance |
结果进行逐步回归分析,得回归方程为Y=−0.146+3.134 C-0.043 C2+0.378 B,r=1.000,F=6 466。
由表 3可知,回归方程经F检验,F=6 466>F0.01(3, 1)=5 403,故回归方程具有极显著意义,且复相关系数r=1.000,表明该回归方程对试验过程拟合情况良好,可以据其预测包封率。
由回归方程可知,影响提取包封率的各因素作用大小顺序为乙醇体积分数(C)>TPGS量(B)。其中大豆磷脂量(A)无显著影响作用。根据回归方程求出最佳参数为TPGS 50 mg、乙醇体积分数为36.44%。结合实际生产,拟确定最优处方为大豆磷脂350 mg、TPGS 50 mg、乙醇体积分数为36.44%,按回归方程计算,预测包封率为75.85%。按优化后处方制备3批含TPGS秋水仙碱醇质体,测定其包封率,分别为73.24%、76.61%、74.89%。由此可知,验证结果与回归方程预测结果基本接近,优选处方稳定可行,重复性好。
2.5 粒径与Zeta电位考察取适量含TPGS秋水仙碱醇质体采用激光散射粒径测定仪测定粒径和Zeta电位,结果见表 1和图 2。与普通醇质体相比,TPGS醇质体平均粒径显著减小(P<0.01),且更均匀。
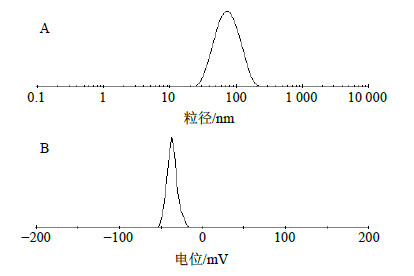 | 图 2 含TPGS秋水仙碱醇质体的粒径分布 (A) 和Zeta电位 (B) Fig.2 Size distribution (A) and Zeta potential (B) of colchicine ethosomes containing TPGS |
将醇质体滴于铜网上,滴加3%的磷钨酸溶液进行负染,自然晾干,透射电镜观察醇质体形态并拍照,结果见图 3。由图 3可知,TPGS醇质体外观呈球形或近球形囊泡,粒子大小较均一,粒径较普通醇质体稍小,与激光散射粒径测定仪测定的粒径结果基本一致。
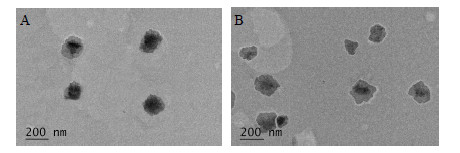 | 图 3 含TPGS秋水仙碱醇质体 (A) 和普通秋水仙碱醇质体 (B) 透射电镜照片Fig.3 Transmission electron micrographs of ethosomes containing TPGS (A) and ethosomes (B) |
小鼠脱颈处死,剃去腹部皮肤上的毛,剥离腹部皮肤,去除皮下脂肪和粘连物,保证皮肤完整性,生理盐水漂洗干净后备用。将皮肤置于Franz扩散装置上,角质层面向供给池,真皮层面向接收液,透皮扩散面积为0.785 cm2,接收液为10 mL生理盐水,使液面与皮肤内层紧密接触,恒温水浴37 ℃,500 r/min磁力搅拌。供给池分别注入0.2 mL含TPGS秋水仙碱醇质体、0.2 mL普通秋水仙碱醇质体和0.2 mL秋水仙碱30%乙醇溶液(秋水仙碱质量浓度均为1 mg/mL)。分别于1、2、3、4、6、8、12、18、24 h时间点取样1 mL,并立即补充等量空白接收液[17]。样品经微孔滤膜滤过后,进样检测,计算单位面积累积渗透药量(Qn,μg/cm2)。
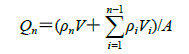
ρn为第n个取样点测得的秋水仙碱质量浓度(μg/mL),ρi为第i个取样点测得的秋水仙碱质量浓度(μg/mL),V为接收池体积(10 mL),Vi为取样体积(1 mL),A为透皮扩散面积(0.785 cm2)
以时间t为横坐标,Qn为纵坐标,绘制经皮渗透曲线,以秋水仙碱Qn对t进行线性回归,所得回归方程的斜率即为稳态透皮速率[Js,μg/(cm2∙h)]。
采用皮肤剪碎法测定皮内滞留量,于24 h取下皮肤,生理盐水洗去表面残留物,剪碎皮肤,10 mL甲醇浸润24 h,再超声提取3次,每次20 min,合并提取液,水浴蒸干,10 mL甲醇超声溶解20 min,微孔滤膜滤过,进样检测,计算单位面积皮内药物滞留量(Qs,μg/cm2)。以普通秋水仙碱醇质体、秋水仙碱30%乙醇溶液作为对照,研究含TPGS秋水仙碱醇质体的经皮渗透性质,结果见图 4和表 4。 含TPGS秋水仙碱醇质体可提高药物的Qn。秋水仙碱在不同载体中24 h的Qn由大到小的顺序依次为含TPGS秋水仙碱醇质体>普通秋水仙碱醇质体>秋水仙碱30%乙醇溶液。其中,含TPGS秋水仙碱醇质体的Qn为(91.36±7.11)μg/cm2,分别是普通秋水仙碱醇质体、秋水仙碱30%乙醇溶液的1.42、3.27倍,且差异具有统计学意义(P<0.01)。含TPGS秋水仙碱醇质体可提高药物的Js。由表 4可知含TPGS秋水仙碱醇质体的Js为(4.73±0.38)μg/(cm2∙h),分别是普通秋水仙碱醇质体、秋水仙碱30%乙醇溶液的1.67、3.43倍,且差异具有统计学意义(P<0.01)。由24 h的Qs的结果可知,含TPGS醇质体可明显提高Qs,其顺序为含TPGS秋水仙碱醇质体>普通秋水仙碱醇质体>秋水仙碱30%乙醇溶液。其中含TPGS秋水仙碱醇质体的Qs为(182.84±14.37)μg/cm2,分别是普通秋水仙碱醇质体、秋水仙碱30%乙醇溶液的1.43、1.74倍,且差异具有统计学意义(P<0.01)。
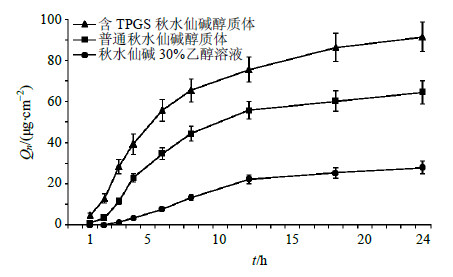 | 图 4 含TPGS秋水仙碱醇质体和对照制剂的经皮渗透曲线 (x±s, n = 3) Fig.4 Cumulative permeation curves of colchicine penetrating through mice skin from ethosomes containing TPGS and control groups (x±s, n = 3) |
| 表 4 TPGS醇质体和对照制剂的经皮渗透参数 Table 4Permeation parameters of colchicine ethosomes containing TPGS and control preparation |
TPGS作为一种新型非离子表面活性剂已被FDA批准为安全的药用辅料,研究发现,TPGS具有很多特性,如作为吸收促进剂、黏膜免疫佐剂及多药耐药逆转剂等,TPGS也可应用于前体药物、胶束、脂质体提高制剂的溶解度、渗透性及稳定性,从而实现缓、控释及靶向作用。
均匀设计是常用的试验设计方法,其实验点在实验范围内充分分散,可大大减少实验次数,具有方便、适用、预测性好等优点,非常适合用于处方筛选、药理药效筛选等研究中多因素、多水平试验。通过对TPGS醇质体处方优化的均匀设计结果可知,乙醇体积分数、TPGS量对包封率均有影响。适量的乙醇可以增加膜的流动性,促使包封率提高。但是,乙醇体积分数过高时包封率反而降低,可能是由于部分磷脂溶解于乙醇,导致囊泡膜变薄。
本研究曾采用透析法测定醇质体中药物包封率,但透析法耗时较长,所耗介质较多,实验效率极低,且长时间透析也易导致药物渗漏,故最终采用微柱离心法测定药物包封率。实验证明,微柱离心法能较迅速地分离醇质体和游离药物,且方法简单,易于操作,所得包封率较高,重现性良好。
本实验表明,秋水仙碱在TPGS醇质体中Qn、Js及Qs均明显高于普通醇质体,原因可能有以下2个方面:TPGS的存在使得所制备的醇质体粒径较小,而且均匀;药物包封率较高。
| [1] | 中国药典 [S]. 二部. 2010. |
| [2] | 杨效宇, 赵 佩, 李兰兰, 等. 两种秋水仙碱醇质体的制备及评价[J]. 中国药学杂志, 2010, 45(11): 844-848. |
| [3] | Slobodnick A, Shah B, Pillinger M H, et al. Colchicine: old and new[J]. Am J Med, 2015, 128(5): 461-470. |
| [4] | Shen L N, Zhang Y T, Wang Q, et al. Enhanced in vitro and in vivo skin deposition of apigenin delivered using ethosomes[J]. Int J Pharm, 2014, 460(1/2): 280-288. |
| [5] | 施晓琴, 赵继会, 王志东, 等. 醇质体在经皮给药方面的应用[J]. 中国实验方剂学杂志, 2013, 19(12): 352-355. |
| [6] | 陈 彦, 吴青青, 张振海. 熊果酸醇质体的制备和体外透皮研究[J]. 中国中药杂志, 2011, 36(8): 988-991. |
| [7] | Mbah C C, Builders P F, Attama A A. Nanovesicular carriers as alternative drug delivery systems: ethosomes in focus[J]. Expert Opin Drug Deliv, 2014, 11(1): 45-59. |
| [8] | 郑楠楠, 吴琳华, 唐景玲. 聚乙二醇维生素E琥珀酸酯在药剂学中的应用进展[J]. 中国药学杂志, 2014, 49(16): 1373-1376. |
| [9] | Guo Y, Luo J, Tan S, et al. The applications of vitamin E TPGS in drug delivery[J]. Eur J Pharm Sci, 2013, 49(2): 175-186. |
| [10] | 王文喜, 张 楠, 单伟光, 等. 聚乙二醇1000维生素E琥珀酸酯修饰多柔比星脂质体的制备和性质[J]. 中国药学杂志, 2011, 46(17): 1340-1344. |
| [11] | Zhu X, Li F, Peng X, et al. Formulation and evaluation of lidocaine base ethosomes for transdermal delivery[J]. Anesth Analg, 2013, 117(2): 352-357. |
| [12] | 夏晓静, 包汝泼, 黄 悦. 经去氧胆酸钠修饰的白桦脂酸醇质体的制备及其体外透皮效果研究[J]. 中草药, 2014, 45(10): 1407-1411. |
| [13] | 姜素芳, 胡姣艳, 何丽华. 盐酸青藤碱醇质体的制备及其体外经皮渗透研究[J]. 中草药, 2012, 43(9): 1738-1741. |
| [14] | 王素芳, 刘利萍, 边可君. 微柱凝胶离心-HPLC测定酮康唑醇质体包封率[J]. 中国现代应用药学, 2011, 28(6): 527-530. |
| [15] | 于燕燕, 赵继会, 冯年平, 等. 微柱离心-HPLC法测定鬼臼毒素醇质体的包封率研究[J]. 中草药, 2010, 41(10): 1634-1637. |
| [16] | 方开泰. 均匀设计与均匀设计表 [M]. 北京: 科学出版社, 1994. |
| [17] | 于燕燕, 赵继会, 冯年平, 等. 鬼臼毒素醇质体的体外经皮渗透特性研究[J]. 中草药, 2012, 43(1): 74-77. |
 2015, Vol. 46
2015, Vol. 46


