桉属Eucalyptus L'Héritier为桃金娘科(Myrtaceae)的一个主要属,桉属植物常统称为桉树,原产于澳洲,全属约有600种,1890年开始引入我国,我国引入近80种,广泛分布于广东、广西、贵州、四川、云南、江西等地。桉属植物生长迅速,材质优良,用途广泛,其木材、叶、花、果实等是化学工业、香料、医药领域的重要原料。
长期以来,桉属植物作为民间药被使用,主要用于治疗流行性感冒、痢疾、湿疹、跌打损伤等,国内外学者对桉属植物的化学成分及药理作用也有一定的研究。前期研究发现,桉属植物中的化学成分有间苯三酚衍生物(phloroglucinolderivatives,PDs)、黄酮、三萜、单萜、倍半萜、植物甾醇、氨基酸、微量元素等,其中的一些化学成分表现出良好的生物活性。PDs为桉属植物中最主要的一类化合物,因为其良好的抗菌、抗肿瘤等生物活性,国内外学者对其进行了较为深入的研究。
PDs为桉属植物中一类结构比较特殊的化合物,常与单萜、倍半萜及二萜结合形成杂合物,结构较为复杂、多变,根据其结构的变化特点,可以将已分离得到的PDs分为3类:简单的PDs,间苯三酚二聚物,间苯三酚与单萜、倍半萜或二萜的杂合物。间苯三酚与单萜、倍半萜或二萜形成的杂合物为桉属植物中一类特有的化合物,因参与形成杂合物的间苯三酚为甲酰基间苯三酚,这些杂合物也被称为甲酰基间苯三酚化合物(formylated phloroglucinol compounds,FPCs)。目前,国内外学者从蓝桉E. globules Labill.、圆叶桉E. pulverulenta Sims、自旋桉E. perriniana Rodway、大果桉E. macrocarpa Hook、巨桉E. grandis Hill ex Maiden、铁桉E. sideroxylon A. Cunn. ex Wools、厚桉E. incrassate Labill、布氏桉E. blakelyi Maiden、广叶桉E. amplifolia Naud. Descr.、柳叶桉E. saligna Smith、白色桉E. albens Benth、直干蓝桉E. maideni F. V. Muell.、大叶桉E. robusta Smith等桉属植物中分离得到96个间苯三酚衍生物。分离得到的PDs通常命名为euglobal、eucalyptal、macrocarpal和sideroxylonal等,由于这类化合物中的萜类残基部分通常存在多个手性中心,其绝对构型通常通过X单晶衍射的方法确定。
近年来,国内外学者对桉属植物进行了大量的研究,对PDs的研究进展有更进一步的认识,通过查阅相关的文献,本文对其研究概况进行综述。PDs在桉属植物中的分布情况见表 1。
| 表 1 桉属植物中PDs的分布 Table 1 Distribution of PDs in plants of Eucalyptus L'Héritier |
桉属植物中存在一系列的PDs,这些PDs的酚羟基均有不同程度的甲基化取代,并且其取代基上碳的个数及氧化程度存在差异。
这一类化合物的典型代表就是巨桉醇(grandinol,1)。其作为植物生长调节因子最早从巨桉中分离得到[1]。日本学者从圆叶桉的甲醇提取物的正己烷萃取层分离得到3个该类化合物,分别为巨桉醇、2,6-二羟基-4-甲氧基-3-甲基异苯丙酮(2)、2,6-二羟基-2′,3-二甲基-4-甲氧基丁酰苯(3),水芹种子萌芽抑制活性测试结果表明,巨桉醇的活性显著,其IC50值为1×10−5,而化合物2和3显示出较弱的活性[4]。随后,日本学者从自旋桉中也分离得到了巨桉醇,并对其进行了抑菌活性测试,发现其对枯草芽胞杆菌和金黄色葡萄球菌的抑制活性较强,其最小抑制浓度(MIC)分别为5 μg/mL和25 μg/mL[45]。1992年,Boland等[7]报道了从E. jensenii叶的挥发油中分离得到jensenone(4)。之后,国外学者对桉属植物的精油分析时发现了许多该类化合物,分别为apodophyllone(5)、4,6-diformyl- 2-isobutyrylphloro- glucinol(6)、isotorquatone(7)、torquatone(8)、4,6-diformyl-2-isopentanoylphloro glucinol(9)[9]、chartabomone(10)、isobaeckeol(11)、miniatone(12)、baeckeol methyl ether(13)、homoisobaeckeol(14)、homobaeckeol methyl ether(15)、conglomerone(16)、baeckeol(17)[8]、loxophlebene(18)[10]、4-O-demethyl miniatone(19)[6]。化合物1~19的结构见图 1。
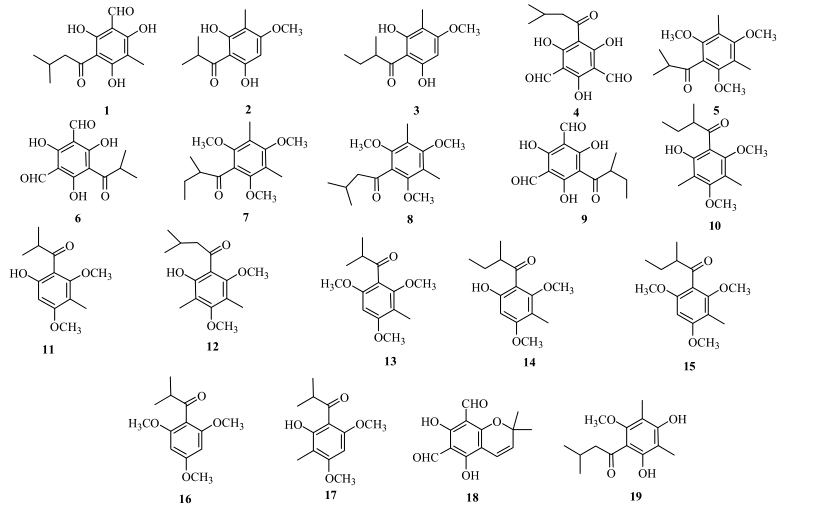 | 图 1 桉属植物中的简单PDs结构Fig.1 Stuctures of simple PDs from plants of Eucalyptus L'Héritier |
日本学者[46]对简单PDs的水芹种子萌芽抑制活性的构效关系进行了研究,PDs中的2个羰基能与相邻的酚羟基形成氢键,是活性的必需基团;侧链R1与R2上的原子空间排布影响活性,而R3的长度对活性的影响不明显(图 2)。之后,日本学者对简单PDs的抑制EB病毒活性的构效关系进行了研究,其构效关系与水芹种子萌芽抑制活性的构效关系一致[5]。
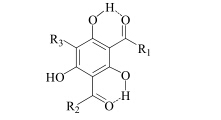 | 图 2 简单的PDs构效关系图Fig.2 Structure-activity relationship of simple PDs |
除了上述的化合物之外,还有学者从桉属植物中分离得到了该类化合物形成的糖苷类化合物,其中包括氧苷和碳苷。2010年,我国学者Tian等[11]从直干蓝桉的果实中分离到5个间苯三酚糖苷类化合物eucalmainoside A~E(20~24)。2012年,Tian等[12]又从直干蓝桉中分离得到1个碳苷类化合物8-β-C-glucopyranosyl-5,7-dihydroxy-2-isobutylchromone(25)。化合物20~25的结构见图 3。
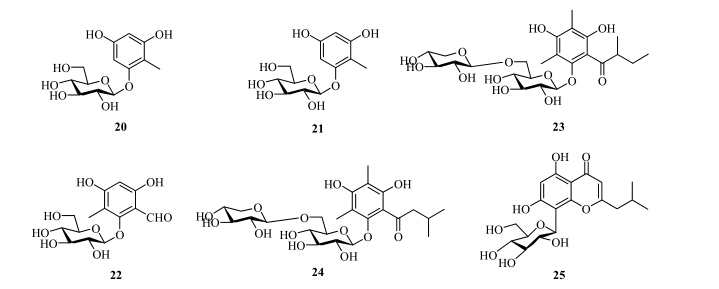 | 图 3 桉属植物中酰基间苯三酚糖苷类化合物结构Fig.3 Structures of acylphloroglucinol glycosides from plants of Eucalyptus L'Héritier |
目前从桉属植物中分离得到的间苯三酚二聚物可分为2类:一类是2个间苯三酚通过1个亚甲基相连,形成二聚物;一类是2个间苯三酚形成1个吡喃环,而2个间苯三酚连在吡喃环的两侧(图 4)。
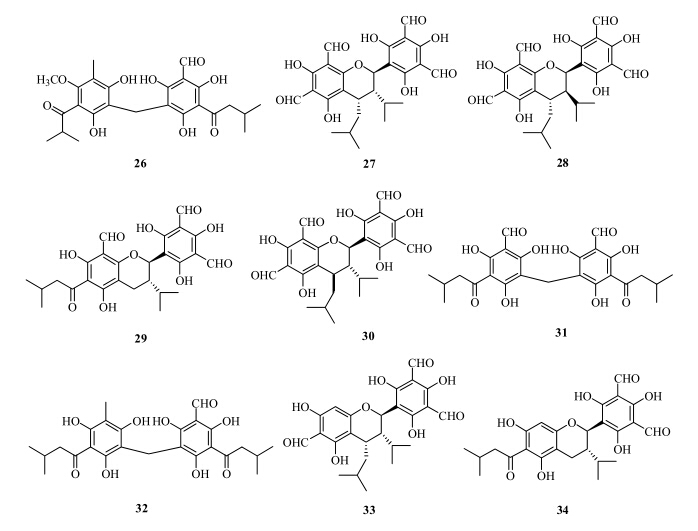 | 图 4 桉属植物中间苯三酚二聚物结构Fig.4 Structures of dimeric phloroglucinols from plants of Eucalyptus L'Héritier |
桉属植物中最早分离得到的间苯三酚二聚物是大叶桉酚甲(robustaol A,26),由我国学者秦国伟等[13]从大叶桉的叶中分离得到,并发现其对鼠疟原虫具有抑制作用。之后,日本学者从铁桉中分离得到sideroxylonal A(27)和B(28),研究表明,二者对革兰氏阳性菌金黄色葡萄球菌和枯草芽孢杆菌有较强的抑制活性(3.9、7.8 μg/mL),并且发现它们能够抑制HeLa细胞的增殖[14]。随后,日本学者从蓝桉树叶甲醇提取物中分离得到grandinal(29)[2]。
1999年,从白色桉的花中分离得到sideroxylonal C(30),并测试了sideroxylonal A~C(27、28、30)抑制I型纤溶酶原激活物抑制剂(plasminogen activator inhibitor type-1,PAI-1)的活性,它们的IC50值分别为3.3、5.3和4.7 μmol/L[15]。2003年,Mitaine- Offer等[16]从柳叶桉中分离得到由jensenone形成的二聚物,命名为dimer of jensenone(31)。2004年,Moore等[47]对桉属植物中的PDs进行研究,从E. strzeleckii中分离到jensenal(32)。2010年,Sidana等[17]从E. loxophleba叶中分离得到loxophlebal A(33),并对分离得到的该类化合物进行了抗菌活性实验。结果显示,loxophlebal A的抗菌活性明显比sideroxylonal A~C强,构效关系研究显示当C-3位没有醛基时,抗菌活性增强。2011年,Sidana等[10]从桉属植物E. loxophleba中分离得到loxophlebal B(34)。桉属植物分得间苯三酚二聚物的结构见图 4。
3 间苯三酚与单萜、倍半萜、二萜的杂合物间苯三酚与单萜、倍半萜、二萜形成的杂合物是桉属植物中特有的一类化合物。形成杂合物的间苯三酚多为甲酰基间苯三酚(formylated phloroglucinol,FP),因此,它们通常被称为甲酰基间苯三酚类化合物(FPCs)。FPCs结构多变,种类繁多,国内外学者通常将分离得到的这些FPCs命名为euglobal和macrocarpal。
3.1 FP与单萜形成的杂合物Kozuka等[18]在水芹种子萌芽抑制活性筛选中从蓝桉叶中首先发现此类化合物euglobal-IIc(35)。随后,国外学者在桉属植物巨桉、细叶桉、大叶桉中发现了一系列该类化合物,其中包括euglobal- G1~G3(36~38)[21]、euglobal T1(39)[20]、euglobal- G4~G12(40~48)[3, 22, 24]、euglobal R1(49)和R2(50)[23 ]。桉属植物中分离得到的FP与单萜形成的杂合物结构见图 5。
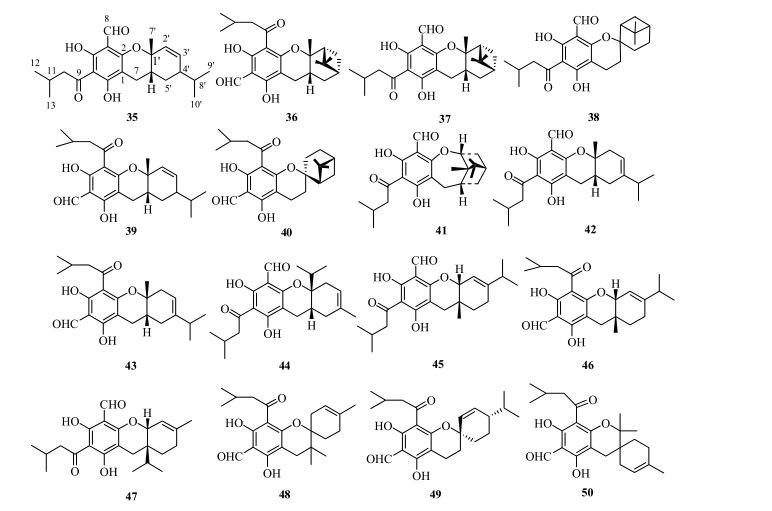 | 图 5 桉属植物中FP与单萜形成的杂合物结构Fig.5 Structures of FP-monoterpene adducts from plants of Eucalyptus L'Héritier |
1982年,Kozuka等[18]从蓝桉叶中分离得到一系列FP与倍半萜形成的杂合物euglobal-Ia1(51)、Ia2(52)、Ib(53)、Ic(54)、IIa(55)和IIb(56)。随后,从大叶桉的树叶中分离得到2个具有抗疟活性的该类化合物robustadial A(57)和B(58)[25, 27]。1994年,日本学者从布氏桉中分离得到1个该类化合物euglobal- Bl-1(59)[26]。同时,测定了化合物53、54、55、59的EB病毒早期抑制活性,结果表明,53和59的活性较强。2007年,Mohamed等[29]从蓝桉树皮中分离得到2个该类化合物eucalyptone G(60)和rhodomyrtone(61),并研究了它们的抗菌活性。2014年,Tian等[33]从直干蓝桉的叶中分离得到eucalmaidials A(62)和B(63),并测试了其抗真菌活性,结果表明,62抗光滑念珠菌Candida glabrata的IC50值为0.75 μg/mL。FP与倍半萜形成的杂合物结构见图 6。
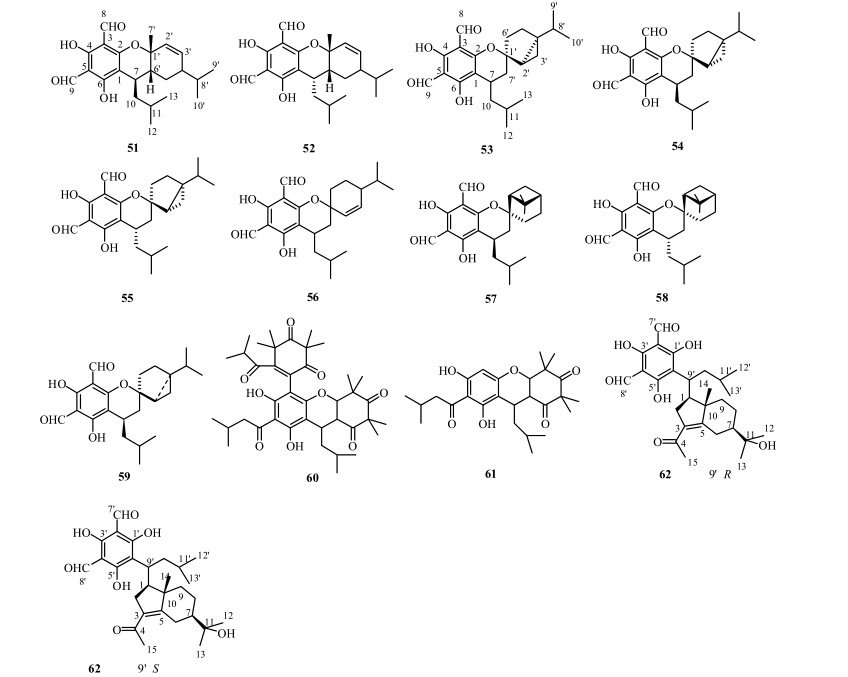 | 图 6 桉属植物中FP与倍半萜形成的杂合物结构Fig.6 Structures of FP-sesquiterpene adducts from plants of Eucalyptus L'Héritier |
FP与二萜形成的杂合物从结构上可分为2类:一类为euglobals,其主要特征是FP与二萜形成苯并吡喃结构(euglobal V除外),二萜残基剩余的碳连在吡喃环上;另一类通常为macrocarpal,其主要特征是FP与二萜不形成环,只是二萜残基部分的某个碳与苯环相连形成杂合物。它们的结构通式见图 7。
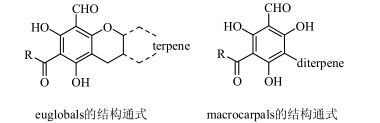 | 图 7 Euglobals和macrocarpals的结构通式Fig.7 General structures of euglobals and macrocarpals |
1980年,Sawada等[19]从蓝桉叶中分离得到euglobal-III(64)。随后,Kozuka等[30]从蓝桉叶中分离得到euglobal-IVb(65)、V(66)和VII(67)。国外学者从厚桉的树叶中分离得到euglobal-In-1(68),并对其进行了EB病毒早期抑制活性测试,结果显示,64对EB病毒具有显著的抑制活性[31]。1997年,Tadasaki等[32]从厚桉的树叶中分离得到euglobal-In-2(69)和euglobal-In-3(70)。日本学者从蓝桉中分离得到的12个euglobals,以及结构相近的26个化合物,并进行了抑制EB病毒活性测试,实验结果表明,64的活性较强[5]。2011年,Tetsuro等[28]从蓝桉叶中分离得到euglobal-IX(71),活性研究结果表明,其抑制细胞色素CYP3A4活性的IC50值为38.8 μmol/L。
2007年,Yin等[34]从蓝桉果实中分离得到eucalyptal A~C(72~74),并测定了它们对HL-60的细胞毒活性,其IC50分别为1.7、6.8和17 μmol/L。2012年,Wang等[35]从蓝桉果实中分离得到eucalyptal D(75)和E(76),并且对70、75、76进行了细胞毒活性测试,结果表明,所测试的化合物对KE-97、Jurkat、BGC-823和Huh-7显示出显著的细胞毒活性,其IC50值介于4.63~24.57 μmol/L。FP与二萜形成的此类化合物结构见图 8。
 | 图 8 桉属植物中的euglobals和eucalyptals结构Fig.8 Structures of euglobals and eucalyptals from plants of Eucalyptus L'Héritier |
 | 图 9 桉属植物中的macrocarpals结构Fig.9 Structures of macrocarpals from plants of Eucalyptus L'Héritier |
国内外学者对FP与二萜形成的杂合物的生物活性也进行了较为深入的研究。研究表明,macrocarpal A(75)对革兰阳性菌枯草芽孢杆菌PCI219和金黄色葡萄球菌FDA209P具有较为显著的抑制活性,其MIC小于0.2和0.4 μg/mL[36]。Yamakoshi等[40]对macrocarpal A~G进行了抗菌活性筛选,结果显示,macrocarpal类化合物对革兰阴性菌和真菌并未表现出活性,而对革兰阳性菌,如金黄色葡萄球菌、枯草芽孢杆菌、藤黄微球菌、包皮垢分支杆菌表现出活性,MIC值在0.78~3.13 μg/mL。Nishizawa等[49]测试了化合物77~81的HIV逆转录酶抑制活性,研究表明,它们对HIV逆转录酶抑制活性都比较强,其IC50值分别为10、5.3、8.4、12、8.1 μmol/L。1996年,Osawa 等[38]对77~81、84~86及95进行了抗菌活性测试,结果显示,测试的化合物对致龋细菌(质量浓度<100 μg/mL)和牙周病原菌(质量浓度<25 μg/mL)具有较强的抑制活性;并且研究 发现,此类化合物对革兰阳性菌具有抑制活性,对革兰阴性菌也具有抑制活性。通过构效关系分析发现,与FP结合的二萜部分是此类化合物抗菌活性关键部位;二萜部分连有2个羟基时,抗菌活性减弱。
4 结语目前对桉属植物进行化学成分研究的仅有20多种,对桉属植物的研究远远不够,还存在广阔的空间。同时,桉属植物的生物活性具有潜在的研究前景,如抗菌、抗肿瘤、抗病毒、抗HIV等生物活性还有待于进一步研究。PDs为桉属植物中量比较大的一类化合物,由于其结构上的特异性及其生物活性显著,一直受到药物化学家的关注,但由于其结构上的复杂多变,存在多个手性中心,这又导致对其研究受到阻碍,随着ECD光谱的发展及X射线单晶衍射技术的运用,这方面存在的问题也会逐步得到解决。
| [1] | Crow W D, Osawa T, Paton D M, et al. Structure of grandinol: a novel root inhibitor from Eucalyptus grandis [J]. Tetrahedron Lett, 1977, 18(12): 1073-1074. |
| [2] | Singh I P, Hayakawa R, Etoh H, et al. Grandinal, a new phloroglucinol dimer from Eucalyptus grandis [J]. Biosci Biotechnol Biochem, 1997, 61(5): 921-923. |
| [3] | Umehara K, Singh I P, Etoh H, et al. Five phloroglucinol-monoterpene adducts from Eucalyptus grandis [J]. Phytochemistry, 1998, 49(6): 1699-1704. |
| [4] | Bolte M L, Bowers J, Crow W D, et al. Germination inhibitor from Eucalyptus pulverulenta [J]. Agric Biol Chem, 1984, 48(2): 373-376. |
| [5] | Takasaki M, Konoshima T, Fujitani K, et al. Inhibitors of skin-tumor promotion. VIII: Inhibitory effects of euglobals and their related compounds on epstein-barr virus activation (1) [J]. Chem Pharm Bull, 1990, 38(10): 2737-2739. |
| [6] | Sidana J, Foley W J, Singh I P. Isolation and quantitation of ecologically important phloroglucinols and other compounds from Eucalyptus jensenii [J]. Phytochem Anal, 2012, 23(5): 483-491. |
| [7] | Boland D J, Brophy J J, Fookest C J R. Jensenone, a ketone from Eucalyptus jensenii [J]. Phytochemistry, 1992, 31(6): 2178-2179. |
| [8] | Ireland B F, Goldsack R J, Brophy J J, et al. The leaf essential oils of Eucalyptus miniata and its allies [J]. J Essent Oil Res, 2004, 16(2): 89-94. |
| [9] | Menut C, Bessiere J M, Samate A D, et al. Apodophyllone and isotorquatone, two arenic ketones from Eucalyptus apodophylla [J]. Phytochemistry, 1999, 51(8): 975-978. |
| [10] | Sidana J, Singh S, Arora S K, et al. Formylated phloroglucinols from Eucalyptus loxophleba foliage [J]. Fitoterapia, 2011, 82(7): 1118-1122. |
| [11] | Tian L W, Zhang Y J, Qu C, et al. Phloroglucinol glycosides from the fresh fruits of Eucalyptus maideni [J]. J Nat Prod, 2010, 73(2): 160-163. |
| [12] | Tian L W, Xu M, Li Y, et al. Phenolic compounds from the branches of Eucalyptus maideni [J]. Chem Biodivers, 2012, 9(1): 123-130. |
| [13] | 秦国伟, 陈政雄, 王洪诚, 等. 大叶桉酚甲的结构和合成 [J]. 化学学报, 1981, 39(1): 83-89. |
| [14] | Satoh H, Etoh H, Watanabe N, et al. Structures of sideroxylonals from Eucalyptus sideroxylon [J]. Chem Lett, 1992, 21(10): 1917-1920. |
| [15] | Neve J, Leone P A, Carroll A R, et al. Sideroxylonal C, a new inhibitor of human plasminogen activator inhibitor type-1, from the flowers of Eucalyptus albens [J]. J Nat Prod, 1999, 62(2): 324-326. |
| [16] | Mitaine-Offer A C, Djoukeng J D, Tapondjou L A, et al. Constituents of the leaves of Eucalyptus saligna [J]. Syst Ecol, 2003, 31(12): 1457-1460. |
| [17] | Sidana J, Rohilla R K, Roy N, et al. Antibacterial sideroxylonals and loxophlebal A from Eucalyptus loxophleba foliage [J]. Fitoterapia, 2010, 81(7): 878-883. |
| [18] | Kozuka M, Sawada T, Kasahara F, et al. The Granulation-inhibiting principles from Eucalyptus globulus Labill. II. The structures of euglobal-Ia1, -Ia2, -Ib, -Ic, -IIa, -IIb and-IIc [J]. Chem Pharm Bull, 1982, 30(6): 1952-1963. |
| [19] | Sawada T, Kozuka M, Komiya T, et al. Euglobal-III, a novel granulation inhibiting agent from Eucalyptus globulus Labill [J]. Chem Pharm Bull, 1980, 28(8): 2546-2548. |
| [20] | Kokumai M, Konoshima T, Kozuka M, et al. Euglobal T1, a new euglobal from eucalyptus tereticornis [J]. J Nat Prod, 1991, 54(4): 1082-1086. |
| [21] | Takasaki M, Konoshima T, Shingu T, et al. Structures of euglobal-G1, -G2, and-G3 from Eucalyptus grandis, three new inhibitors of epstein-barr virus activation [J]. Chem Pharm Bull, 1990, 38(5): 1444-1446. |
| [22] | Takasaki M, Konoshima T, Kozuka M, et al. Structures of euglobals-G1, -G2, -G3, -G4, and-G5 from Eucalyptus grandis [J]. Chem Pharm Bull, 1994, 42(12): 2591-2597. |
| [23] | Jian Y Q, Wang Y, Huang X J, et al. Two new euglobals from the leaves of Eucalyptus robusta [J]. J Asian Nat Prod Res, 2012, 14(9): 831-837. |
| [24] | Singh I P, Umehara K O, Asai T, et al. Phloroglucinol-monoterpene adducts from Eucalyptus grandis [J]. Phytochemistry, 1998, 47(6): 1157-1159. |
| [25] | 秦国伟, 徐任生. 大叶桉化学成分的研究——大叶桉酚乙和其他成分的分离和鉴定 [J]. 化学学报, 1986, 44(2): 151-156. |
| [26] | Takasaki M. Konoshima T, Kozuka M, et al. Four euglobals from Eucalyptus blakelyi [J]. Chem Pharm Bull, 1994, 42(10): 2177-2179. |
| [27] | Xu R S, Snyder J K, Nakanishi K. Robustadials A and B from Eucalyptus robusta [J]. J Am Chem Soc, 1984, 106(3): 734-736. |
| [28] | Tetsuro K, Tatsuya H, Yuka N, et al. Phloroglucinols from the leaves of Eucalyptus globulus [J]. Heterocycles, 2011, 83(3): 631-636. |
| [29] | Mohamed G A, Ibrahim S R M. Eucalyptone G, a new phloroglucinol derivative and other constituents from Eucalyptus globulus Labill. [J]. Arkivoc Archive Organic Chem, 2007, 2007(4): 281-291. |
| [30] | Kozuka M, Sawada T, Mizuta E, et al. The granulation-inhibiting principles from Eucalyptus globulus Labill. III. The structures of euglobal-III, -IVb and-VII [J]. Chem Pharm Bull, 1982, 30(6): 1964-1973. |
| [31] | Tadasaki M, Konoshima T, Kozuka M, et al. Euglobal-In-1, a new euglobal from Eucalyptus incrassate [J]. Chem Pharm Bull, 1994, 42(10): 2113-2116. |
| [32] | Tadasaki M, Konoshima T, Kozuka M, et al. Euglobal-In-2 and-In-3, new euglobals from Eucalyptus incrassate [J]. Nat Med (Tokyo), 1997, 51(5): 486-490. |
| [33] | Tian L W, Xu M, Li X C, et al. Eucalmaidials A and B, phloroglucinol-coupled sesquiterpenoids from the juvenile leaves of Eucalyptus maideni [J]. RSC Adv, 2014, 41: 21373-21378. |
| [34] | Yin S, Xue J J, Fan C Q, et al. Eucalyptals A-C with a new skeleton isolated from Eucalyptus globulus [J]. Org Lett, 2007, 26: 5549-5552. |
| [35] | Wang J, Zhai W. Z, Zou Y, et al. Eucalyptals D and E, new cytotoxic phloroglucinols from the fruits of Eucalyptus globulus and assignment of absolute configuration [J]. Tetrahedron Lett, 2012, 53(21): 2654-2658. |
| [36] | Murata M, Yamakoshi Y, Homma S, et al. Macrocarpal A, a novel antibacterial compound from Eucalyptus macrocarpa [J]. Agriic Biol Chem, 1990, 54(12): 3221-3226. |
| [37] | Singh I P, Etoh H. New macrocarpal-am-1 from Eucalyptus amplifolia [J]. Biosci Biotech Bioch, 1995, 59(12): 2330-2332. |
| [38] | Osawa K, Yasuda H, Morita H, et al. Macrocarpals H, I, and J from the leaves of Eucalyptus globulus [J]. J Nat Prod, 1996, 59(9): 823-827. |
| [39] | Yang S P, Zhang X W, Ai J, et al. Potent HGF/c-Met axis inhibitors from Eucalyptus globulus: the coupling of phloroglucinol and sesquiterpenoid is essential for the activity [J]. J Med Chem, 2012, 55(18): 8183-8187. |
| [40] | Yamakoshi Y, Murata M, Shimizu A, et al. Isolation and characterization of macrocarpals B-G antibacterial compounds from Eucalyptus macrocarpa [J]. Biosci Biotech Bioch, 1992, 56(1): 1570-1576. |
| [41] | Singh I P, Umehara K, Etoh H. Macrocarpals in Eucalyptus SPP. As attachment-inhibitors against the blue mussel [J]. Nat Prod Lett, 1999, 14(1): 11-15. |
| [42] | Shibuya Y, Kusuoku H, Murphy G. K, et al. Isolation and structure determination of new macrocarpals from a herbal medicine, Eucalyptus globulus leaf [J]. Nat Med, 2001, 55(1): 28-31. |
| [43] | Chenavas S, Fiorini-Puybaret C, Joulia P, et al. New formylated phloroglucinol compounds from Eucalyptus globulus foliage [J]. Phytochem Lett, 2015, 11: 69-73. |
| [44] | Osawa K, Yasuda H, Morita H, et al. Eucalyptone from Eucalyptus globulus [J]. Phytochemistry, 1995, 40(1): 183-184. |
| [45] | Nakayama R, Murata M, Homma S, et al. Antibacterial compounds from Eucalyptus perriniana [J]. Agric Biol Chem, 1990, 54(1): 231-232. |
| [46] | Bolte M L, Crow W D, Takahashi N, et al. Structure/activity relationships of grandinol: a germination inhibitor in Eucalyptus [J]. Agr Biol Chem, 1985, 49(3): 761-768. |
| [47] | Moore B D, Wallis I R, Palá-Paúl J, et al. Antiherbivore chemistry of Eucalyptus and deterrents for marsupial folivores [J]. J Chem Ecol, 2004, 30(9): 1743-1769. |
| [48] | Terada Y, Saito J, Kawai T, et al. Structure-activity relationship of phloroglucinol compounds from Eucalyptus as marine antifoulants [J]. Biosci Biotechnol Biochem, 1999, 63(2): 276-280. |
| [49] | Nishizawa M, Emura M, Kan Y, et al. Macrocarpals: HIV-RTase inhibitors of Eucalyptus globulus [J]. Tetrahedron Lett, 1992, 33(21): 2983-2986. |
 2015, Vol. 46
2015, Vol. 46


