2. 宁波市第一医院 内分泌科, 浙江 宁波 315010
2. Department of Endocrinology, Ningbo First Hospital, Ningbo 315010, China
白头翁Pulsatilla chinensis (Bge.) Regel属于毛茛科(Ranunculuceae)银莲花Anemone L. 属多年生草本药用植物。在中国大多数省份如四川、安徽、江苏、湖北、河南、甘肃等均有分布[1]。白头翁具有抗阴道毛滴虫、抗氧化、抗炎、杀虫、抗肿瘤等功效[2],具有很高的药用价值[3]。实验研究发现其提取物也表现出多种药理活性,如白头翁正丁醇提取物对小鼠肝脏的保护作用[4]及白头翁水溶液的抗炎[5]、抗心律失常活性[6]等。但白头翁的抗糖尿病研究还未见报道,本实验研究白头翁水提物(aqueous extract from Pulsatilla chinensis,AEPC)的降血糖活性及其可能作用机制。
1 材料 1.1 药材、药品与试剂白头翁(根部)药材购自北京同仁堂药店,经浙江大学生命科学院傅承新教授鉴定为白头翁Pulsatilla chinensis (Bge.) Regel;链脲佐菌素(STZ,批号79C-0027)、格列本脲(批号024K0701)、尿素、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、总蛋白检测试剂盒均购自Sigma公司;胰岛素检测试剂盒(Crystal Chem公司)。大小鼠繁殖饲料(北京华阜康生物科技有限公司);聚山梨酯80(上海索莱宝生物科技有限公司);葡萄糖溶液(天津新郑股份有限公司)。
1.2 仪器罗氏GC型血糖检测仪(ROCHE公司);分光光度计(上海美析仪器有限公司);酶标仪(上海永创医疗器械有限公司)。
1.3 实验动物Wistar大鼠,11~12周龄,动物合格证号SCXK (京)-2009-0004,购自北京华阜康生物科技有限公司。新生大鼠为雌雄大鼠性成熟后,配种生育所得。大鼠均在统一的环境中喂养,喂以大鼠繁殖饲料,饲养间配以12 h光照/12 h黑暗循环,温度控制为23~25 ℃,湿度为45%~55%。所有动物实验操作步骤均在国家动物实验标准(GB/T 27416-2014)的指导下完成。
1.4 细胞RIN 5F细胞购自美国菌种保藏中心(ATCC)。由含10%胎牛血清的RPIM 1640培养基培养,内含100 U/mL青霉素、100 μg/mL链霉素。培养条件为37 ℃、5% CO2、95%湿度。
2 方法 2.1 AEPC的制备取白头翁药材500 g,每次加入2 L的双蒸水,在烧杯中浸泡30 min后,反复煎煮3次,每次20 min。收集煎煮所得药液,浓缩得水提物浸膏,用含1%聚山梨酯-80的水溶解成生药浓度为1 g/mL的AEPC储备液(经HPLC检测,主要含有白头翁皂苷、白头翁素、小檗碱、药根碱、巴马汀、秦皮甲素和秦皮乙素,质量分数均在1%以上),4 ℃保存备用。
2.2 口服葡萄糖耐量试验(OGTT)OGTT参照文献方法[7]中的实验步骤进行。取30只雄性Wistar大鼠(11~12周龄),空腹24 h,随机分成5组,对照组,阳性药组,AEPC低、中、高剂量组,每组6只。对照组ig 1% 聚山梨酯-80的水溶液1 mL;AEPC低、中、高剂量组分别ig 10、20、40 mg/kg AEPC;阳性药组ig 0.5 mg/kg格列本脲。给药30 min后,所有大鼠均ig 60% 葡萄糖溶液(3 g/kg)。分别在给糖前1 min及给糖后30、90、150 min尾静脉采血1次,立即通过血糖检测仪检测血糖水平。
2.3 对2型糖尿病大鼠模型的作用 2.3.1 新生大鼠2型糖尿病模型的制备具体操作参考文献方法[8, 9, 10],5日龄的新生Wistar大鼠按体质量ip 80 mg/kg的STZ(溶于0.1 mol/L的柠檬酸缓冲液,pH值为4.5)后放回母鼠身边继续饲养。10周后,空腹12 h尾静脉取血,血糖检测仪检测血糖值。
2.3.2 分组给药、血糖检测及样本采集模型制备后,选取体质量为175~185 g,空腹血糖值在12.7~13.4 mmol/L的雄性大鼠18只,随机分为3组,模型组、AEPC(20 mg/kg)组、阳性药(格列本脲,0.5 mg/kg)组,每组6只,选取6只正常大鼠作为对照组。对照组、模型组每天ig 1 mL 1% 聚山梨酯-80的水溶液,AEPC组、阳性药组均为ig给药,连续给药20 d。于第1天给药前5 min、第5、10、15、20天给药后1 h,尾静脉采集空腹12 h血样,检测血糖值。在第20天测量体质量以后,大鼠通过CO2麻醉,眼球取血,收集血样进行血清生化指标分析,收集肝组织,称量肝质量,进行肝糖原分析,最后大鼠麻醉处死。血样盛于离心管中,静置37 ℃环境中促其凝固,待血液凝固后,3 000 r/min离心10 min,分离血清。
2.3.3 肝糖原及血清生化指标检测肝糖原水平通过Caroll等[11]描述的方法分析,血清丙氨酸转氨酶(ALT)以及天冬氨酸转氨酶(AST)通过Reitman等[12]的方法检测,碱性磷酸酶(ALP)通过Kind等[13]描述的方法检测,尿素、TG、TC、HDL-C、总蛋白及胰岛素水平均采用试剂盒方法进行检测。
2.4 对体外RIN 5F细胞胰岛素释放的影响RIN 5F细胞的胰岛素释放量检测参考Gray等[14]的方法。RIN 5F细胞铺板到24孔板上,待细胞密度达到1×106/孔开始实验。细胞用KRB缓冲液(pH 7.4,含115 mmol/L NaCl、4.7 mmol/L KCl、1.28 mmol/L CaCl2、1.2 mmol/L KH2PO4、1.2 mmol/L MgSO4、24 mmol/L NaHCO3、10 mmol/L HEPES、1 g/L BSA、1.1 mmol/L葡萄糖)洗2次后,在37 ℃孵育40 min后,分别加入AEPC使其终质量浓度为0、5、10、20、40 μg/mL,加入格列本脲使其终质量浓度为0、5、10、15、20 μg/mL,继续孵育20 min。收集上清,保存于−20 ℃。通过试剂盒方法检测胰岛素水平。
2.5 数据分析实验数据用x±s表示,采用SPSS 19.0软件进行组间方差分析,组间均数比较采用t检验。
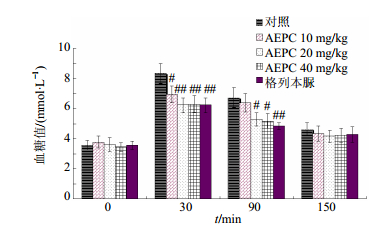
3 结果 3.1 OGTT结果10、20、40 mg/kg AEPC均表现出了降糖效果。10 mg/kg AEPC在ig葡萄糖30 min后观测到了轻微的降血糖效果。20、40 mg/kg AEPC在30、90 min后均表现出了明显的降血糖效果。但40 mg/kg AEPC相对于20 mg/kg的降血糖效果并没有明显增加,不存在明显剂量依赖关系。在后续的实验中选取20 mg/kg剂量继续考察。结果见图 1。
|
与对照组比较:#P<0.05 ##P<0.01, 下同 #P < 0.05 ##P < 0.01 vs control group, same as below 图 1 OGTT检测结果(x±s,n=6) Fig.1 Detection results of OGTT(x±s,n=6) |
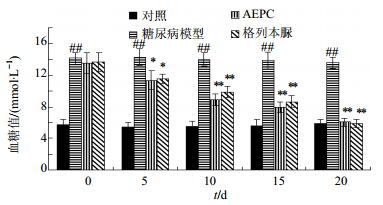
AEPC 20 mg/kg给药后,观察到了明显的降血糖效果。给药5 d后AEPC组以及阳性药组均观察到了血糖降低,给药10 d和15 d后进一步观察到了血糖的降低。20 d后,给药组的血糖值已经与对照组无明显差别。AEPC与格列本脲表现出了类似的降血糖效果。结果见图 2。
|
与模型组比较:*P<0.05 **P<0.01, 下同 *P < 0.05 **P < 0.01 vs model group, same as below 图 2 AEPC对糖尿病大鼠血糖的影响(x±s,n=6) Fig.2 Effect of AEPC on blood glucose of diabetic rats(x±s,n=6) |
与对照组比较,模型组大鼠体质量、肝脏质量、以及肝糖原水平均明显下降。AEPC和阳性药组上述指标与对照组比较均无明显改变,结果见表 1。与对照组比较,模型组AST、ALT、ALP、尿素、TG、TC水平上升,HDL-C、总蛋白及血清胰岛素水平下降,AEPC组和阳性药组的上述指标与对照组比较无明显差异。结果见表 2和表 3。
|
|
表 1 各组大鼠的体质量、肝脏质量和肝糖原水平 Table 1 Body weight, liver weight, and liver glycogen values of rats in each group |
|
|
表 2 各组大鼠的血清生化指标 Table 2 Serum biochemical parameters of rats in each group |
|
|
表 3 各组大鼠血清尿素和脂质水平 Table 3 Serum urea and lipid levels of rats in each group |
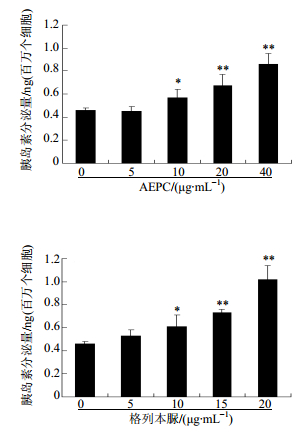
10、20、40 μg/mL的AEPC呈剂量依赖性地显著增加了RIN 5F细胞的胰岛素释放。而低剂量5 μg/mL对RIN 5F细胞的胰岛素释放无明显影响。同时,阳性药格列本脲也剂量依赖性地促进了RIN 5F细胞的胰岛素释放。说明与格列本脲类似,AEPC能促进RIN 5F细胞的胰岛素释放。结果见图 4。
|
图 4 细胞胰岛素释放检测结果(x±s, n = 6) Fig.4 Insulin release from RIN 5F cells in vitro(x±s, n = 6) |
OGTT结果显示20 mg/kg的AEPC显示了很好的降血糖效果,而高剂量(40 mg/kg)组的降血糖效果与20 mg/kg组比较没有明显增加。所以后续的实验采用20 mg/kg给药。本实验建立了非肥胖的新生儿大鼠2型糖尿病模型,该模型适用于口服降糖药的药效验证。就代谢特征而言,该模型与人2型糖尿病几乎相同,是目前最合适也是最广泛使用的2型糖尿病动物模型[8, 10, 15]。在糖尿病大鼠上,20 mg/kg的AEPC和0.5 mg/kg格列本脲连续给药20 d以后,大鼠的血糖值已经与正常大鼠无明显差异,说明了AEPC对2型糖尿病大鼠具有良好的降血糖效果。此外,AEPC处理后的大鼠的肝脏质量以及肝糖原水平也与正常大鼠无明显差异,该效果有可能是AEPC对脂解作、肝糖分解以及蛋白质水解的调控所引起的。AEPC处理后使模型大鼠AST、ALT、ALP、尿素、TG、TC、HDL-C、总蛋白等代谢指标均恢复了正常,说明AEPC处理后使大鼠的肝功能等恢复了正常。
相对于模型组,AEPC处理组大鼠的血清胰岛素水平明显上升,恢复到了与正常大鼠相当的水平。提示AEPC有可能促进胰岛素分泌。所以,体外考察了AEPC对RIN 5F细胞胰岛素分泌的影响,结果显示AEPC明显地促进了RIN 5F细胞的胰岛素释放。结合AEPC对动物模型的降血糖效果,推测AEPC的降血糖作用可能是通过促进胰岛β细胞分泌胰岛素而实现的。本研究首次报道了AEPC在2型糖尿病模型上的降血糖效果,为白头翁的药理活性研究提供了新的实验证据,但其具体的机制还有待进一步研究。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1980. |
| [2] | 蔡 鹰, 陆 瑜, 梁秉文, 等. 白头翁体内抗肿瘤作用的实验研究 [J]. 中草药, 1999, 30(12): 929-931. |
| [3] | 关树光, 於文博, 徐东铭, 等. 白头翁药理作用的研究近况 [J]. 吉林中医药, 2006, 26(3): 60-61. |
| [4] | 黄 展, 李春丰, 王 晶, 等. 白头翁正丁醇提取物对小鼠肝损伤保护研究 [J]. 黑龙江医药科学, 2014, 2(2): 57-58. |
| [5] | 胡屹屹, 穆 祥, 胡元亮. 白头翁汤及其主要成分对内皮细胞分泌细胞因TNF-α, TXB-2和6-KETO-PGF1α的影响 [J]. 吉林农业大学学报, 2014, 3(3): 342-346. |
| [6] | 马 科, 罗国平, 宋紫霞, 等. 白头翁水煎液对离体蛙心功能的影响及其机制研究 [J]. 西部中医药, 2014, 27(4): 8-10. |
| [7] | Ajikumaran N S, Sabulal B R, Arun K R, et al. Promising antidiabetes mellitus activity in rats of β-amyrin palmitate isolated from Hemidesmus indicus roots [J]. Eur J Pharmacol, 2014, 734(1): 77-82. |
| [8] | Olivier B, Daniele B, Portha B, et al. Relation of insulin deficiency to impaired insulin action in NIDDM adult rats given streptozocin as neonates [J]. Diabetes, 1989, 38(5): 610-617. |
| [9] | Verspohl E J. Recommended testing in diabetes research [J]. Planta Med, 2002, 68(7): 581-591. |
| [10] | Arulmozhi D K, Veeranjaneyulu A, Bodhankar S L. Neonatal streptozotocin induced rat model of Type-2 diabetes mellitus: A glance [J]. Indian J Pharmacol, 2004, 36(4): 217-221. |
| [11] | Caroll N V, Longly W, Joseph H R. Determination of glycogen in liver and muscle by use of anthrone reagent [J]. J Biol Chem, 1956, 220(2): 583-593. |
| [12] | Reitman S, Frankel S. A colorimetric method for the determination of serum glutamate oxalo-acetate and glutamate pyruvate transaminase [J]. Am J Clin Pathol, 1957, 28(1): 56-63. |
| [13] | Kind P R, King E J. Estimation of plasma phosphatases by determination of hydrolysed phenol with antipyrine [J]. J Clin Pathol, 1954, 70(4): 322-330. |
| [14] | Gray A M, Flatt P R. Insulin-secreting activity of the traditional antidiabetic plant Viscum album [J]. J Endocrinol, 1999, 160(3): 409-414. |
| [15] | Reed M J, Meszaros K, Entes L J, et al. A new rat model of type 2 diabetes, the fat-fed, streptozotocin treated rat [J]. Metabolism, 2000, 49(11): 1390-1394. |
 2015, Vol. 46
2015, Vol. 46


