2. 江西中医药大学, 江西 南昌 330004;
3. 解放军第三〇二医院 全军中医药研究所, 北京 100039
2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China;
3. China Military Institute of Chinese Materia Medica & Integrative Medical Center, 302 Military Hospital, Beijing 100039, China
慢性溃疡性结肠炎(chronic ulcerative colitis,UC)是一种病因和发病机制不明确的结直肠慢性炎症疾病。该疾病通常会反复发作,伴随持续腹痛、腹泻、黏液脓血便以及体质量消耗性减轻等临床症状,严重影响患者的日常生活;此外,UC会导致炎症细胞浸润,肠壁溃疡性损伤乃至异常增生,最终发展为结直肠癌[1]。目前临床常用糖皮质激素、柳氮磺胺吡啶等药物治疗UC,然而,上述药物很难有效抑制溃疡性肠炎的恶化,同时对肝功能、精神系统等产生严重的副作用[2, 3, 4]。因此迫切需要寻找疗效确切、毒副作用小、可长期服用的治疗药物。
白花蛇舌草Hedyotis Diffusae Herba为茜草科植物白花蛇舌草Hedyotis diffusa Willd. 的干燥全草,始载于《广西中药志》,可清热解毒、消肿止痛,主治恶性肿瘤、胃肠炎等病症。目前临床常用于慢性炎症诱发的肿瘤,如肝癌、肠腺癌等的治疗[5, 6],现代研究认为,白花蛇舌草对结肠癌移植瘤有明显的抑制作用[7, 8, 9]。但白花蛇舌草是否可以有效控制UC及其诱发的肠癌,目前未见报道。因此,本研究以葡聚糖硫酸钠(DSS)诱发的UC小鼠为研究模型,观察白花蛇舌草对小鼠体质量、腹泻和便血的影响,分析小鼠肠组织病理损伤和炎症细胞浸润程度,检测白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等炎症因子的表达变化,核抗原Ki67阳性率的变化,评价白花蛇舌草抑制DSS诱导的UC的效果,为UC的治疗以及肠炎相关肿瘤的预防提供新的治疗药物和方法。
1 材料 1.1 药品和试剂白花蛇舌草(北京绿野药业有限公司,批号1307401),经解放军第三〇二医院全军中药研究所肖小河研究员鉴定为茜草科植物白花蛇舌草Hedyotis diffusa Willd.的干燥全草。DSS(相对分子质量36000~50000,MP Biomedicals公司,批号M8667);生理盐水(石家庄四药有限公司);IL-6和TNF-α ELISA试剂盒(USCN);Ki67抗体(谷歌生物科技有限公司);二抗HRP标记山羊抗兔(KPL);RNA保存液(RNA store reagent,TIAN GEN);RNA提取试剂盒(QIAGEN);逆转录和PCR反应试剂盒(Thermo);IL-6和TNF-α引物(Invitrogen);便潜血检测试纸(北京蓝十字生物技术有限公司)。
1.2 仪器高效液相色谱(Waters ACQUITY);7500型荧光定量PCR仪(AppliedBiosystems);Leica2016石蜡切片机(上海莱卡仪器有限公司);爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司)。
1.3 动物SPF级雌性C57BL/6小鼠60只,约8周龄,体质量18~22g,购自军事医学科学院,动物合格证号SCXK(军)2012-0004,饲养于解放军第三〇二医院动物实验中心。
2 方法 2.1 白花蛇舌草乙醇提取物的制备白花蛇舌草乙醇提取物(ethanolextract of HedyotisDiffusae Herba, EEHDH)的制备方法参照卫生部颁药品标准(标准编号WS3-B-3176-98)中白花蛇舌草注射液的制备方法。白花蛇舌草原药材100g,加20倍量80%乙醇,常温浸泡5 h,85℃加热回流提取2次,每次2h,滤过,合并滤液,减压浓缩,冷冻干燥,得到EEHDH冻干粉598.3mg,4℃保存,实验时用蒸馏水溶解、稀释。
依据《中国药典》2010年版和参照李存满等[10]方法,对EEHDH中黄酮类成分进行检测,EEHDH冻干粉中含芦丁1.2514%。
2.2 分组、给药方法及UC模型的制备取SPF级雌性C57BL/6小鼠60只,适应性喂养1周后,随机分为5组:对照组,模型组,EEHDH低、中、高剂量(生药量2.5、10.0、20.0 g/kg)组,每组12只。模型建立第1天,除对照组外,所有小鼠给予含有2%DSS的饮用水,自由饮用6 d后换正常饮用水,恢复14 d;第21天时,重复DSS饮水6 d,恢复14 d;第3次DSS饮水6 d后,恢复4 d,整个实验过程共计50 d[11, 12]。建立模型的同时,EEHDH组每天定时ig0.2 mLEEHDH,模型组和对照组ig相应体积的蒸馏水。
2.3 样本采集及处理实验的第50天,摘眼球取血,4 ℃保存备用。脱颈处死小鼠,采用十字法剖开腹腔,小心剥离结肠(小肠末端至直肠末端),观察结肠黏膜的损伤程度,并精确测量其长度(盲肠至直肠末端);用生理盐水清除肠内废物,沿结肠纵轴剖开,结肠两端各剪取0.5 cm,放入冻存管中,加1 mL RNA保存液;剩余部分采用Swiss-roll的方式翻卷[13, 14],10%福尔马林固定保存,备用。
2.4 体质量的变化及评价每天定时称小鼠体质量,计算其体质量变化率。

肉眼观察小鼠粪便性状改变情况,便潜血试纸法检测便血情况,并按照标准[12]进行评分。粪便性状评分:0分,正常;1分,粪便成型略软;2分,粪便非常软;3分,腹泻;4分,痢疾样便。便血程度评分:0分,便潜血阴性;1分,便潜血阳性;2分,便中有可见血;3分,可见直肠出血。以小鼠粪便性状评分和便血程度评分之和的平均值为临床症状评分。
2.6 结肠组织HE染色10%福尔马林固定保存的结肠组织,常规石蜡切片,HE染色,光学显微镜下观察小鼠结肠的形态学变化,参照Wirtz等[12]方法对结肠损伤程度进行半定量评分。
2.7 血清和组织中炎症因子的检测保存于EP管中的新鲜全血,3500r/min离心10min,吸取上清,ELISA试剂盒法检测血清中炎症因子IL-6和TNF-α的水平;RNA保存液中的结肠组织匀浆,提取RNA,逆转录合成cDNA,以GAPDH为内参进行扩增,检测结肠组织中IL-6和TNF-α mRNA的表达量。IL-6和TNF-α引物序列见表 1。实验操作按试剂盒说明书进行。
| 表 1 实时荧光定量PCR引物序列 Table 1 Primersequences of real time qPCR |
10%福尔马林固定保存的结肠组织,常规石蜡切片,免疫组化Ki67染色,采用Image pro-plus 6.0软件分析染色结果:每组内每张切片随机挑选3个200倍视野进行拍照,对每张照片进行分析,得出每张照片阳性的累积吸光度值。累积吸光度值越大,则Ki67阳性表达率越高。
2.9 统计学处理实验数据以x± s 表示,采用SPSS13.0统计软件分析数据,计量资料采用单因素方差分析(ANOVA)。
3 结果 3.1 对UC小鼠体质量的影响3次DSS刺激期(0~6、20~26、40~46 d),小鼠体质量总体呈不同程度下降趋势,第2次和第3次造模期间,模型组相对于各给药组小鼠体质量下降更为显著。DSS恢复期(7~20、27~40、47~50 d),EEHDH给药组小鼠体质量恢复优于模型组,最终各给药组小鼠体质量增加值均大于模型组。结果见图 1。
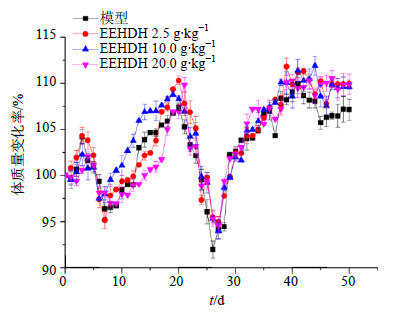 |
图 1 各组小鼠体质量变化情况( |
在UC模型中,由于结肠黏膜损伤导致黏膜充血水肿、糜烂,肠壁增厚并形成溃疡,结肠缩短。与对照组比较,模型组小鼠的结肠明显缩短(P<0.05);与模型组比较,EEHDH中、高剂量组能够显著增加结肠长度(P<0.05)。结果见表 2。
| 表 2 EEHDH对UC小鼠结肠长度的影响 Table 2 Effect of EEHDH on colon length of UC mice |
正常小鼠经过3个DSS循环后才能形成慢性UC,重点观察第3次DSS刺激后小鼠粪便性状改变,随着DSS刺激次数的增加,临床症状评分逐渐增大。不同的DSS刺激阶段,表现有所不同。第1次DSS刺激期和恢复期,所有小鼠的便形没有明显变化,便血程度较轻,临床症状评分没有显著性差
异;第2次DSS刺激后,模型组小鼠出现严重便血症状,粪便也变稀、变软,EEHDH治疗组,尤其是EEHDH 20.0 g/kg组,小鼠临床症状与模型组有显著差异;第3次DSS刺激,小鼠的粪便很快就开始变稀变软,便血由阴性转为阳性,随着DSS刺激时间的延长,发展成为腹泻或痢疾样便。对评分结果进行统计学分析,第43、44天EEHDH各给药组临床症状评分显著低于模型组(P<0.05);第45、46天,EEHDH20.0g/kg组临床症状评分显著低于模型组(P<0.01);肠炎恢复期,EEHDH10.0、20.0g/kg组临床症状评分下降显著(P<0.05),EEHDH2.5g/kg组粪便形状和便血程度有所改善,但与模型组比较,差异不显著。结果见图 2。
3.4 对UC小鼠肠组织病理改变的影响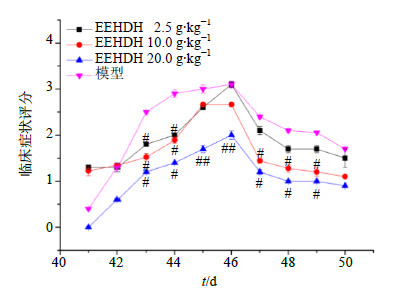 |
图 2 EEHDH对UC小鼠临床症状评分的影响( |
与对照组比较,模型组小鼠结肠黏膜损伤严重、炎症细胞浸润和异常增生显著。EEHDH给药组小鼠结肠黏膜损伤、炎症细胞浸润和异常增生均显著改善,而且给药剂量越高,改善越明显,结果见图 3。
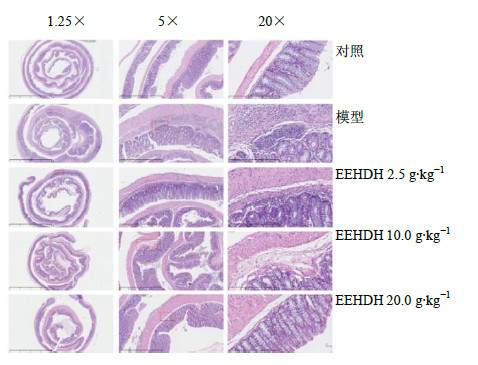 | 图 3 HE染色评价小鼠结肠组织病理损伤情况Fig.3 Evaluation on pathological damage of colon tissue in mice by HE staining |
按病理组织学诊断指标对染色结果进行评分,与对照组比较,模型组结肠组织病理评分明显升高(P<0.05),提示DSS对结肠造成严重损伤,形成了UC;EEHDH10.0、20.0 g/kg组结肠组织病理评分结果显著低于模型组(P<0.01),提示EEHDH能够显著改善DSS导致的黏膜损伤、炎症细胞浸润等。结果见表 3。
3.5 对UC小鼠血清和结肠组织中炎症因子的影响| 表 3 EEHDH对UC小鼠结肠组织病理评分的影响 Table 3 Effect of EEHDH on pathological scores ofcolon tissue ofUC mice |
ELISA法测定小鼠外周血中IL-6和TNF-α水平,模型组血清中IL-6和TNF-α的水平显著高于对照组(P<0.01);与模型组比较,EEHDH 10.0、20.0 g/kg组IL-6的水平显著降低(P<0.05、0.01),EEHDH2.5、10.0、20.0 g/kg组TNF-α水平显著降低(P<0.05、0.01)。
RT-PCR法对损伤肠组织中促炎性因子IL-6和TNF-α表达变化进行分析。结果表明,结肠组织中IL-6、TNF-α mRNA表达变化与血清中蛋白水平变化趋势基本一致:模型组IL-6、TNF-α mRNA的表达量显著高于对照组(P<0.05),EEHDH 10.0、20.0 g/kg组显著低于模型组(P<0.05、0.01)。结果见表 4。
| 表 4 EEHDH对UC小鼠血清和结肠组织中炎症因子表达的影响 Table 4 Effect of EEHDH on inflammatory factors in serum or colon tissue of UC mice |
对小鼠结肠组织进行免疫组化Ki67染色,Ki67的阳性率越高,说明处于增殖周期的细胞越多,上皮细胞的异常增殖程度越严重。模型组Ki67染色明显强于对照组和给药组。对染色结果进行统计学分析,对照组和模型组Ki67阳性率分别为(20.65±1.02)%、(49.17±4.45)%,模型组显著高于对照组(P<0.01);与模型组比较,EEHDH给药组Ki67阳性表达率随剂量增大而降低(P<0.05、0.01)。结果提示,EEHDH可以降低小鼠慢性溃疡性肠组织上皮细胞中Ki67的表达,抑制肠组织上皮细胞增殖,阻止异常增生。结果见图 4。
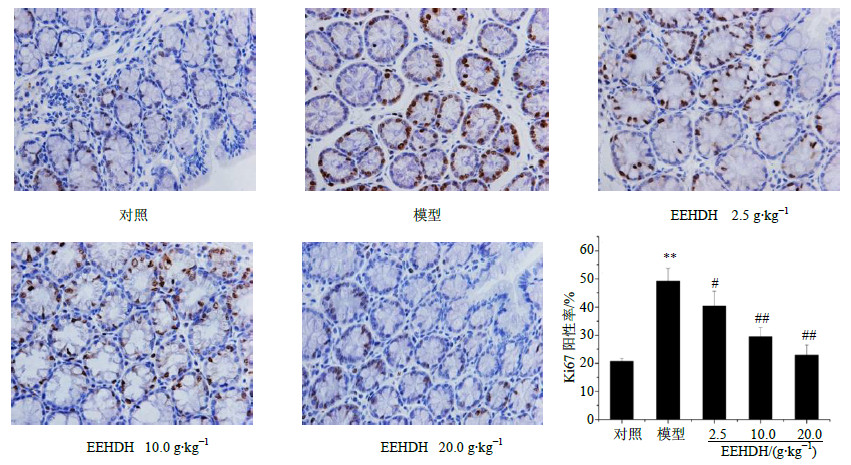 | 图 4 EEHDH抑制肠组织的异常增生Fig.4 Inhibition of EEHDH on intestinal tissuedysplasia |
UC发病可能与免疫失调密切相关,当炎性肠病反复发作时,免疫功能持续紊乱,NF-κB、JAK/STAT等信号通路异常活化,TNF-α、IL-6等促炎因子过表达,促进炎症并诱导上皮细胞增殖,抑制细胞凋亡,发生异常增生,甚至发展为结直肠癌[15]。
近年来大量研究报道表明,白花蛇舌草的主要活性成分是蒽醌类、环烯醚萜类和黄酮类[16],如豆甾醇、乌索酸、齐墩果酸等都具有广泛的抗炎活性[17, 18, 19],Lin等[20]已证实白花蛇舌草提取物可抑制结肠癌细胞增殖,诱导细胞凋亡;Kim等[21]发现白花蛇舌草对DSS诱导的急性肠炎效果显著,但治疗UC的研究还不成熟,因此本研究以DSS诱导的UC模型,探究EEHDH在抑制UC及损伤组织异常增生过程中的作用。
DSS诱导的UC模型与人类的UC的病理改变接近,往往出现体质量下降、血便和肠道黏膜损伤等症状[11],其中体质量下降是结肠炎严重程度的一个重要指标。UC最常见的临床表现是粪便性状的改变和便血的出现,便血的严重程度是评价黏膜屏障功能损伤程度的重要指标之一。故本研究主要考察白花蛇舌草对UC小鼠体质量、粪便性状及便血情况、血清组织中炎症因子、结肠组织病理改变等指标的影响。结果表明EEHDH能够改善肠炎导致的体质量下降、腹泻便血等症状,提高肠炎小鼠的生活质量;同时EEHDH能够抑制炎症导致的结肠缩短、炎症细胞浸润、黏膜损伤甚至溃疡形成,显著抑制血清及结肠组织中IL-6、TNF-α的表达,抑制肠组织的病理损伤;免疫组化结果表明,给药组小鼠结肠组织上皮细胞的Ki67阳性率降低,推测EEHDH通过抑制上皮细胞的增殖,从而抑制炎症诱发的异常增生,预防UC的癌变。
综上所述,EEHDH可能是通过降低促炎因子的表达,进而治疗UC、抑制肠组织异常增生。但是,EEHDH是否通过阻断NF-κB、STAT3等信号通路活化抑制IL-6、TNF-α的表达,发挥治疗UC、抑制异常增生的作用,尚需进一步实验证明。随着研究的不断深入,EEHDH治疗慢性肠炎以及预防肠炎癌变在临床应用方面将具有广阔的前景。
| [1] | Eaden J A, Abrams K R, Mayberry J F. The risk of colorectal cancer in ulcerative colitis: A meta-analysis [J]. Gut, 2001, 48(4): 526-535. |
| [2] | Ishiguro K, Ando T, Maeda O, et al. Paeonol attenuates TNBS-induced colitis by inhibiting NF-κB and STAT1 transactivation toxicol [J]. Appl Pharmacol, 2006, 217(1): 35-42. |
| [3] | Domenech E. Inflammatory bowel disease: current therapeutic options [J]. Digestion, 2006, 73(suppl 1): 67-76. |
| [4] | Sandborn W J, Targan S R. Biologic therapy of inflammatory bowel disease [J]. Gastroenterology, 2002, 122(6): 1592-1608. |
| [5] | 黄时浩. 白花蛇舌草治疗慢性非特异性溃疡性结肠炎 [J]. 中医杂志, 2007, 48(6): 535-535. |
| [6] | 黄信群. 重用白花蛇舌草治疗肠炎 [J]. 中医杂志, 2007, 48(8): 722-723. |
| [7] | 单保恩, 张金艳, 杜肖娜, 等. 白花蛇舌草的免疫学调节活性和抗肿瘤活性 [J]. 中国中西医结合杂志, 2001, 21(5): 370-374. |
| [8] | 曾永长, 梁少瑜, 罗佳波, 等. 白花蛇舌草提取物(HDNF)体内外抗肿瘤实验研究 [J]. 中药材, 2011, 34(4): 594-597. |
| [9] | 彭 军, 林久茂, 魏丽慧, 等. 白花蛇舌草提取物对结肠癌HT-29细胞bcl-2和bax表达的影响 [J]. 福建中医药大学学报, 2010, 20(5): 23-26. |
| [10] | 李存满, 薛兴亚,章飞芳,等.白花蛇舌草超高效液相色谱特征图谱研究II—强极性组分特征图谱研究[J]. 药物分析杂志, 2010, 30(2): 259-262. |
| [11] | Tanaka T, Kohno H, Suzuki R, et al. A novel inflamma-tion-related mouse colon carcinogenesis model induced byazoxymethane and dextran sodium sulfate [J]. Cancer Sci, 2003, 94(11): 965-973. |
| [12] | Wirtz S, Neufert C, Weigmann B, et al. Chemically induced mouse models of intestinal inflammation [J]. Nat Protocols, 2007, 2(3): 541-546. |
| [13] | 王少鑫. CUEDC2在结肠炎相关肿瘤中作用机制的研究 [D]. 北京: 中国人民解放军军事医学科学院, 2013. |
| [14] | 全国大肠癌病理协作组. 全国大肠癌病理研究统一规范 [J]. 浙江肿瘤通讯, 1982(1): 136-147. |
| [15] | Naugler W E, Karin M. NF-kappa B and cancer-identifying targets and mechanisms [J]. Curr Opin Genet Dev, 2008, 18(1): 19-26. |
| [16] | 李 芳, 杨培民, 曹广尚. 白花蛇舌草黄酮类成分大鼠在体肠吸收研究 [J]. 中草药, 2015, 46(2): 240-244. |
| [17] | Dharmappa K K, Kumar R V, Nataraju A, et al. Anti-inflammatory activity of oleanolic acid by inhibition of secretory phospholipase A2 [J]. Planta Med, 2009, 75(3): 211-215. |
| [18] | Gabay O, Sanchez C, Salvat C, et al. Berenbaum. Stigmasterol: a phytosterol with potential anti-osteoarth-ritic properties [J]. Osteoarthritis Cartilage, 2010, 18(1): 106-116. |
| [19] | Huang Y, Nikolic D, Pendland S, et al. Effects of cran-berry extracts and ursolic acid derivatives on P-fimbriated Escherichia coli, COX-2 activity, pro-inflammatory cytokine release and the NF-kappabeta transcriptional response in vitro [J]. Pharm Biol, 2009, 47(1): 18-25. |
| [20] | Lin J M, Li Q Y, Chen H W, et al. Hedyotis diffusa Willd. extract suppresses proliferation and induces apoptosis via IL-6-inducible STAT3 pathway inactivation in human colorectal cancer cells [J]. Oncol Lett, 2015, 9(4): 1962-1970. |
| [21] | Kim S J, Kim Y G, Kim D S, et al. Oldenlandia diffusa ameliorates dextran sulphate sodium-induced colitis through inhibition of NF-kappa B activation [J]. Am J Chin Med, 2015, 39(5): 957-969. |
 2015, Vol. 46
2015, Vol. 46


