2. 上海交通大学医学院附属仁济医院 药学部, 上海 200127
2. Department of Pharmacy, Ren Ji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China
软珊瑚为腔肠动物门(Coelenterata)珊瑚虫纲(Anthozoa)八放珊瑚亚纲(Octocorallia)软珊瑚目(Alcyonacea)的海洋无脊椎动物,是热带和亚热带常见的海洋生物。中国珊瑚礁资源丰富,主要分布于南海和东海海域,其中软珊瑚和柳珊瑚种类繁多,为珊瑚的药用研究提供了丰富的资源基础。珊瑚的药用在《本草纲目》中已有详细记载,主要有清热解毒、软坚散结、活血祛瘀、安神镇惊等功效[1]。
由于海洋生物的多样性,软珊瑚作为无物理防御功能的海洋生物,必然会产生化学或生理防御物质,所以其代谢产物逐步成为海洋天然产物研究的热点。据文献报道,软珊瑚所含化学成分丰富,主要包括萜类、甾体类、神经酰胺和生物碱类等,其中二萜类化合物种类和量丰富,这些化合物通常具有细胞毒[2]、抗病毒[3]、毒鱼[4]、钙拮抗[5]及抗污[6]等活性,具有重要的药用研究价值。国内外研究报道的软珊瑚主要为肉芝软珊瑚Sarcophyton、短指软珊瑚Sinularia和豆荚软珊瑚Lobophytum 3大属。本实验研究对象为其中一种豆荚软珊瑚Lobophytum sp.,二萜类化合物是该属软珊瑚中数目最多的一类次生代谢产物。
为了进一步丰富软珊瑚的二萜类化学成分,本课题组在前期研究基础上[7],对采自中国西沙群岛海域中的一种豆荚软珊瑚Lobophytum sp. 进行了进一步的系统化学成分研究,从其95%乙醇提取物中分离得到6个二萜类化合物,分别鉴定为豆荚内酯B(chilobolide B,1)、(1S*,3SS*,4SS*,7E,11E)-3,4-epoxy- 13-oxo-7,11,15-cembratriene(2)、(2E,4E,7R,8S,12Z)- 1-isopropyl-cyclotetradeca-4,8-dimethyl-7-hydroxy-1, 3,11-triene-8,12-carbolactone(3)、(2E,4E,8S,12Z)-1- isopropyl-4,8-dimethyl-7-oxocyclotetradeca-l,3,11-triene-8,12-carbolactone(4)、sarcrassin D(5)、laevigatol B(6)。结构见图 1。其中,化合物1为新化合物,化合物2~4为首次从该属软珊瑚中分离得到。
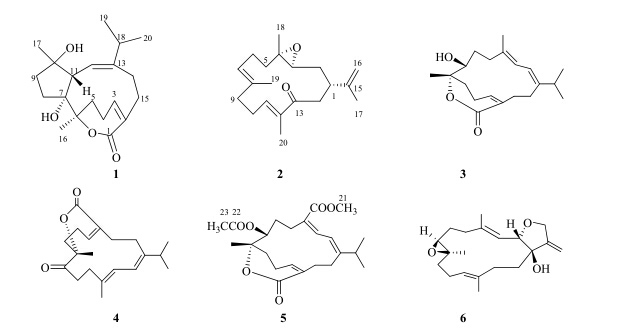 | 图 1 化合物1~6的结构Fig.1 Structures of compounds 1—6 |
Perkin-Elmer 341型旋光仪(美国Perkin-Elmer公司);Bio-Rad FTS-185傅里叶变换红外光谱仪(美国伯乐Bio-Rad公司);Waters 1525/2998高效液相色谱仪(美国Waters公司),半制备色谱柱为YMC C18(250 mm×10 mm,5 μm);Q-Tof micro YA019型液质联用仪(美国Waters公司);Bruker AV-600核磁共振仪(德国Bruker公司);Sephadex LH-20由Amersham Pharmacia Biotech生产;柱色谱硅胶与硅胶板为烟台江友硅胶开发有限公司产品;柱色谱ODS为北京金欧亚科技发展有限公司产品;正己烷、醋酸乙酯、二氯甲烷、正丁醇和甲醇等分析纯有机溶剂购自上海化学试剂公司;色谱级甲醇和乙腈为Promptar公司产品。
实验样品于2010年4月采自我国西沙群岛海域,经中国科学院南海海洋研究所黄辉研究员鉴定为豆荚软珊瑚Lobophytum sp.,样品标本(编号X-17)保存在中国人民解放军第二军医大学附属长征医院海洋药物研究室。
2 提取和分离冷冻干燥的豆荚软珊瑚1 kg,切碎成小块,室温下每次用95%乙醇3 L回流提取2 h,重复3次,合并提取液减压浓缩得总浸膏约68 g。将总浸膏混悬分散于水中,依次用正己烷(1 L×3)、二氯甲烷(1 L×3)及正丁醇(1 L×3)分别萃取3次,分别得浸膏19、8和4 g。二氯甲烷萃取物经反相硅胶ODS柱色谱,甲醇-水(20∶80→100∶0)梯度洗脱,得到8个流分(Fr. 1~8),Fr. 4经硅胶柱色谱,正己烷-醋酸乙酯(10∶1→1∶1)梯度洗脱,得到6个流分(Fr. 4a~4f),Fr. 4c经半制备高效液相色谱分离纯化(乙腈-水70∶30),得到化合物1(2.5 mg,tR=14.3 min)、2(2.3 mg,tR=17.5 min)和3(3.1 mg,tR=23.5 min);Fr. 4d经半制备高效液相色谱分离纯化(乙腈-水65∶35),得到化合物4(2.6 mg,tR=10.1 min)和5(4.2 mg,tR=18.5 min);Fr. 4e经半制备高效液相色谱分离纯化(乙腈-水60∶40),得到化合物6(6.4 mg,tR=17.6 min)。
3 结构鉴定化合物1:无色油状物,[α]D25 +75° (c 0.25, CH2Cl2);IR光谱给出α,β-不饱和羰基(1 668 cm−1)与羟基(3 233 cm−1)特征吸收峰。HR-ESI-MS给出准分子离子峰m/z: 357.204 4 [M+Na]+(计算值357.204 2,C20H30O4Na),结合NMR数据,确定其分子式为C20H30O4,不饱和度为6。
1H-NMR (600 MHz, CDCl3) 谱(表 1)低场区给出2个烯质子信号δH 6.33 (1H,dd, J = 6.0, 9.0 Hz, H-3) 和5.53 (1H, d, J = 11.1 Hz, H-12),2个次甲基质子信号δH 2.30 (1H, m, H-18) 和2.20 (1H, d, J = 11.1 Hz, H-11);高场区给出4个甲基质子信号δH 1.46 (3H, s, H-16), 1.13 (3H, s, H-17), 1.11 (3H, d, J = 6.9 Hz, H-20) 和1.07 (3H, d, J = 6.9 Hz, H-19)。13C-NMR (150 MHz, CDCl3) 谱(表 1)高场区给出4个甲基碳信号δC21.2 (C-20), 23.4 (C-19), 26.6 (C-17) 和27.0 (C-16),6个亚甲基碳信号δC22.4 (C-4), 26.9 (C-14), 31.6 (C-15), 34.2 (C-8), 36.3 (C-9) 和38.4 (C-5),2个次甲基碳信号δC33.9 (C-18) 和50.7 (C-11),3个连氧季碳信号δC 83.7 (C-10), 87.0 (C-6) 和88.9 (C-7);低场区给出2组烯碳信号δC 118.0 (C-12), 133.6 (C-2), 144.4 (C-3) 和147.5 (C-13),1个羰基碳信号δC 170.3(C-1)。同时依据HMQC谱,将氢和碳相关信号进行详细归属(表 1)。
| 表 1 化合物1的1H-NMR和13C-NMR数据 Table 11H-NMR and 13C-NMR data for compound 1 |
将化合物1的NMR数据与已知化合物sarsolilide A[8]进行比较,两者数据非常相似,提示两者具有相似的结构。不同之处仅在于化合物1少了1组末端烯烃碳信号,多了1个单峰甲基碳信号和1个连氧季碳信号,初步推测化合物1可能是已知化合物sarsolilide A中的环外末端双键与H2O加成后的产物。
1H-1H COSY谱中,H-11 (δH 2.20) 与H-12 (δH 5.53) 相关,H2-8 (δH 1.90) 与H2-9 (δH 1.99, 1.84) 相关;HMBC谱中,H3-17 (δH 1.13) 与C-9 (δC 36.3)、C-10 (δC 83.7)、C-11 (δC 50.7) 相关;C-10 (δC 83.7) 是一个连氧季碳;以上信息说明1个单峰甲基 (δC 26.6) 连接在C-10上,并证实结构中存在C-8到C-12的结构片段。进一步分析HMBC谱,发现H2-8 (δH 1.90) 与C-7 (δC 88.9)、C-10 (δC 83.7)、C-11 (δC 50.7) 相关,H-11 (δH 2.20) 与C-7 (δC 88.9)、C-10 (δC 83.7)、C-12 (δC 118.0) 相关,这些关键相关说明化合物1存在C-7到C-11的五元环结构,从而证实了上述推断。
再次对比化合物1与已知化合物sarsolilide A的碳谱数据,发现两者C-1~C-7,C-11~C-15,C-18~C-20与C-16的化学位移数据基本一致,由此推断化合物1其余部分结构与已知化合物sarsolilide A相同,并从1H-1H COSY与HMBC远程相关(图 2)得以证实。1H-1H COSY谱中,H-18 (δH 2.30) 与H3-19 (δH 1.07)、H3-20 (δH1.11) 相关;HMBC谱中,H3-19 (δH 1.07) 与C-18 (δC 33.9)、C-13 (δC 147.5)、C-20 (δC 21.2) 相关;说明结构中存在1个异丙基,并且此异丙基连接在C-13位上。HMBC谱中,H3-16 (δH 1.46) 与C-5 (δC 38.4)、C-6 (δC 87.0)、C-7 (δC 88.9) 相关,同时C-7为连氧季碳,C-5为亚甲基碳,说明另外1个单峰甲基 (δH 27.0) 连接在C-6位上。最后,1H-1H COSY谱中,H2-15 (δH 2.93, 2.01) 与H2-14 (δH 2.50, 2.04) 相关,H2-4 (δH 2.88, 2.35) 与H-3 (δH 6.33)、H2-5 (δH 2.58) 相关;HMBC谱中,H-12 (δH 5.53) 与C-13 (δC 147.5)、C-14 (δC 26.9)、C-18 (δC 33.9) 相关,H-3 (δH 6.33) 与C-1 (δC 170.3)、C-15 (δC 31.6) 相关,H3-16 (δH 1.46) 与C-1 (δC 170.3) 相关;通过以上分析确定了化合物1的平面结构(图 1)。
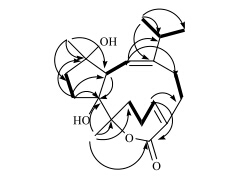 |
图 2 化合物1的关键HMBC ( )和1H-1H COSY ( )和1H-1H COSY ( )相关 Fig.2 Key HMBC ( )相关 Fig.2 Key HMBC ( ) and 1H-1H COSY ( ) and 1H-1H COSY ( ) correlations of compound 1 ) correlations of compound 1 |
H-12与H3-19,H-3与H2-14之间明显的NOE相关信号证实双键Δ12,13,Δ2,3的构型分别为E式与Z式,并且Δ2,3双键只能为Z式,否则无法构成七元内酯环。化合物1与已知化合物sarsolilide A在C-5、C-6、C-7、C-11、C-12和C-16位碳的化学位移数据一致,由此确定化合物1在C-6、C-7和C-11位的相对构型与已知化合物sarsolilide A相同,而C-10位的相对构型尚待其他方法确定。目前培养的化合物1的单晶太细,无法做X-单晶衍射,其单晶还在不断尝试培养中。综上所述,化合物1的结构确定为 (2Z,6R*,7R*11S*,12E)-6,10-dimethyl-7,10- dihydroxy-13-isopropyl-2,12-dolabelladiene-1,6-olide,是1个新化合物,命名为豆荚内酯B。
化合物2:无色油状物,ESI-MS m/z: 325 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 6.62 (1H, t, J = 7.2 Hz, H-11), 5.20 (1H, t, J = 7.0 Hz, H-7), 4.69 (1H, s, H-16a), 4.62 (1H, s, H-16b), 2.61 (1H, m, H-1), 1.72 (3H, s, H-20), 1.71 (3H, s, H-17), 1.64 (3H, s, H-19), 1.21 (3H, s, H-18);13C-NMR (150 MHz, CDCl3) δ: 44.2 (C-1), 33.1 (C-2), 62.1 (C-3), 60.2 (C-4), 39.2 (C-5), 24.2 (C-6), 125.8 (C-7), 134.8 (C-8), 38.7 (C-9), 25.9 (C-10), 144.1 (C-11), 137.4 (C-12), 188.9 (C-13), 43.2 (C-14), 148.3 (C-15), 110.8 (C-16), 19.6 (C-17), 11.6 (C-18), 15.8 (C-19), 16.8 (C-20)。以上数据与文献报道基本一致[9],故鉴定化合物2为 (1S*,3S*,4S*,7E,11E)-3,4-epoxy-13-oxo-7, 11,15-cembratriene。
化合物3:黄色油状物,ESI-MS m/z: 341 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 6.21 (1H, d, J = 11.5 Hz, H-2), 6.13 (1H, t, J = 4.2 Hz, H-11), 5.58 (1H, d, J = 11.5 Hz, H-3), 4.31 (1H, d, J = 9.8 Hz, H-7), 1.85 (3H, s, H-18), 1.45 (3H, s, H-19), 1.10 (3H, d, J = 6.9 Hz, H-16), 1.03 (3H, d, J = 6.9 Hz, H-17);13C-NMR (150 MHz, CDCl3) δ: 147.1 (C-1), 119.9 (C-2), 122.3 (C-3), 134.4 (C-4), 31.3 (C-5), 26.8 (C-6), 67.5 (C-7), 84.8 (C-8), 36.7 (C-9), 33.9 (C-10), 142.1 (C-11), 133.8 (C-12), 28.7 (C-13), 27.5 (C-14), 35.8 (C-15), 22.7 (C-16), 23.1 (C-17), 19.9 (C-18), 21.6 (C-19), 167.2 (C-20)。以上数据与文献报道基本一致[10, 11],故鉴定化合物3为 (2E,4E,7R,8S,12Z)-1- isopropylcyclotetradeca-4,8-dimethyl-7-hydroxy-1,3,11- triene-8,12-carbolactone。
化合物4:黄色油状物,ESI-MS m/z: 339 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 6.03 (1H, d, J = 11.2 Hz, H-2), 5.98 (1H, t, J = 4.3 Hz, H-11), 5.43 (1H, d, J = 11.2 Hz, H-3), 1.78 (3H, s, H-18), 1.53 (3H, s, H-19), 1.08 (3H, d, J = 7.0 Hz, H-16), 1.05 (3H, d, J = 7.0 Hz, H-17);13C-NMR (150 MHz, CDCl3) δ: 145.8 (C-1), 119.4 (C-2), 119.9 (C-3), 134.5 (C-4), 29.9 (C-5), 32.3 (C-6), 209.8 (C-7), 87.2 (C-8), 34.3 (C-9), 32.7 (C-10), 143.6 (C-11), 131.3 (C-12), 27.0 (C-13), 27.5 (C-14), 35.6 (C-15), 22.2 (C-16), 23.2 (C-17), 19.1 (C-18), 29.8 (C-19), 166.8 (C-20)。以上数据与文献报道基本一致[10, 11],故鉴定化合物4为 (2E,4E,8S,12Z)-1-isopropyl-4,8-dimethyl-7-oxo-cyclotetradeca-1,3,11-triene-8,12-carbolactone。
化合物5:黄色油状物,ESI-MS m/z: 427 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 7.58 (1H, d, J = 9.6 Hz, H-3), 6.34 (1H, t, J = 4.3 Hz, H-11), 5.98 (1H, d, J = 9.6 Hz, H-2), 5.27 (1H, brd, J = 10.9 Hz, H-7), 3.72 (3H, s, H-21), 2.07 (3H, s, H-23), 1.36 (3H, s, H-19), 1.12 (3H, d, J = 6.8 Hz, H-16), 1.09 (3H, d, J = 6.8 Hz, H-17);13C-NMR (150 MHz, CDCl3) δ: 156.1 (C-1), 120.6 (C-2), 138.5 (C-3), 129.7 (C-4), 22.4 (C-5), 28.2 (C-6), 68.1 (C-7), 83.2 (C-8), 36.1 (C-9), 28.9 (C-10), 142.5 (C-11), 134.1 (C-12), 35.6 (C-13), 32.8 (C-14), 30.3 (C-15), 19.3 (C-16), 23.7 (C-17), 166.7 (C-18), 25.6 (C-19), 166.1 (C-20), 52.6 (C-21), 170.1 (C-22), 22.3 (C-23)。以上数据与文献报道基本一致[12],故鉴定化合物5为sarcrassin D。
化合物6:无色油状物,ESI-MS m/z: 341 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 5.19 (1H, t, J = 2.8 Hz, H-17a), 5.11 (1H, d, J = 10.6 Hz, H-3), 5.06 (1H, t, J = 2.8 Hz, H-17b), 4.76 (1H, d, J = 10.6 Hz, H-2), 4.62 (1H, d, J = 13.1 Hz, H-16a), 4.39 (1H, d, J = 13.1 Hz, H-16b), 2.64 (1H, t, J = 4.1 Hz, H-7), 1.79 (3H, s, H-18), 1.60 (3H, s, H-20), 1.25 (3H, s, H-19);13C-NMR (150 MHz, CDCl3) δ: 82.5 (C-1), 85.4 (C-2), 122.7 (C-3), 140.5 (C-4), 38.8 (C-5), 26.7 (C-6), 63.4 (C-7), 61.1 (C-8), 41.3 (C-9), 24.8 (C-10), 124.6 (C-11), 137.4 (C-12), 35.7 (C-13), 33.8 (C-14), 153.6 (C-15), 70.2 (C-16), 107.4 (C-17), 17.5 (C-18), 17.8 (C-19), 16.3 (C-20)。以上数据与文献报道基本一致[13],故鉴定化合物6为laevigatol B。
| [1] | 邵长伦, 傅秀梅, 王长云, 等. 中国珊瑚礁资源状况及其药用研究调查III. 民间药用与药物研究状况 [J]. 中国海洋大学学报, 2009, 39(4): 691-698. |
| [2] | Duh C Y, Wang S K, Huang B T, et al. Cytotoxic cembrenolide diterpenes from the Formosan soft coral Lobophytum crassum [J]. J Nat Prod, 2000, 63(6): 884-885. |
| [3] | Rashid M A, Gustafson K R, Boyd M R. HIV-inhibitory cembrane derivatives from a Philippines collection of the soft coral Lobophytum species [J]. J Nat Prod, 2000, 63(4): 531-533. |
| [4] | Yamada K, Ryu K, Miyamoto T, et al. Bioactive terpenoids from Octocorallia.4. Three new cembrane-type diterpenoids from the soft coral Lobophytum schoedei [J]. J Nat Prod, 1997, 60(8): 798-801. |
| [5] | Kobayashi J, Ohizumi Y, Nakamura H, et al. Ca-antagonistic substance from soft coral of the genus Sarcophyton [J]. Experientia, 1983, 39(1): 67-69. |
| [6] | Anthoni U, Bock K, Christopherson C, et al. Structure of a novel antifouling epoxy cembrenoid diterpene from a Sarcophyton sp. [J]. Tetrahedron Lett, 1991, 32(24): 2825-2826. |
| [7] | 郎俊慧, 杨 帆, 甘建红, 等. 中国西沙豆荚软珊瑚Lobophytum sp.化学成分研究 [J]. 中草药, 2015, 46(20): 2999-3003. |
| [8] | Long K H, Huang S H, Shi K L. A novel diterpenolide from the soft coral Sarcophyton solidun [J]. J Nat Prod, 1992, 55(11): 1672-1675. |
| [9] | Ravi B N, Faulkner D J. Cembranoid diterpenes from a South Pacific soft coral [J]. J Org Chem, 1978, 43(11): 2127-2131. |
| [10] | Gross H, Wright A D, Beil W, et al. Two new bicyclic cembranolides from a new Sarcophyton species and determination of the absolute configuration of sarcoglaucol-16-one [J]. Org Biomol Chem, 2004, 2(8): 1133-1138. |
| [11] | Bowden B F, Coll J C, Willis R H, et al. Studies of Australian soft corals. XXVII. Two novel diterpenes from Sarcophyton glaucum [J]. Aust J Chem, 1982, 35(3): 621-627. |
| [12] | Zhang C X, Li J, Su J Y, et al. Cytotoxic diterpenoids from the soft coral Sarcophyton crassocaule [J]. J Nat Prod, 2006, 69(10): 1476-1480. |
| [13] | Quang T H, Ha T T, Minh C V, et al. Cytotoxic and anti-inflammatory cembranoids from the Vietnamese soft coral Lobophytum laevigatum [J]. Bioorg Med Chem, 2011, 19(8): 2625-2632. |
 2015, Vol. 46
2015, Vol. 46


