2. 天津中医药大学, 天津 300193;
3. 天津药物研究院, 天津 300193;
4. 中药现代制剂与质量控制技术国家地方联合工程实验室(天津), 天津 300193
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
4. National & Local United Engineering Laboratory of Modern Preparation and Quality Control Technology of Traditional Chinese Medicine (Tianjin), Tianjin 300193, China
红芪Hedysari Radix(HR)为豆科植物多序岩黄芪Hedysarum polybotrys Hand. -Mazz. 的干燥根,具有补气升阳、固表止汗的功效[1]。红芪为甘肃特色中药材,与黄芪同科异属,具有相同的功效,在我国西北地区多以红芪代用黄芪。自《中国药典》1985年版开始,红芪收载其中。红芪主要含有多糖、黄酮及苯丙素类成分,在抗肿瘤方面有着广阔的应用前景。本文对有关红芪的文献资料进行系统的整理,全面综述其化学成分和抗肿瘤作用研究进展,以期为红芪的进一步研究、开发和利用提供参考。
1 化学成分红芪中已发现的化学成分主要包括糖类(sacchcrides)、黄酮类(flavonoids)、苯丙素类(phenylpropanoids),其次还有三萜(triterpenoids)、甾体(steroids)及生物碱(alkaloids)类等成分。
1.1 糖类红芪多糖(Hedysarum polybotrys polysacchcrides,HPS)是红芪的重要活性成分,红芪中多糖平均量为9.01%[2]。李世刚等[3]通过对红芪的水提醇沉得到红芪多糖,再经葡聚糖凝胶柱色谱法分离纯化得到HPS-1、HPS-2和HPS-3;赵良功等[4]通过对红芪水提液的分级醇沉得到HPS-1、HPS-2、HPS-3和HPS-4。HPS-1、HPS-2、HPS-3、HPS-4均由鼠李糖、阿拉伯糖、木糖、葡萄糖和半乳糖5种单糖组成[5]。
惠和平等[6]对红芪多糖的结构鉴定表明,HPS-2为均一多糖,其中鼠李糖、木糖、阿拉伯糖、葡萄糖和半乳糖5种单糖的摩尔比为0.3∶0.2∶2.7∶16.1∶2.0,单糖主要为吡喃糖,异头碳以β型为主,并有少量的α型。陈同强等[7]对HPS-3进一步分离纯化,得到HPS-3-A、HPS-3-B、HPS-3-C和HPS-3-D;封士兰等[8]和党子龙等[9]对HPS-4进一步分离纯化,得到HPS-4-1A、HPS-4-1B和HPS-4-2A。
1.2 黄酮类目前从红芪中共分得14个黄酮类化合物,主要有异黄酮类(1~4)、黄酮类(5~7)和二氢黄酮类(8~10),其中化合物4、7、9、10为黄酮苷,此外还有黄酮醇(11)、查耳酮(12)、紫檀烷(13)和双苯吡酮(14)。具体化合物名称见表 1,结构式见图 1。
| 表 1 红芪中的黄酮类成分 Table 1Flavonoids in HR |
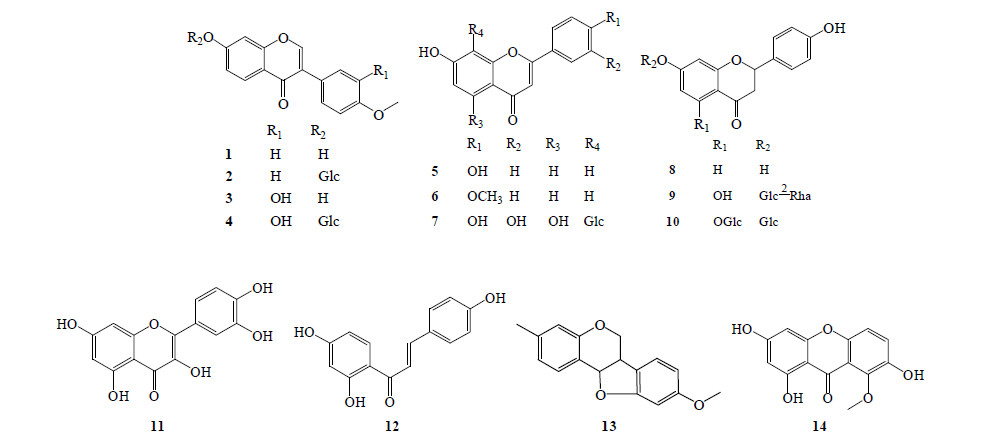 | 图 1 红芪中黄酮类成分结构Fig.1 Structures of flavonoids in HR |
苯丙素类成分也是红芪的主要成分之一。目前从红芪中共分得9个苯丙素类化合物(15~23),其中5个为简单苯丙素类(15~19),化合物20、21为骈双四氢呋喃类木脂素;化合物22、23为香豆苯醚类化合物。具体名称见表 2,结构式见图 2。
| 表 2 红芪中的苯丙素类成分 Table 2Phenylpropanoids in HR |
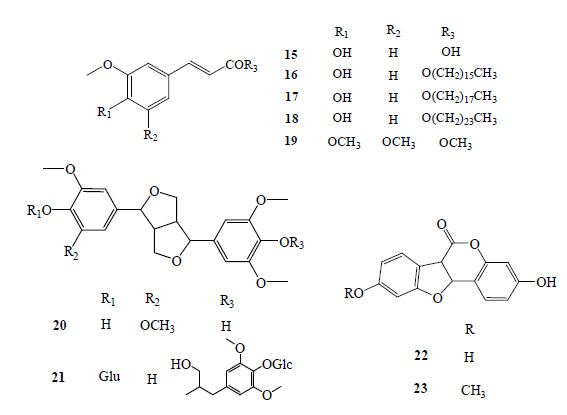 | 图 2 红芪中苯丙素类成分结构Fig.2 Structures of phenylpropanoids in HR |
红芪中共分到1个乌苏烷型和2个羽扇豆烷型三萜类化合物,分别是乌苏酸(24)、羽扇豆醇(25)和白桦酸(26)。从红芪的正丁醇部位分离得到4个三萜皂苷类化合物(27~30)。从红芪中还分到β-谷甾醇(31)和胡萝卜苷(32)2个甾体类成分。具体名称见表 3,结构式见图 3。
| 表 3 红芪中的三萜、三萜皂苷及甾体类成分 Table 3Terpenoids, terpenoid saponins, and steroids in HR |
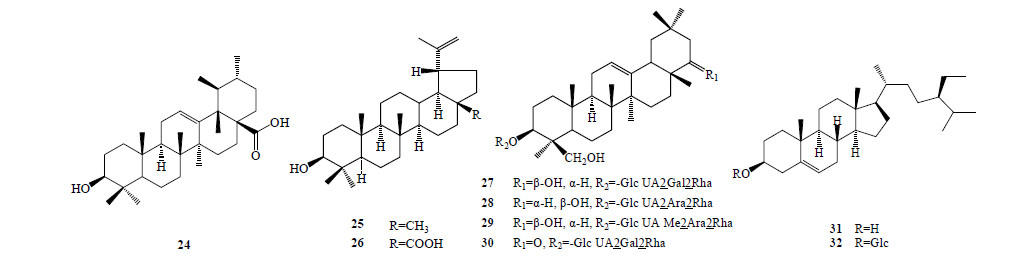 | 图 3 红芪中三萜、三萜皂苷及甾体类成分结构Fig.3 Structures of terpenoids, terpenoid saponins, and steroids in HR |
红芪中除含有上述较常见的成分外,尚有生物碱、酚酸以及脂肪烃类化合物,如下箴桐碱(33)、香草酸(34)、硬脂酸(38)、木蜡酸(39)、三油酸甘油酯(41)和单棕榈酸甘油酯(42)等。红芪含21种微量元素,其中13种为生命活动所必需,Ca和Mg的量很高,其中有1/3具有明显生理活性[22]。Hiroshi等[23]研究发现,红芪与黄芪均含有γ-氨基丁酸(GABA),红芪中GABA的量为0.094%,高于黄芪的0.024%。其他类成分见表 4,结构式见图 4。
| 表 4 红芪中的其他成分 Table 4Other constituents isolated from HR |
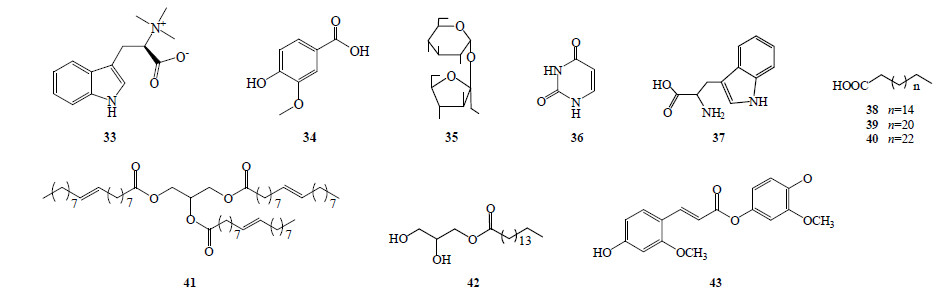 | 图 4 红芪中的其他成分结构式Fig.4 Structures of other constituents isolated from HR |
近年来对红芪的抗肿瘤作用研究较多,其主要活性成分为HPS,黄酮和皂苷也具有一定的抗肿瘤作用。红芪的活性成分主要通过抑制肿瘤细胞的生长、诱导肿瘤细胞凋亡、上调机体免疫功能以及协同化疗药物等发挥抗肿瘤作用。红芪的活性成分对肝癌细胞、S180荷瘤小鼠癌细胞、肺腺癌A549细胞、胃腺癌MGC-803细胞、人宫颈癌HeLa细胞、人白血病K562细胞和人早幼粒白血病HL-60细胞均有抑制作用。
2.1 抑制肿瘤细胞的生长近年来对红芪的活性成分的抑制肿瘤细胞生长的研究较多,其主要活性成分为红芪多糖和黄酮类化合物。研究发现,红芪中的紫檀烷类化合物3-羟基-9-甲氧基紫檀烷对人肝癌细胞系HepG-2具有一定的细胞毒活性,对HepG-2的IC50为10.69 μmol/L[11]。HPS对体外培养的人肝癌HepG-2细胞的增殖抑制作用具有时间及剂量依赖性,400 μg/mL HPS作用72 h后对HepG-2细胞抑制率(RI)达到33.8%;HPS作用72 h后,通过阻滞G2/M期细胞、降低Bcl-2蛋白表达水平、提高Bax蛋白表达水平以发挥抗肿瘤作用[26]。HPS-1质量浓度为400 μg/mL时对HepG-2的RI为36.0%[3]。
研究表明,ip HPS能使Ascitic Hepatoma腹水型肝癌细胞(AH)荷瘤小鼠淋巴细胞内cAMP和DNA的量明显增加,并能抑制AH细胞的增殖,其RI为51%[27]。HPS-1、HPS-2和HPS-3(200 mg/kg) ip S180荷瘤小鼠均可提高荷瘤小鼠生存质量,抑制肿瘤生长[28]。HPS体外作用于A549后可明显改变其蛋白表达谱,从中筛选出35个差异明显的蛋白,这些蛋白可能是HPS体外抑制A549增殖的相关蛋白质[29]。李世刚等[3]研究表明,400 μg/mL HPS体外对MGC-803的RI为11.9%;400 μg/mL HPS-3对MGC-803的RI为36.3%。研究发现,HPS-3能抑制MGC-803细胞的增殖[30]。红芪总黄酮在20~ 100 μg/mL内,随着浓度的增大,抑制K562细胞增殖作用明显增强,随时间的延长其抑制率增高[31]。
2.2 诱导肿瘤细胞凋亡诱导肿瘤细胞凋亡是红芪活性成分抗肿瘤作用机制之一,主要活性成分有HPS、硫酸化修饰的HPS以及红芪总黄酮,其活性成分对S180荷瘤小鼠癌细胞、A549细胞、HeLa细胞等均有诱导凋亡作用。中剂量(200 mg/kg)的HPS ip S180荷瘤小鼠,瘤细胞内钙离子浓度、自由基量明显升高,线粒体膜电位和瘤细胞DNA、RNA量降低,诱导S180细胞凋亡[32]。研究表明,硫酸化修饰的HPS在体外具有抗A549细胞活性,可使其细胞周期阻滞在G1期[33]。HPS-3能通过在G2/M期阻滞MGC-803细胞、诱导细胞凋亡、降低Bcl-2蛋白水平等作用机制发挥肿瘤作用[30]。此外,硫酸化修饰的红芪多糖在体外可使MGC-803细胞周期被阻滞于G1期[33]。HPS可明显影响HeLa细胞的蛋白表达谱,经质谱鉴定成功的核仁磷酸蛋白、α-烯醇酶、磷酸丙糖异构酶、乙酰基辅酶A还原酶与HPS的体外抗肿瘤作用相关[29]。
红芪总黄酮作用于HL-60细胞后,氯化硝基四唑氮蓝(NBT)还原能力增强,CD1lb表达升高,细胞被阻滞于G0/G1及G2/M期,S期细胞数相应减少,C-fos基因表达升高[34]。
2.3 增强免疫功能机体的免疫功能对肿瘤的发生、发展以及治疗均发挥着重要作用。多糖类化合物通过活化杀伤性T细胞和巨噬细胞、促进细胞因子分泌和活化补体等增强机体抗肿瘤作用,并改善由化疗所致的免疫功能低下状态。多糖可通过改变细胞膜的生化特性、诱导肿瘤细胞分化与凋亡、影响肿瘤细胞内信号传递等多途径发挥抗肿瘤作用,但一般认为免疫调节是其主要作用方式,这可能与多糖的生物活性主要通过与相应受体识别才能发挥作用有关。HPS-1、HPS-2和HPS-3(200 mg/kg)ip S180荷瘤小鼠均可增强淋巴细胞转化功能、NK细胞和LAK细胞活性,改善红细胞天然免疫功能,但以HPS-3的作用最佳[28]。研究表明,ip中剂量200 mg/kg HPS能明显抑制小鼠S180瘤质量增长及体积增加,提高NK细胞水平[35]。用MTT法观察HPS对LAK细胞的影响,HPS无明显促进LAK细胞扩增的作用,但与LAK细胞或单个核细胞(PBMC)合用可显著增强其对膀胱肿瘤细胞株EJ和原代肿瘤细胞的杀伤作用[36]。
2.4 协同化疗药物抗肿瘤作用HPS-1可对顺铂(DDP)治疗肺腺癌起增效作用,不同浓度(50、100、200、400 mg/L)的HPS-1对肺腺癌A549细胞的生长均有抑制作用,RI与浓度和时间呈正相关;HPS-1联合DDP可使A549细胞凋亡率较单用DDP组凋亡率明显增加,且细胞周期阻滞于G1和S期;HPS-1联合DDP处理对Bcl-2和Bax蛋白表达的抑制或促进作用均较单用DDP组明显增强,具有协同作用[37]。
HPS联合环磷酰胺(CTX)可减轻CTX对S180荷瘤小鼠的免疫抑制作用,增强CTX对S180细胞的化疗效果。HPS与CTX合用后,各剂量组均能明显抑制CTX所致的白细胞数量下降,只有中剂量的HPS与CTX合用能够降低肿瘤的质量,并能明显抑制CTX所致的CD3+ T细胞和NK细胞数量下降;中剂量的HPS具有降低CTX免疫抑制和骨髓抑制的作用,其机制与提高T细胞和NK细胞介导的免疫应答有关[35]。
3 结语与展望通过对红芪化学成分及抗肿瘤作用相关文献的研究,发现红芪具有悠久的民间药用历史,具有抗肿瘤等多种药理作用。恶性肿瘤已成为威胁人类健康的严重疾病,寻找疗效确切、低毒等优点的天然抗肿瘤药已成为研究热点。多糖作为红芪的一种低毒而免疫活性强的物质引起了广泛的关注。
红芪多糖对多种肿瘤细胞都有很好的抑制作用,除能增强机体免疫力,通过机体免疫机制抗癌之外,还能在体内外引起肿瘤细胞周期停滞、诱导肿瘤细胞的凋亡、对化疗药物减毒增效等。至今已发现的大多数具有抗肿瘤活性的多糖都具有β-葡聚糖的主链结构[38]。具有β-(1→3)-糖苷键主链的多糖表现出较高的抗肿瘤活性,具有β-(1→4)-糖苷键、β-(1→6)-糖苷键主链的多糖表现出较低的抗肿瘤活性或者没有抗肿瘤活性[39],对红芪多糖结构的进一步研究能更好地阐述其抗肿瘤作用的构效关系。红芪多糖的化学结构是其生物活性的基础,其受单糖组成、相对分子质量的大小、糖苷键的连接方式、多糖的立体结构等多种因素的影响,而呈现出生理活性的多样性。红芪及其有效成分的抗肿瘤机制尚不完全明确,需要进一步深入研究。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 王新玲, 王 茜, 马彦玲, 等. 红芪根中多糖的提取及含量测定[J]. 新疆中医药, 2009, 27(4): 55-57. |
| [3] | 李世刚, 张永琦, 赵健雄, 等. 红芪多糖体外抗肿瘤活性及构效关系研究[J]. 中药药理与临床, 2007, 23(6): 35-37. |
| [4] | 赵良功, 李晓东, 赵建辉, 等. 4种红芪多糖对实验性糖尿病小鼠血糖的影响[J]. 中药材, 2009, 32(10): 1590-1592. |
| [5] | 李 冰, 封士兰, 刘小花, 等. HPLC测定红芪药材中红芪多糖的含量[J]. 中成药, 2008, 30(5): 716-718. |
| [6] | 惠和平, 封士兰, 赵良功, 等. 红芪多糖的纯化及初步结构鉴定[J]. 时珍国医国药, 2010, 21(9): 2302-2303. |
| [7] | 陈同强, Adilbekov J, 赵良功, 等. 红芪多糖3中4个组分的单糖组成分析及多糖含量测定[J]. 中国药学杂志, 2012, 47(7): 551-555. |
| [8] | 封士兰, 赵良功, 封德梅, 等. 红芪多糖4及其有效成分的制备和应用: 中国, CN103073650A[P]. 2013-05-01. |
| [9] | 党子龙, 刘小花, 赵安娜, 等. 红芪多糖HPS4-1A的化学结构特征研究及分子构象初步分析[J]. 中草药, 2013, 44(2): 141-146. |
| [10] | 海力茜, 张庆英, 梁 鸿, 等. 多序岩黄芪化学成分研究[J]. 药学学报, 2003, 38(8): 592-595. |
| [11] | 李云志, 黄 静, 郭弘川, 等 红芪化学成分和抗肿瘤活性研究[J]. 中草药, 2009, 40(8): 1195-1198. |
| [12] | 郑善松, 吴 弢, 王峥涛. 多序岩黄芪根化学成分研究[J]. 中国中药杂志, 2011, 36(17): 2350-2352. |
| [13] | 刘 毅, 张 征, 张庆英, 等. 红芪化学成分及其抗氧化活性研究[J]. 中国药事, 2010, 24(6): 543-545. |
| [14] | 刘 扬. 多序岩黄芪化学成分的研究[D]. 北京: 中国协和医科大学, 2006. |
| [15] | 刘 扬, 杨峻山. 多序岩黄芪化学成分研究[J]. 中国药学杂志, 2005, 40(16): 1215-1216. |
| [16] | 海力茜, 张庆英, 赵玉英, 等. 多序岩黄芪化学成分研究[J]. 中国中药杂志, 2004, 29(5): 432-434. |
| [17] | 王 锐, 陈耀祖. 红芪化学成分分析研究[J]. 兰州大学学报, 1988, 24(3): 46-50. |
| [18] | 海力茜, 梁 鸿, 赵玉英, 等. 多序岩黄芪化学成分研究[J]. 中国中药杂志, 2002, 27(11): 843-845. |
| [19] | 潘竞先, 刘 薇, 卫 东, 等. 红芪化学成分的研究I[J]. 北京医学院学报, 1984, 16(3): 248-250. |
| [20] | 海力茜·陶尔大洪, 张庆英, 王 岩, 等. 多序岩黄芪化学成分研究 (IV)[J]. 时珍国医国药, 2006, 17(9): 1659-1659. |
| [21] | 刘 毅, 张庆英, 赵玉英, 等. 多序岩黄芪化学成分研究[A] // 第六届全国药用植物与植物药学术研讨会论文集[C]. 长春: 中国植物学会药用植物和植物药专业委员会, 2006. |
| [22] | 段志兴, 孙丽君, 郑海金, 等. 红芪根中的微量元素和氨基酸[J]. 兰州大学学报: 自然科学版, 1990, 26(2): 79-82. |
| [23] | Hiroshi H, Funayama S, Endo K. Hypotensive principle of Astragalus and Hedysarum roots[J]. Planta Med, 1976, 30(4): 297-302. |
| [24] | Cheng F, Zou K, Zhu S, et al. A new phenylpropionate derivative from the rhizomes of Hedysarum polybotrys[J]. Chin J Nat Med, 2009, 7(5): 351-353. |
| [25] | Zou K, Komatsu K, Zhu S. A novel compound from Hedysarum polybotrys[J]. J Asian Nat Prod Res, 2007, 9(6/8): 699-703. |
| [26] | 董玉梅, 王小虎, 寇 炜, 等. 红芪多糖联合X线对HepG-2细胞DNA损伤的影响[J]. 实用肿瘤杂志, 2012, 27(4): 344-349. |
| [27] | 王 勤, 郑海金, 张万庆, 等. 甘肃武都米仓山红芪研究 III. 红芪多糖的免疫作用及其对荷瘤小鼠淋巴细胞内cAMP, DNA含量的影响[J]. 兰州大学学报, 1991, 27(2): 125-128. |
| [28] | 王希玉, 路 莉, 胡 燕, 等. 不同红芪多糖抗肿瘤和免疫调节作用研究[J]. 中药药理与临床, 2009, 25(5): 72-74. |
| [29] | 卫东锋. 红芪多糖调节免疫及抗肿瘤作用的蛋白质组学研究[D]. 兰州: 兰州大学, 2012. |
| [30] | 李世刚, 张永琦, 赵健雄, 等. 红芪多糖HPS-3体外诱导人胃癌MGC-803细胞凋亡的研究[J]. 中药药理与临床, 2007, 23(3): 49-51. |
| [31] | 王雅莉. 红芪总黄酮对K562细胞增殖的抑制作用及机理研究[D]. 兰州: 兰州大学, 2007. |
| [32] | 雷丰丰, 赵健雄, 王学习, 等. 红芪总多糖诱导S180瘤细胞凋亡的实验研究[J]. 中成药, 2008, 30(7): 961-964. |
| [33] | Wei D, Wei Y, Cheng W, et al. Sulfated modification, characterization and antitumor activities of Radix Hedysari polysaccharide[J]. Int J Biol Macromol, 2012, 51(4): 471-476. |
| [34] | 李广远, 陈 彻, 楚惠媛. 红芪总黄酮对人白血病细胞诱导分化的影响[J]. 中国中医药信息杂志, 2008, 15(7): 39-40. |
| [35] | 姚宝泰, 赵健雄, 薛凤英, 等. 红芪总多糖对荷S180瘤小鼠的抑瘤作用及其机制的研究[J]. 药物评价研究, 2012, 35(2): 90-93. |
| [36] | 崔笑梅, 王志平, 张志华, 等. 红芪多糖增强LAK细胞对膀胱肿瘤细胞的杀伤作用[J]. 中药药理与临床, 1998, 14(2): 19-20. |
| [37] | 刘 华, 闫立萍, 王小军. 红芪多糖1联合顺铂对肺癌A549细胞凋亡的协同作用及其机制探讨[J]. 肿瘤, 2013, 33(11): 980-984. |
| [38] | Tong H B, Xia F G, Feng F, et al. Structural charaterizaion and in vitro antitumor activity of a novel polysaccharide isolated from the fruiting bodies of Pleurotus ostreatus[J]. Bioresour Technol, 2009, 100(4): 1682-1686. |
| [39] | Wasser S P. Medicinal mushrooms as a source of antitumor and immuno-modulating polysaccharides[J]. Appl Microbiol Biotechnol, 2002, 60(3): 258-274. |
 2015, Vol. 46
2015, Vol. 46


