2. 江苏康缘药业股份有限公司, 江苏 连云港 222000
2. Jiangsu Kanion Pharmaceutical. Co., Ltd., Liangyungang 222000, China
泽泻Alismatis Rhizoma始载于《神农本草经》[1],列为上品。《中国药典》2015年版一部[2]收录的泽泻为泽泻科植物泽泻Alisma orientalis (Sam.) Juzep. 的干燥块茎,具有利水渗湿、泄热、化浊降脂的功效,用于小便不利、水肿胀满、泄泻尿少、痰饮眩晕、热淋涩痛、高脂血症。泽泻在温带、亚热带地区均可生长,被广泛种植于福建、四川、江西、广东、广西等地[3],是川、闽的道地药材。泽泻应用历史悠久,在中医现存最早的著作《内经》中,泽泻饮是其十三方中最重要的方剂之一。汉朝医圣张仲景善用泽泻,其代表方剂有五苓散、猪苓汤、泽泻汤及仲景八味丸,均重用泽泻。宋朝儿科圣手钱乙的名方六味地黄丸至今仍广泛应用。2002年,泽泻被我国原卫生部列入可用于保健食品的名单。泽泻具有调血脂[4, 5, 6, 7, 8]、利尿[9]、抗尿路结石[10, 11, 12]、降血糖[13, 14, 15, 16]、抗炎[17, 18]、抗乙肝病毒[19, 20]及抗肿瘤[21, 22, 23, 24]等多种作用。小林忠之[25]在20世纪60年代研究泽泻抗脂肪肝作用,我国在20世纪70年代起开展了泽泻提取物调血脂的临床、质量控制、化学成分、药理药效等研究。近年有文献报道了泽泻的安全性评价、药动学研究等。由于至今未见泽泻提取物调血脂药品的上市,本文期望从泽泻调血脂活性成分、药理、毒理和临床研究等方面进行综述,探讨其作为调血脂新药开发的可能。
1 泽泻的调血脂活性成分泽泻含淀粉(约25%)、蛋白质(约7%)、脂类[26](如棕榈酸、硬脂酸、油酸及亚油酸等)、泽泻多糖(alisman PII[27]、alisman PIIIF和alisman SI[27, 28])及被认为是泽泻主要活性成分的萜类化合物[29]。目前从泽泻中已经分离到三萜类51个、倍半萜类19个以及二萜类3个。三萜类成分的分子结构多为原萜烷型(protostane)四环三萜[30],其中泽泻醇A、泽泻醇A 24-乙酸酯以及泽泻醇B 23-乙酸酯等成分是泽泻调血脂生物活性的物质基础。
在20世纪70年代,Tadakzu等[8]通过喂以含1%胆固醇、0.2%胆酸钠和0.2%胆碱的高脂饲料,建立SD雄性大鼠高脂血症模型,筛选泽泻的调血脂活性成分。将一定比例的泽泻提取物(0.1%或0.5%)混入饲料,喂食10 d后测定大鼠血脂水平,在活性追踪下进行调血脂活性成分的分离纯化。
从调血脂活性的部位经硅胶柱色谱分离到5个化合物,其中泽泻醇A、泽泻醇A 24-乙酸酯、泽泻醇B 23-乙酸酯以及泽泻醇C 23-乙酸酯均显示大于50%的调脂活性。泽泻醇A等代表性原烷型三萜类化学结构见图 1。泽泻醇A为无定形物质,不能通过单晶X射线衍射法确定立体构型,为此Kazuhide等[31]通过合成易于结晶的泽泻醇A (23,24)-缩酮-11-乙酸酯,通过单晶X射线衍射法确定立体构型后,推测泽泻醇A的立体化学结构(图 2)。
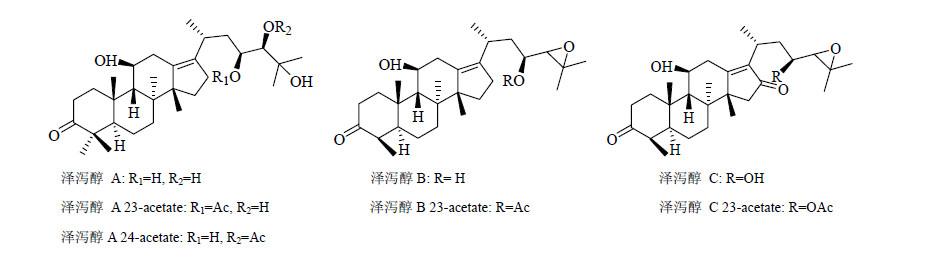 | 图 1 泽泻中部分原萜烷型三萜的结构Fig.1 Structures of some protostane triterpenoids in Alismatis Rhizoma |
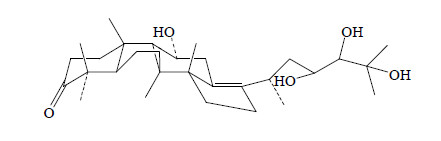 | 图 2 泽泻醇A的立体化学结构式Fig.2 Stereochemistrystructure of alisol A |
Imai等[32]通过合成泽泻醇A 24-乙酸酯的一些衍生物,与泽泻醇A等进行调血脂作用比较。构效关系研究发现,泽泻三萜侧链上3个相邻的羟基是发挥调脂作用的必要基团,将侧链C-23氧化成醛基,调脂活性消失;C-23,24的羟基成乙酸酯后活性增强;C-11羟基成酯后活性消失[32]。
Imai等[33]采用14C标记的胆固醇研究泽泻醇A 24-乙酸酯对外源性胆固醇吸收的抑制作用,以胸部导管插管收集淋巴液并测定淋巴液中乳糜微粒的量。研究发现,每只大鼠ig 2.5 mg的泽泻醇A 24-乙酸酯6 h后,34%胆固醇被抑制进入乳糜微粒,进而减少胆固醇经乳糜微粒通过淋巴系统的吸收,该抑制作用在泽泻醇A 24-乙酸酯0.5~80 mg内呈明显量效关系。通过比较接收到的淋巴中乳糜微粒中外源性胆固醇和总胆固醇(TC)的量,发现泽泻醇A 24-乙酸酯不仅显著抑制外源性胆固醇(14C放射标记)的吸收,而且内源性胆固醇的吸收(乳糜微粒中TC量减去14C放射标记的TC量)也明显降低。泽泻醇A 24-乙酸酯在给药6 h后,大鼠TC吸收量为(12.50±0.53)mg,明显低于模型组的(19.98±1.70)mg。
泽泻新鲜块茎中泽泻醇B和泽泻醇B 23-乙酸酯的量较高[34, 35, 36],经干燥、存贮以及炮制,泽泻醇B及其乙酸酯会转化为泽泻醇A和泽泻醇A单乙酸酯[35, 36, 37, 38],泽泻醇C的母核是泽泻醇B在C-16位的羰基化产物[35, 39]。
泽泻醇A 24-乙酸酯是泽泻醇A在C-24位上的羟基乙酸酯化而成,在溶液中的稳定性较差,Makabel等[40]发现其在不同溶剂中的稳定性依次为丙酮>醋酸乙酯>氯仿>乙腈>无水乙醇>95%乙醇>甲醇>无水甲醇。在甲醇溶液中60 min即有近50%泽泻醇A 24-乙酸酯转化为泽泻醇A 23-乙酸酯;在室温下放置120 d后几乎完全转化为泽泻醇A。
2 泽泻提取物及其萜类成分调血脂活性1976年,我国就系统研究了泽泻乙醇提取物对家兔高脂血症的预防、治疗作用及对雄性高脂血症模型大鼠的调血脂作用,以及泽泻醋酸乙酯提取物对正常大鼠血清TC的降低作用[41]。给药2周后,泽泻乙醇提取物或醋酸乙酯提取物开始显示降低受试动物血清TC,动物一般健康状况良好。陶晋舆等[42]研究了泽泻提取物对实验性大鼠、家兔的调血脂及抗动脉粥样硬化作用。经2个半月的给药,高脂饲料喂养的家兔血清TC为136.9 mg/dL(模型组为273.43 mg/dL),三酰甘油(TG)为55.74 mg/dL(模型组血清TG为104.4 mg/dL),高密度胆固醇脂蛋白(HDL-C)为24.27 mg/dL(模型组为17.59 mg/dL),显示泽泻降血清TC和TG,升高HDL-C作用显著。8只给药的家兔主动脉呈中度及轻度病变,未见有重度病变,对照组6只家兔中4例病变程度严重,进展活跃者4例,显示泽泻提取物对高脂饲料喂养家兔的动脉粥样硬化有明显的抑制作用。
后续的机制研究[37]显示,泽泻中原烷型三萜是法尼醇X受体(farnesoid X receptor,FXR)激动剂,而FXR参与调控胆固醇7α-羟化酶(CYP7A1)和胆盐外排泵(bile salt export pump),从而调控机体胆固醇的动态平衡。以泽泻醇M 23-乙酸酯和泽泻醇A 23-乙酸酯为受试药物,以鹅去氧胆酸为阳性药物,研究其对HepG2细胞FXR的作用,结果显示,浓度为1、10 μmol/L的泽泻醇M 23-乙酸酯或泽泻醇A 23-乙酸酯均显示出剂量依赖性的激活FXR作用,进而上调磷脂转移蛋白的表达,促进磷脂从极低密度脂蛋白(VLDL)和乳糜微粒(MC)向高密度脂蛋白(HDL)转运。李淑子等[43]研究显示,泽泻醇提物、水提物及泽泻多糖均有降低TC、TG,升高HDL-C,以及升高超氧化物歧化酶(SOD)和降低丙二醛(MDA)水平的作用,显示较强的抗氧化能力和保护肝组织细胞的作用。张春海等[44]研究发现,泽泻醇提物和水提物均能降低肥胖小鼠的TC、TG,升高HDL-C水平。秦建国等[45]采用ApoE−\−C57小鼠研究泽泻萜类化合物的调血脂及对受试动物肝脏基底膜硫酸乙酰肝素蛋白多糖(HSPG)的调节作用,发现泽泻萜类化合物能显著降低受试小鼠血清低密度胆固醇(LDL)水平,对抗高脂饲料引起的HSPG降低作用,促进肝脏清除乳糜残粒。
泽泻在降低TC、LDL-C水平的同时,能较显著地升高HDL-C水平,发挥促进胆固醇逆向转运的作用,其良好的降TG作用也值得进一步关注。
3 泽泻提取物及其萜类成分抗动脉粥样硬化活性现代药理研究表明,动脉粥样硬化实际上是一个慢性炎症的过程,因此泽泻的调血脂作用又兼有抗炎活性。张力华等[46]研究发现,ig泽泻醇提物能明显抑制L-蛋氨酸长期注射引起的内皮氧化损伤家兔的血清诱导型一氧化氮(NO)合成酶(iNOS)和NO合成酶(NOS)水平,抑制NO异常增加保护血管内皮免受损伤,进而发挥抗动脉粥样硬化作用。Chen等[47]研究发现,浓度为10 μmol/L的泽泻醇B 23-乙酸酯作用于主动脉平滑肌细胞或淋巴细胞,均能通过显著上调促凋亡基因C-myc和bax的表达,启动细胞凋亡。诱导平滑肌细胞凋亡可下调动脉粥样硬化疾病进展过程中细胞过度分裂,有利于斑块稳定,既发挥抗动脉粥样硬化作用,还可能是预防血管成形术后再狭窄的有效措施。
Kim等[17]研究表明,泽泻醇B 23-乙酸酯和泽泻倍半萜成分alismol具有抑制巨噬细胞RAW 264.7在干扰素γ和脂多糖诱导下合成NO的活性,该作用至少是部分通过抑制iNOS mRNA的表达发挥作用的。Chang等[18]研究发现,泽泻乙醇提取物在RAW 264.7细胞体系以及C57小鼠体内,均能显著抑制脂多糖引起的炎症反应,通过抑制核因子- κB(NF-κB),激活核因子E2相关因子(Nrf2),进而调控环氧合酶-2(COX-2)、白细胞介素-1β(IL-1β)和iNOS等炎症因子,发挥抗炎作用。C57小鼠连续14 d ig 0.3、1.2 g/kg剂量泽泻乙醇提取物,再鼻腔给予脂多糖造急性肺炎模型,24 h后处死小鼠取肺组织,模型组(给脂多糖)肺组织出现严重炎症反应,高、低剂量泽泻乙醇提取物组均显示炎症程度减轻;细胞计数结果显示,高、低剂量泽泻乙醇提取物组中性粒细胞数量明显低于模型组,显示与剂量相关的抗炎效果。Matsuda等[48]研究了泽泻中8个倍半萜和18个原烷型三萜对小鼠巨噬细胞在脂多糖刺激下抑制NO生成的活性,发现泽泻醇A等化合物在3~30 μmol/L浓度下即产生明显的抑制NO生成作用。泽泻的抗血管平滑肌炎症作用可能是抗动脉粥样硬化的重要途径。
4 泽泻提取物的临床应用20世纪70年代我国的一些医院已对泽泻提取物的调血脂作用进行了临床研究。江西省第一人民医院自1973年11月起,应用泽泻水提醇沉浸膏片,按每人每天服用42 g生药的剂量治疗19例高脂血症患者,用药2周后,TC降低19.7%,β-脂蛋白降低20.3%,TG降低26.5%;用药4周后,患者TC平均降低16.4%,β-脂蛋白降低幅度达27%,TG降低26.6%。17例高胆固醇血症患者,服药2周,88.23%的患者TC明显降低,服药4周后,接受检查的13例高胆固醇血症患者TC全部降低,与服药前比,差异存在统计学意义(P<0.001)。接受治疗的19例高β-脂蛋白血症患者在服药2~4周后,β-脂蛋白水平均明显下降[4]。
1976年,原上海第一医学院中山医院采用泽泻乙醇提取物制成的浸膏片,以每日27 g生药的剂量治疗110例高脂血症患者,1个月后,高TC的44例患者平均TC下降9.0%,其中半数以上下降幅度达10%以上,部分受试者用药3个月,TC下降达22.6%,103例高TG患者经1个月治疗,TG平均下降23.5%,其中下降幅度10%以上者占65%,下降30%以上者占40.8%,有18.4%的患者TG下降超过50%。用药至3个月,平均TG下降35.8%。经统计学分析,治疗前后TC、TG平均水平均有显著性差异(P<0.01)[5]。
1978年9月至1979年4月,江苏省中医研究所冠心病组在南京第二机床厂开展泽泻浸膏片治疗高脂血症的临床观察[6],对比20例高脂血症患者服用泽泻醇提浸膏片前后的血脂变化,服药剂量相当于27 g生药,治疗5、11、19周后,TC分别下降10.35%、6.61%和13.94%,TG分别下降7.01%、21.99%和21.86%。20例患者的血清HDL-C分别在接受治疗的5、11、19周时升高57.29%、51.10%和51.65%,相应的HDL-C/TC值在治疗5、11、19周时分别升高81.94%、68.99%和84.80%,治疗前后相应血脂变化具统计学意义。停药10周后,受试者的血清TC、TG均值和下降率均维持停药前水平,HDL-C仍保持较高水平,血脂指标未反弹。
1976年,浙江省泽泻研究组报道了泽泻醇提浸膏片的调血脂临床疗效[7],观察病例262例,年龄27~65岁,多数为服用其他调血脂药物无效的高脂血症患者。135例高胆固醇患者口服泽泻片9~16片(相当于生药22.5~44.8 g),经1~3个月治疗后,平均血清TC较服药前下降16.86%(P<0.001),119例有不同程度下降,占88%。137例高TG患者经1~3个月的用药,TG平均下降14.13%(P<0.001),98例有不同程度下降,占72%。研究过程中发现,用药1个月,88例受试者平均TC降低16.76%,用药2个月,25例受试者平均TC降低20.25%,说明随着疗程延长,泽泻调血脂疗效增强。从血脂升降幅度及频数分布分析,均可证明泽泻降脂片具有降低血清TC和TG的作用,并以降TC作用为优。
5 泽泻的安全性研究陈小青等[49]将泽泻提取物ig给药,小鼠的半数致死量为21.50 g/kg,毒性级别应属于无毒级。段雪英等[50]研究发现,大鼠连续60 d ig泽泻水提物,观察大鼠行为、活动、毛色光泽、饮食以及粪便等,均未见明显异常,大鼠肝脏无明显的病理改变。高剂量泽泻组大鼠肾功能部分指标(尿γ-GT)有异常变化,但病理组织学检查未见明显病理性损伤。Huang等[51]以不同剂量泽泻三萜类提取物(360、720和1 440 g/kg)ig SD大鼠90 d,未观测到动物死亡和与受试药物相关的血液、尿液、体质量、摄食量、器官指数等指标改变,认为1 440 g/kg的给药剂量是泽泻三萜类提取物的安全剂量。关于泽泻肾毒性的研究,祝建辉等[52]以正常大鼠与1/2肾切除大鼠为模型比较连续8周ig泽泻水煎剂对受试动物尿常规和肾毒性。泽泻水煎剂对正常大鼠无明显肾脏毒性,但1/2肾切除大鼠的肾小管和肾间质均受到损害。赵筱萍等[53]通过猪肾近曲小管上皮细胞株(LLC-PK1)模型追踪泽泻的肾毒性成分,发现泽泻醇C和16,23-环氧泽泻醇B以及泽泻醇O可能会引起肾毒性,在临床应用和新药研究过程中应引起重视。
作为须长期用药的调血脂药,安全性尤为重要,在泽泻的调血脂新药开发过程中,应尽量除去药物中可能引起毒副作用的成分,并监控其量,以提高用药安全性。而符合GLP的安全性评价研究亦是新药开发过程中的重要环节,目前尚未见泽泻提取物该方面的相关报道。
6 泽泻化学成分的药动学研究吴启南等[54]建立了HPLC-UV测定泽泻醇A 24-乙酸酯和泽泻醇B 23-乙酸酯在大鼠体内的药动学方法,考察了药物经尿液和胆汁排泄情况,二者均口服吸收快,药时曲线呈明显的双峰现象,24 h尿液中检测到给药总量的0.04%和0.06%,说明原型药物经尿液排泄很少,胆汁中也未检测到泽泻醇A 24-乙酸酯。罗永东等[55]采用乙腈蛋白沉淀法进行样品前处理,用HPLC-UV法测定大鼠血浆中药物浓度,比较了泽泻醇B 23-乙酸酯大鼠po和iv的生物利用度。泽泻醇B 23-乙酸酯po 6 mg/kg,AUC0-t为1 855 μg∙min/mL,iv 1 mg/kg,AUC0-t为2 810 μg∙min/mL,据此其口服生物利用度为11%。Bi等[56, 57, 58]分别用LC-MS法测定大鼠po泽泻醇提物后血浆中泽泻醇A、泽泻醇A 24-乙酸酯和泽泻醇B 23-乙酸酯的浓度,采用大鼠肝微粒体作为体外模型研究泽泻醇A的代谢产物。大鼠po 18 g/kg(以原药计算)的泽泻醇提物后,泽泻醇A t1/2为3.1 h、Cmax为476.1 μg/L,泽泻醇A 24-乙酸酯t1/2为2.9 h、Cmax为233.1 μg/L;po 25 g/kg(以原药计算)的泽泻醇提物后,泽泻醇A t1/2为9.3 h、Cmax达到192.2 μg/L,泽泻醇B 23-乙酸酯t1/2为8.4 h、Cmax达到427.7 μg/L。体外代谢研究结果显示,经细胞色素P450酶代谢,泽泻醇A在大鼠肝微粒体内被代谢成3个氧化产物,在人肝微粒体内被氧化成6个代谢产物。
7 结语本文综述了泽泻调血脂活性成分及其药理、临床应用及安全性的研究进展,重点梳理了其调血脂药效和抗动脉粥样硬化可能的作用机制,从已有的研究结果中可以证明泽泻的调血脂效用。
泽泻提取物在整体动物上的安全性良好,在细胞水平实验发现泽泻醇C和16,23-环氧泽泻醇B以及泽泻醇O可能会引起肾毒性,因此在新药研究时应针对性除去以上3种成分,控制成品中的残留量,以提高安全性。且仍需从分子水平、细胞水平以及整体动物水平来揭示泽泻提取物发挥调血脂、抗动脉粥样硬化的作用机制,为新药开发和临床指导用药提供依据。
Nature杂志将胆固醇抑制药物列为2015年十大受关注的研究方向之一[59],开发泽泻的调血脂新药应是今后的发展方向。
| [1] | 马继兴. 神农本草经辑注[M]. 北京: 人民卫生出版社, 1995. |
| [2] | 中国药典[S]. 2010. 一部. |
| [3] | 陈士林. 中国药材产地生态适宜性区划[M]. 北京: 科学出版社, 2011. |
| [4] | 江西省第一人民医院泽泻研究小组. 泽泻治疗高脂血症的疗效观察[J]. 新医药学杂志, 1975, 79(2): 29-31. |
| [5] | 上海第一医学院中山医院. 泽泻浸膏片治疗高脂血症初步疗效观察[J]. 中华医学杂志, 1976, 56(11): 693-694. |
| [6] | 江苏省中医研究所冠心病组. 泽泻对血清总胆固醇、甘油三酯及高密度脂蛋白-胆固醇作用初步临床观察[J]. 南京中医学院科研资料选编, 1980, 1(1): 38-42. |
| [7] | 浙江省泽泻研究组. 泽泻降血脂的临床研究[J]. 中草药通讯, 1976, 7(7): 31-33. |
| [8] | Tadakazu M, Yoshio M, Takeo H, et al. Biological-active triterpenes of Alismatis Rhizoma I. Isolation of the alisols[J]. Chem Pharm Bull, 1970, 18(7): 1347-1353. |
| [9] | Chen D Q, Feng Y L, Tian T, et al. Diuretic and anti-diuretic activities of fractions of Alismatis Rhizoma[J]. J Ethnopharmacol, 2014, 157(1): 114-118. |
| [10] | 曹正国, 刘继红, 吴继洲, 等. 泽泻不同溶剂提取物对大鼠草酸钙结石形成的影响[J]. 中草药, 2003, 34(1): 45-48. |
| [11] | 耿小茵, 赖 真, 石之嶙, 等. 猪苓汤及泽泻对肾结石大鼠草酸钙结晶形成的影响[J]. 中国中医药信息杂志, 2004, 11(6): 497-498. |
| [12] | 曹正国, 刘继红, 尹春萍, 等. 泽泻活性成分对肾结石模型大鼠bikunin表达的影响[J]. 中国现代医学杂志, 2006, 16(11): 1601-1605. |
| [13] | Li Q, Qu H B. Study on the hypoglycemic activities and metabolism of alcohol extract of Alismatis Rhizoma[J]. Fitoterapia, 2012, 83(16): 1046-1053. |
| [14] | 杨新波, 黄正明, 曹文斌, 等. 泽泻水提取对正常及高血糖小鼠血糖的影响[J]. 中药药理学与临床, 1998, 14(6): 29-30. |
| [15] | 杨新波, 黄正明, 曹文斌, 等. 泽泻提取物对链脲佐菌素高血糖小鼠的治疗和保护作用[J]. 解放军药学学报, 2002, 18(6): 336-338. |
| [16] | 杨新波, 黄正明, 曹文斌, 等. 泽泻提取物对正常及四氧嘧啶小鼠糖尿病模型的影响[J]. 中国实验方剂学杂志, 2002, 8(3): 24-26. |
| [17] | Kim N Y, Kang T H, Pae H O, et al. In vitro inducible nitric oxide synthesis inhibitors from alismatis rhizoma[J]. Biol Pharm Bull, 1999, 22(10): 1147-1149. |
| [18] | Chang W H, Min J K, Kyun H K, et al. Ethanol extrct of alismatis rhizoma reduces acute lung inflammation by suppressing NF-κB and activating Nrf2[J]. J Ethnopharmacol, 2013, 146(1): 402-410. |
| [19] | Zhang Q, Jiang Z Y, Luo J, et al. Anti-HBV agents. part 1: Synthesis of alisol A derivatives: A new class of hepatitis B virus inhibitors[J]. Bioorg Med Chem Lett, 2008, 18(16): 4647-4650. |
| [20] | Zhang Q, Jiang Z Y, Luo J, et al. Anti-HBV agents. part 2: Synthesis and in vitro anti-hepatitis B virus activities of alisol A derivatives[J]. Bioorg Med Chem Lett, 2009, 19(8): 2148-2153. |
| [21] | Lee S, Kho Y, Min B, et al. Cytotoxic triterpenoides from alismatis rhizoma[J]. Arch Pharm Res, 2001, 24(6): 524-526. |
| [22] | Lee S M, Min B S, Bae K H. Chemical modification of alisol B 23-acetate and their cytotoxic activity[J]. Arch Pharm Res, 2002, 25(5): 608-612. |
| [23] | Huang Y T, Huang D M, Chueh S C, et al. Alisol B acetate, a triterpene from Alismatis Rhizoma, induces Bax nuclear translocation and apoptosis in human hormone-resistant prostate cancer PC-3 cells[J]. Cancer Lett, 2006, 231(2): 270-278. |
| [24] | 马 兵, 项 阳, 李 涛, 等. 泽泻对Lewis肺癌自发性转移的抑制作用及其机制研究[J]. 中草药, 2003, 34(8): 743-746. |
| [25] | 小林忠之. 泽泻抗脂肪肝成分的分离[J]. 药学杂志, 1960, 80(10): 1456-1459. |
| [26] | 龚树生, 张建军, 曹广智, 等. 泽泻的历史及生物活性成分研究进展 (续完)[J]. 山西中医学院学报, 2000, 1(3): 25-28. |
| [27] | Tomoda M, Gonda R, Shimizu N, et al. Charaterization of an acidic polysaccharide having immunological activities from the tuber of Alisma orientale[J]. Biol Pharm Bull, 1994, 17(5): 572-576. |
| [28] | Shimizu N, Ohtsu S, Tomoda M, et al. A glucan with immunological activities from the tuber of alisma orientale[J]. Biol Pharm Bull, 1994, 17(12): 1666-1668. |
| [29] | Tian T, Chen H, Zhao Y Y. Traditional uses, phytochemistry, pharmacology, toxicology and quality control of Alisma orientale (Sam.) Juzep: A review[J]. J Ethnopharmacol, 2014, 158 (Part A): 373-387. |
| [30] | 朱玉岚, 彭国平. 泽泻的萜类化学成分研究进展[J]. 天然产物研究与开发, 2006, 18(2): 348-351. |
| [31] | Kazuhide K, Tadakazu M, Masao N. Biological-active triterpenes of Alismatis Rhizoma III. the X-ray crystallography of alisol A (23,24)-acetonide 11-monobromoacetate[J]. Chem Pharm Bull, 1970, 18(7): 1362-1368. |
| [32] | Imai Y, Matsumura H, Aramaki Y. Hypocholesterolemic effect of alisol A-24-monoacetate and its related compounds in rats[J]. Jpn J Pharmacol, 1970, 20(2): 222-228. |
| [33] | Imai Y, Matsumura H. Effect of alisol A 24-monoacetate on the intestinal absorption of cholesterol and fatty acids in rats[J]. J Takeda Res Lab, 1970, 29(3): 462-466. |
| [34] | Yoshikawa M, Hatakeyama S, Tanaka N, et al. Crude drugs from aquatic plants. II. On the constituents of the rhizome of Alisma orientale Juzep. originating from Japan, Taiwan, and China. Absolute stereostructures of 11-deoxyalisols B and B 23-acetate[J]. Chem Pharm Bull, 1993, 41(12): 2109-2112. |
| [35] | Nakajima Y, Satoh Y, Katsumata M, et al. Terpenoids of Alisma orientale rhizome and the crude drug Alismatis Rhizoma[J]. Phytochemisty, 1994, 36(1): 119-127. |
| [36] | Murata T, Shinohara M, Hirata T, et al. New triterpenes of Alisma plantago-aquatica var. orientale Samuels.[J]. Tetrahedron Lett, 1968, 9: 103-108. |
| [37] | 彭国平, 朱国元, 楼凤昌. 泽泻中二个三萜新成分的研究II[J]. 天然产物研究与开发, 2002, 14(4): 5-8. |
| [38] | Lin H R. Triterpenes from Alisma orientalis act as farnesoid X receptor agonists[J]. Bioorg Med Chem Lett, 2012, 22(14): 4787-4792. |
| [39] | Murata T, Shinohara M, Miyamoto M. Biological-active triterpenes of Alismatis Rhizoma IV. The structures of alisol B, alisol B monoacetate and alisol C monoacetate-some reactions of the α-hydroxy epoxide of the alisol B derivatives[J]. Chem Pharm Bull, 1970, 18(7): 1369-1384. |
| [40] | Makabel B, Zhao Y Y, Wang B, et al. Stability and structure studies on alisol A 24-acetate[J]. Chem Pharm Bull, 2008, 56(1): 41-45. |
| [41] | 浙江人民卫生实验院药物研究所. 泽泻降血脂的药理研究[J]. 中草药通讯, 1976, 7(7): 26-30. |
| [42] | 陶晋興, 吕 环, 张秋菊, 等. 泽泻抗动脉粥样硬化作用系列研究 (二)——泽泻对实验性大鼠、家兔的降血脂作用及抑制家兔动脉粥样硬化作用[J]. 北京中医学院学报, 1991, 14(6): 51-53. |
| [43] | 李淑子, 金久在, 张善玉, 等. 泽泻不同提取物对高脂血症小鼠血脂及脂质过氧化的影响[J]. 中国实用医药, 2008, 3(32): 7-9. |
| [44] | 张春海, 毛 缜, 马 丽, 等. 泽泻水提取物、醇提取物对小鼠脂代谢影响的比较[J]. 徐州师范大学学报: 自然科学报, 2005, 23(2): 68-70. |
| [45] | 秦建国, 王亚红, 梁晋普, 等. 泽泻萜类化合物对ApoE基因敲除动脉粥样硬化小鼠肝脏基底膜HSPG的调节作用[J]. 中华中医药学刊, 2007, 25(4): 696-698. |
| [46] | 张力华, 李开军, 薛存宽, 等. 泽泻提取物对高同型半胱氨酸血症兔氧化及氧化因子的影响[J]. 循化医学杂志, 2007, 17(3): 31-32. |
| [47] | Chen H W, Hsu M J, Chien C T, et al. Effect of alisol B acetate, a plant triterpene, on apoptosis in vascular smooth muscle cells and lymphocytes[J]. Eur J Pharmacol, 2001, 419(2): 127-138. |
| [48] | Matsuda H, Kageura T, Toguchida I, et al. Effects of sesquiterpenes and triterpenes from the rhizome of Alisma orientale on nitric oxide production in lipopolysaccharide-activated macrophages: absoblute stereostructures of alismaketone-B 23-acetate and -C 23-acetate[J]. Bioorg Med Chem Lett, 1999, 9(21): 3081-3086. |
| [49] | 陈小青, 虞维娜, 马中春, 等. 泽泻、葛根等6种中药提取物的急性毒性效应观察[J]. 浙江中医杂志, 2011, 46(11): 848-849. |
| [50] | 段雪英, 王军波, 尹喜玲, 等. 泽泻60天大鼠喂养试验研究[J]. 中国食品卫生杂志, 2004, 16(2): 108-111. |
| [51] | Huang M Q, Xu W, Wu S S, et al. A 90-day subchronic oral toxicity study of triterpene-enriched extract from Alismatis Rhizoma in rats[J]. Food Chem Toxicol, 2013, 58(8): 318-323. |
| [52] | 祝建辉, 鲍晓荣, 何华平, 等. 泽泻肾毒性研究[J]. 中药药理与临床, 2007, 23(3): 60-62. |
| [53] | 赵筱萍, 陆 琳, 张玉峰, 等. 泽泻中肾毒性成分的辨析研究[J]. 中国中药杂志, 2011, 36(6): 758-761. |
| [54] | 吴启南, 王立新, 张 桥. 24-乙酰泽泻醇A、23-乙酰泽泻醇B药动学初步研究[J]. 湖南中医药大学学报, 2007, 27(8): 308-310. |
| [55] | 罗永东, 李小艳, 邱丽莉, 等. 23-乙酰泽泻醇B大鼠体内药动学和生物利用度研究[J]. 中国实验方剂学杂志, 2010, 16(12): 172-175. |
| [56] | Yu Y, Li Q, Bi, K S, et al. A sensitive liquid chromatography-mass spectrometry method for simultaneous determination of alisol A and alisol A 24-acetate from Alisma orientale (Sam.) Juz. in rat plasma[J]. Anal Bioanal Chem, 2011, 399(3): 1363-1369. |
| [57] | Zhang Y W, Li Q, Lv C X, et al. A UFLC/MS/MS method for simultaneous quantitation of alisol A and alisol B 23-acetate from Alisma orientale (Sam.) Juz. in rat plasma[J]. Asian J Pharm Sci, 2014, 9(5): 279-285. |
| [58] | Yu Y, Liu Z Z, Ju P, et al. In vitro metabolism of alisol A and its metabolites' identification using high-performance liquid chromatography-mass spectrometry[J]. J Chromatogr B, 2013, 941(1): 31-37. |
| [59] | Gibney E. What to expect in 2015. Nature looks at what the new year holds for science[J]. Nature, 2015, 517(7532): 10-11. |
 2015, Vol. 46
2015, Vol. 46



