中药复方是遵循中医“辨证论治”的基本原则,按照中药配伍规则,将2味或2味以上的中药按一定剂量组合而成的药物形式,是中药治疗、预防与保健的主要形式。从系统科学的角度观察,中药复方是在药材饮片水平上,由若干单味药构成的整体系统。
随着中药化学研究的深入,发现每个单味中药都含有少则十几个、多则上百个化学成分,所以从化学分子的角度看,中药复方是由上百个,甚至上万个化学分子构成的复杂体系。然而,不可能每个化学成分都是中药复方的有效成分。所以目前中药化学采用了西方的天然药物化学的研究方法,对中药进行化学成分分离、结构鉴定、活性测试,试图寻找到中药的活性单体成分,可是经过近一百年的努力,仅有如青蒿素等少数成功的例子。中药的活性物质基础研究仍然需要从研究思路和方法上进行探索。
中药有效成分组(effective compounds group)是近年来提出的中药药效物质基础研究的新对象,其概念与“组分中药”相当,具有药效化学物质基础基本清楚、质量可控性强、作用机制较明确等特点[1];相比单一活性成分,其在一定程度上保持了中药多成分、多靶点的基本特点,在理论上其能较好地阐明中药物质基础,在一定程度上代替中药复方。然而因中药的复杂性,目前对其研究成功的案例仍然较少,所以本文拟从概念、基本性质、研究方法等方面总结分析近年来对中药有效成分组的成功研究案例,为今后的中药有效成分组研究提供思路。
1 中药复方有效成分组的概念2002年,杜冠华[2]率先提出了中药有效成分组的概念,认为“中药有效成分组是指中药复方中所含有的所有与该复方临床应用目的密切相关的药理活性成分”。李忠红等[3]将其展开为中药复方发挥疗效的“多种成分,这些成分可能属于不同的化学类型,也可以是不同的作用机制的物质,它们通过不同途径实现协同作用,达到治疗疾病的目的”,从化学、药理作用说明了中药有效成分组多成分、多靶点的特点。张家玮等[4]提出的概念中强调了中药有效成分组“既不同于中药有效部位、有效组分或有效成分,也不是组成复方的各单味药中有效成分的简单加和”的特点。宋芳娇等[5]除了延续了杜冠华的概念外,认为其是中药复方制剂质量控制的基本对象。综上所述,目前对于中药有效成分组的概念认识基本一致,是指中药复方中所含有的所有与该复方临床应用目的密切相关的药理活性成分,是中药复方系统中起核心作用的一个子系统,在一定程度上可以代替中药复方的简化系统。
2 中药复方有效成分组的性质为了对中药复方有效成分组进行深入的研究,需要对其基本性质进行整理。因为有效成分组是中药复方化学成分组的核心子系统,所以应该具备中药复方化学成分组的基本性质,可以概括为以下3个方面。
2.1 具有多成分组合的特点中药复方由多味中药组成1个系统,每味中药含有数十种化学成分,所以1个中药复方应该含有成百上千的成分,这是中药复方多成分的特点,也是中药与单一有效成分的化学药最大的不同点。中药有效成分组应该保持这个基本特点,即“中药有效成分组应该由2个或2个以上的化学成分组成的系统,保持中药复方多成分的特点”。
2.2 具有系统整体性中药复方配伍需要按照“君、臣、佐、使”的中药配伍理论进行,通过“七情”关系,相互作用,发挥方剂整体的功效;该功效并非单味药功效的简单叠加,而是将单味药功效取长补短,组合而成,这说明中药复方是一个完整的系统整体。作为替代中药复方的有效成分组,应该遵循中药复方配伍的基本思想,保持其系统完整性,具体体现为多个成分在多个靶点间的相互作用。
2.3 化学成分明确中药复方是以单味药为要素单位组成的系统,然而因为单味药多为天然产物,受化学成分多而复杂、来源复杂等因素影响,其具体起效的活性成分难以确定,成为中药质量控制、作用机制等研究的障碍。
中药复方有效成分组是以化学成分为要素单位组成的系统,其化学成分数目有限,成分的化学结构明确,符合现代科学对药物化学本质的认识。
3 有效成分组的构建方法在以往的研究中,大都是以天然药物化学的方法将中药复方的成分分解成了单体化合物,破坏了复方的系统整体性。在中药有效成分组的研究中,首要的关键问题是构建有效成分组。这需要在分子水平重新构建新的系统,并且能够体现出与原复方相似的多成分、多靶点的整体性和系统性。如何合理、可行地构建并表征有效成分组,是一个创造性的研究,也具有十分大的难度。至今为止,完整成功的 案例较少,本文对有效成分组的构建过程进行总结、整理、分析,以期为今后的研究探明道路。
3.1 基于化学成分中药药性辨析的拆方-组方研究拆方研究是较早提出的方法,基本思路是逐步减去复方中一味中药或几味中药以观察疗效变化,逐渐缩小研究范围,最终搞清楚哪味药是必须保留的,从中再去寻找有效成分,实验设计可以采用正交设计等方法[6]。然而这种方法不仅实验设计较为繁琐,组数偏多,而且主要是在药材水平进行组合[7],达不到有效成分组分子水平的要求。部分方剂做到了药材的有效部位层次,如补阳还五汤[8]、双龙方等[9],然而有效部位依然是多个化学成分的混合物,要弄清所有成分也很困难,在组方过程中取舍依据的合理性也受到很多挑战。
北京中医药大学王庆国课题组采用拆方-组方的方法,对清开灵注射液进行二次开发,研制了仅由栀子苷、黄芩苷、胆酸、珍珠母4种高纯度单体化合物组合而成的“精制清开灵注射液”,实现了中药有效成分组的构建[10]。研制过程中,首先根据清开灵注射液临床应用,确定二次开发的主治病症为脑血栓形成急性期。然后在兼顾中医证候特点的同时,选择国际公认的大鼠大脑中动脉栓塞模型,以及脑梗死体积、神经功能评分和血清炎症因子MCP-l、COX-2等几个药效学指标,从脑梗死终点结局和炎症反应角度评价药效。通过拆方实验,筛选得到黄芩、栀子等关键单味药,其中黄芩的有效成分包括黄芩苷元、黄芩苷、汉黄芩素、汉黄芩苷等主要化学成分;再从药效学、药动学或药物化学等角度,通过实验或文献研究的方法,发现其多种成分均有一定的脑保护作用,故选择其中最具代表性的、研究最广泛、作用机制相对清楚的黄芩苷作为精制清开灵成分之一。按这样的思路进行了精制清开灵的组成要素筛选(图1)。
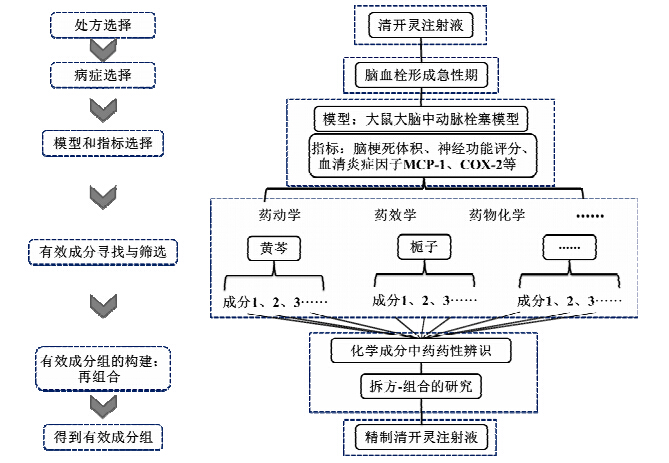 | 图 1 基于化学成分中药药性辨析的精制清开灵拆方-组方研究Fig.1Decomposed-combined recipes research on Jingzhi Qingkailing Injection based on medicinal discrimination of chemical constituent properties in CMM |
清开灵注射液的二次开发,确定了主治病症的药效物质基础,不仅使适应症更加明确,更重要的是实现了质量可控性并提高了药物开发安全性,从而达到精简方剂的目的。在重组有效成分组的过程中,不仅采用拆方研究,还同时综合中药药性研究,减少不必要的工作量,并在较短时间内找到明确的药效物质基础[12]。其中,对于单体有效成分的中药药性的认识十分重要。这类工作早在名医张锡纯的《医学衷中参西录》就已记载,如对石膏阿司匹林汤中的阿司匹林,认为其“味酸性寒,最善达表”,实现了对化学药的中医认识。在近年的研究中,陆茵等[13]将其概况为“组分的中药药性”,对化学成分药性判别方法实践的还有盛良[14, 15]、邓家刚等[16]、Zhang等[17]、张亚超等[18]提出的“基于性-构关系的药性规律研究”,周密和王耘等[19, 20]利用数据挖掘技术总结成分药性,肖小河等[21]利用微量量热法和冷热板示差法研究成分的寒热药性问题等。然而,如何将中药成分的药性判别回归到生物效应,特别是临床效应模型上,不论在方法技术上,还是政策、行业认可上,都还需要艰苦的摸索。
3.2 基于色谱指纹图谱“敲入、敲出”思想的有效成分组筛选基于色谱“敲入、敲出”思想的有效成分组筛选方法是肖小河源于功能性基因方法所提出的中药药效物质辨识与质量评控方法[22]。“成分敲出”是指筛选和确定中药的主要有效成分及可能的协同和拮抗成分,“成分敲入”是指确定最低有效剂量和可能的最大安全剂量。该方法首先应用于药材的研究中,如对黄连[23, 24]和牛黄[25, 26]的抗菌有效成分和质量控制进行研究。该研究过程如图2所示,首先是建立微生物抑菌的生物活性评价模型,采用热量法评价;然后将提取物用p-TLC展开得到p-TLC的指纹图谱,接着将主要成分进行“敲出”,得到敲出化合物组(M+)和剩余成分组(M-),敲出成分使用UPLC-ELSD或UPLC-MS进行结构鉴定;之后将M+组、M-组与原药材组进行药效学对比考察,确定M+化合物是否是有效成分,以及该化合物与剩余成分之间是否存在相互作用;然后再将M+按浓度梯度“敲入”M-中,寻找该有效成分起效的浓度范围;最后,将各个有效组分按照最佳浓度或者叠加与协同增效效应模型进行配比,验证其活性,选择优者,形成“组分中药”。
 | 图 2 基于色谱指纹图谱“敲入、敲出”的黄连有效成分组筛选Fig.2 Screening of effective components groups in Coptidis Rhizoma based on knock-in and knock-out strategy |
类似成功的研究还有李萍教授课题组开展的复方丹参滴丸有效成分组的寻找与生物等效性评价研究[27]。通过一系列实验,最终得出一个由18个化合物组成的、占原复方15%的有效成分组,在细胞模型和大鼠心肌梗死模型中与原复方具有同样疗效。具体筛选过程(图3):(1)建立复方丹参滴丸HPLC-MS指纹图谱,并对其中36个化合物进行结构鉴定;(2)建立与心肌梗死相关的3个细胞模型和评价体系;(3)以指纹图谱中峰面积的大小为标准,利用制备型HPLC和LEAP实时捕获收集系统,多次循环收集组分,得到了单峰峰面积分别占指纹图谱总峰面积≥10%的候选组(M+,仅含有1个成分),以及对应的不含候选组成分的剩余部分组(M-);(4)利用细胞模型,将M+、M-与原复方比较,进行生物等效性评价,若M+等效90%的置信区间在70%~143%,就说明其等效;若不等效,则扩大候选组范围;(5)按以上思路循环推进,依次制备≥1%、≥0.1%的2个候选 图3 基于色谱指纹图谱“敲入、敲出”的复方丹参滴丸有效成分组筛选 Fig.3 Screening of effective components group in Fufang Danshen Dropping Pills based on knock-in and knock-out strategy 组,通过细胞模型等效性评价后,发现候选组3(单峰面积≥0.1%的18个化合物组合)与原复方生物等效;(6)设计体内实验,用大鼠心肌梗死模型对候选组3做进一步验证,与原复方、原复方中除去候选组3后的M-、候选组3的18个化合物的对照品混合物组合进行比较,说明候选组3与原复方生物等效,并从反面说明M-无效;(7)为了验证候选组3中每个成分的必不可少性,分别对组合中的酚酸、皂苷和丹参酮进行移除,结果证明,移除后的组合与原药材没有生物等效性,所以证明候选组3的中药有效成分组是复方丹参滴丸里的药效物质基础。
 | 图 3 基于色谱指纹图谱“ 敲入、 敲出” 的复方丹参滴丸有效成分组筛选Fig.3 Screening of effective components group in Fufang Danshen Dropping Pills based on knock-in and knock-out strategy |
这2项工作均证明了有效成分组的有效性,还从另一个方面证明了阴性组分没有活性,以及筛选出来的有效成分组的整体性,较好地实现了有效成分组的筛选和构建。同时,也注意到了2个研究中,初步筛选模型均为细菌或细胞模型,这主要是色谱敲出的样品量少的缘故。另外,选择成分是优先选择量高的主要成分,进而证明主要成分是有效成分,过程需要多次循环,如何提高效率,需要进一步摸索。
3.3 基于中药血清药物化学的有效成分组研究中药血清药物化学方法是一种体内筛选方法,其核心思想是入血成分可能是中药有效成分。自2003年以来,王喜军对其进行了较为系统的研究,利用该方法对几十个中药复方或药材进行了有效成分研究,特别是对茵陈蒿汤的研究中,构建了由6,7-二甲基香豆素、京尼平苷和大黄酸3个成分组成的新组方,替代原复方治疗湿热黄疸证[28]。具体研究过程(图4):(1)建立茵陈蒿汤UPLC-UV-MS指纹图谱,鉴定45个成分;(2)给大鼠ig复方,采集血浆并制备样品,采用相同条件的指纹图谱条件,对比体内外成分,得到有21个血中移行成分,包括19个原型成分和2个代谢产物,并鉴定了其中19个成分;(3)根据“易 图4 基于血清药物化学的茵陈蒿汤有效成分组筛选 Fig.4 Screening of effective components groups in Yinchenhao Decoction based on serum pharmacochemistry 于检测,吸收快,消除慢,具有较高血药浓度并能维持较长平台期”为标准,在21个峰中有3个行为较好峰,其分别是来源于君药(茵陈)、臣药(栀子)、佐药(大黄)中的6,7-二甲基香豆素、京尼平苷和大黄酸;(4)在此后的研究中,以此3种成分为标记成分,按照3个一组或两两一组或单独成组的研究方法,分别将其与原复方进行药动学和药效学研究,包括对四氯化碳、α-异硫氰酸萘酯(ANIT)、乙醇和D-氨基半乳糖诱导的大鼠急性肝损伤保护作用的药效学研究和代谢组研究,以及有效成分组和原复方在正常大鼠和四氯化碳肝损伤模型大鼠体内的药动学实验对比研究,发现3个药物之间的相互作用明显提高了主要药效成分6,7-二甲基香豆素的生物利用度,减慢了其在体内的消除速度,延长了滞留时间;在肝保护作用再组合研究中,3个成分组合效果明显优于两成分组及单成分组,两成分组中6,7-二甲基香豆素+大黄酸优于另外两组,单成分中6,7-二甲基香豆素最优,三者相须为伍、相使为用,从而确定了3个化合物构成的有效成分组。
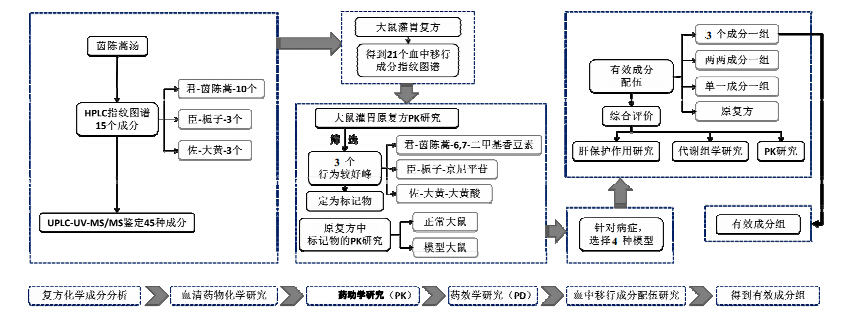 | 图 4 基于血清药物化学的茵陈蒿汤有效成分组筛选Fig.4 Screening of effective components groups in Yinchenhao Decoction based on serum pharmacochemistry |
基于血清药物化学进行中药有效成分组的筛选有一定的优势,主要因为这 是根据中药成分的药代性质进行的筛选,所得成分至少都是可以吸收入血的化合物,生物药剂学性质较好;而约80%入血成分具有活性,药效性质较好[29];另外,一次筛选就可以得到入血成分组,可以成为有效成分组的模板,使之组合和优化更加合理。然而,这种方法对于不入血发挥药效的化学成分不适用。
4 中药复方有效成分组的性质表征根据上述总结和分析表明,适当的中药有效成分组需要较好地表征“多成分组合”“化学成分明确”和“系统整体性”3个方面的性质。
4.1 多成分组合性质的表征实现了2个或以上成分的有效成分组合是构建中药有效成分组的充分必要条件。如有效成分组构建成功,则该特征就可明确体现。
4.2 化学成分明确性质的表征寻找到恰当的有效成分后,才能构建有效成分组;所以,成功构建有效成分组后,化学成分自然可以明确。
4.3 系统整体性的表征对于有效成分组的整体性表征可以从以下方面进行体现:(1)多靶点作用;(2)整体表征成分组的药效或药动学作用;(3)组合中的成分间有相互作用。
中药复方多靶点的表征主要是选取一系列和主治病症相关的模型,进行多个指标的检测,如Zhang等[30]研究砒霜对急性早幼粒细胞白血病作用的研究中,使用了BCR/ABL-阳性小鼠模型及蛋白质和磷酸化的动态变化、K562细胞的转录情况等指标联合观测,系统研究了多靶点的特征。在复方丹参滴丸的研究中,也选择了与冠心病密切相关的氧化型低密度脂蛋白(Ox-LDL)介导的人脐静脉内皮细胞(HUVEC)损伤模型、脂多糖(LPS)刺激的原RAW 264.7巨噬细胞炎症模型和模拟缺血(SI)诱导的H9c2心肌细胞损伤模型3个相关病症的细胞模型进行体内生物等效性评价[27]。
基因组和代谢组是用于表征多靶点、整体性的有效方法。如在精制清开灵的研究中,通过对373个相关基因的基因组学和主成分分析研究发现,基因数据显示5个主要成分可以解释原复方中超过95%的疗效[31];茵陈蒿汤研究中,通过代谢组的研究,包括能量代谢、糖代谢、氨基酸代谢、脂类代谢、蛋白质代谢以及核苷代谢,一同检测其对动物机体产生的系统影响。
药效学的评价还有从整体效应角度入手的评价,如对黄连的研究中,以抗菌作用为指标,使用微量热法为检测手段[23]。
而对整体药物动力学的评价现在主要的研究方式是“总量”药动学评价的方式,即将各个成分的统计矩参数如AUC、MRT,进行线性加和,表征整体的药动学情况,如王广基研究组提出的整体药动学研究的方法[32],贺福元等[33]提出了“网通虹势”的总量统计矩的药动学计算方法,岳鹏飞等[34]提出的“多维向量归一的中药总量药动学”法,张启云等[35]提出了“多效应成分分类整合药代动力学”的研究方法,它们是中药复杂体系药动力学研究的积极探索,但却忽略了各成分之间的相互作用,孤立地将各药动学参数进行简单的线性相加。所以,在未来的研究中,不满足叠加性和齐次性的非线性有效成分组系统必定成为重点关注的对象和研究方向。
5 结语中药复方是我国经过几千年实践经验与科学探索传承下来的无价瑰宝,若将目前现存的数以万计的古方,按其有效成分组的方式进行组合,不仅可以明确中药复方的药效物质基础,提升中药质量,更将可能带来新药研发数量爆炸式的增长和对于人体疾病系统的更深刻的认识。在这个过程中,需要发展和应用现代科学,特别是利用系统科学的知识和技术去揭示中药和人体疾病这2个复杂系统的相互作用,也需要政府、制药行业的鼓励和认可,给予宽松的政策和资金的支持,最终在临床上真实地检验中药有效成分组。
| [1] | 叶祖光. 中药复方与组分中药[J]. 新药研发论坛, 2011, 20(16): 1487-1489. |
| [2] | 杜冠华. 中药复方有效成分组学研究[J]. 中成药, 2002, 24(11): 878-880. |
| [3] | 李忠红, 倪坤仪. 中药复方有效成分研究进展[J]. 中成药, 2006, 28(1): 114-117. |
| [4] | 张家玮, 孙建宁, 张爱林. 有效成分组——中药复方活性物质基础研究方法[J]. 中国中医药信息杂志, 2006, 13(2): 4-5. |
| [5] | 宋芳娇, 曾克武, 王学美. 中药复方有效成分组相关研究方法的研究进展[J]. 环球中医药, 2012, 5(12): 951-955. |
| [6] | 何祥久, 邱 峰, 姚新生. 中药复方研究现状和思路[J]. 化学进展, 2001, 13(6): 481-485. |
| [7] | 毛晓健, 原 雪, 卢桂萍, 等. 红袍胃安主要药效学的拆方研究[J]. 时珍国医国药, 2009, 20(9): 2382-2384. |
| [8] | 刘旺华, 张秋雁, 李 花, 等. 补阳还五汤有效成分部位对大鼠脑缺血后白细胞浸润的影响[J]. 湖南中医学院学报, 2003, 23(6): 1-3. |
| [9] | 范雪梅, 李 雪, 梁琼麟, 等. 双龙方组分诱导大鼠BMSCs分化的差异基因筛选及聚类分析[J]. 高等学校化学学报, 2009, 30(9): 1729-1732. |
| [10] | 李翼飞, 赵 琰, 屈会化, 等. 精制清开灵对高脂血症大鼠血脂的影响[J]. 北京中医药大学学报, 2013, 36(1): 38-41. |
| [11] | 程发峰, 王庆国. 浅谈名优中药二次开发的思路和途径[J]. 北京中医药大学学报, 2010, 33(5): 300-303. |
| [12] | 王春华, 宋艳丽. 浅谈中药成方制剂之间的配伍及合理应用对其疗效的影响[J]. 黑龙江中医药, 2007(3): 49-50. |
| [13] | 陶 丽, 陆 茵, 王爱云, 等. 试论组分中药的药性配伍[J]. 中草药, 2012, 43(11): 2107-2110. |
| [14] | 盛 良. 中药四气五味和化学成分的关系[J]. 现代中西医结合杂志, 2004, 13(21): 2804-2806. |
| [15] | 盛 良. 论中药四气五味的宏观化学成分说[J]. 上海中医药大学学报, 2008, 42(7): 63-67. |
| [16] | 邓家刚, 刘 进, 覃洁萍, 等. 20种活血化瘀中药提取物的红外光谱分析及其与药性相关性的初步探讨[J]. 光谱实验室, 2010, 27(2): 741-744. |
| [17] | Zhang Y L, Wang Y, Qiao Y J. Research on material base of TCM property based on pharmacophore[J]. World Sci Technol, 2009, 11(5): 735-738. |
| [18] | 张亚超, 李梦龙, 郭延芝, 等. 平性药有效成分与药性相关性研究[J]. 化学研究与应用, 2010, 22(1): 67-72. |
| [19] | 周 密, 王 耘, 乔延江. 利用数据挖掘方法预测中药缺失药性的初步研究[J]. 中国中医药信息杂志, 2008, 15(6): 93-94. |
| [20] | 王 耘, 李 江, 石宇峰, 等. 面向数据挖掘的中药药性与功效数据库的建立[J]. 中国中医药信息杂志, 2010, 17(9): 95-97. |
| [21] | 肖小河. 中药药性研究概论[J]. 中草药, 2008, 39(4): 481-484. |
| [22] | 肖小河, 鄢 丹, 袁海龙, 等. 基于成分敲除/敲入的中药药效组分辨识与质量控制模式的商建[J]. 中草药, 2009, 40(9): 1345-1348. |
| [23] | Yan D, Li J X, Xiong Y, et al. Promotion of quality standard of herbal medicine by constituent removing and adding[J]. Sci Rep, 2014, 4: 1-7. |
| [24] | 李俊贤. 基于成分敲出/敲入的中药 (黄连) 药效物质辨识和质量控制模式的研究[D]. 昆明: 昆明理工大学, 2013. |
| [25] | Kong W J, Wang J B, Zang Q C, et al. A novel “target constituent knock-out” strategy coupled with TLC, UPLC-ELSD and microcalorimetry for preliminary screening of antibacterial constituents in Calculus bovis[J]. J Chromatogr B, 2011, 879(30): 3565-3573. |
| [26] | 孔维军. 基于成分敲出/敲入的中药 (牛黄) 药效物质辨识和质量控制模式的初步研[D]. 成都: 成都中医药大学, 2011. |
| [27] | Liu P, Yang H, Long F, et al. Bioactive equivalence of combinatorial components identified in screening of an herbal medicine[J]. Pharm Res-Dordr, 2014, 31(7): 1788-1800. |
| [28] | 王喜军. 中药血清药物化学[M]. 北京: 科学出版社, 2010. |
| [29] | 黄财顺, 向 诚, 李宝才, 等. 基于中药血清药物化学的活性成分筛选的现状和问题[J]. 中草药, 2014, 45(20): 3099-3014. |
| [30] | Zhang Q Y, Mao J H, Liu P, et al. A systems biology understanding of the synergistic effects of arsenic sulfide and Imatinib in BCR/ABL-associated leukemia[J]. PNAS, 2009, 106(9): 3378-3383. |
| [31] | Li J, Wu R G, Meng F Y, et al. Synergism and rules from combination of baicalin, jasminoidin and desoxycholic acid in refined Qing Kai Ling for treat ischemic stroke mice model[J]. PLoS One, 2012, 7(9): 1-10. |
| [32] | 郝海平, 郑超湳, 王广基. 多组分、多靶点中药整体药代动力学研究的思考与探索[J]. 药学学报, 2009, 44(3): 270-275. |
| [33] | 贺福元, 罗杰英, 邓凯文. 中药复方动力学数学模型—总量统计矩法的研究[J]. 世界科学技术—中医药现代化, 2006, 8(6): 13-18. |
| [34] | 岳鹏飞, 吴 彬, 郑 琴, 等. 基于多组分多维向量归一的中药复方“总量”药动学评价模式的创新与思考[J]. 药物评价研究, 2011, 34(5): 335-338. |
| [35] | 张启云, 徐良辉, 李冰涛, 等. 复方葛根芩连汤多效应成分分类整合药代动力学研究[J]. 中国临床药理学与治疗学, 2011, 16(1): 51-56. |
 2015, Vol. 46
2015, Vol. 46


