2. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-based Drug Design and Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
糖尿病(diabetes)是一种与胰岛素的产生和作用异常相关、以高血糖症为主要特征的内分泌代谢疾病,主要包括1型和2型糖尿病。据最新数据统计,我国目前糖尿病患者人数已高达1.14亿,占全世界糖尿病患者总数的三分之一,成为全球糖尿病第一大国。调查报告显示,我国糖尿病人群以2型糖尿病为主,占糖尿病患者总数的90%以上[1]。以胰岛素相对缺乏和胰岛素抵抗为主的2型糖尿病最终会导致高血糖,长期的高血糖症状会引起一系列的慢性并发症,如足病(足部溃疡、感染和坏疽)、肾病(肾功能衰竭、尿毒症)、眼病(视网膜病变、模糊不清、失明)、脑病(脑血管病变)、心脏病、皮肤病、性病等。因此,糖尿病并发症是导致糖尿病患者死亡的主要因素。然而,当前药物的药效有限且有副作用,如腹泻、恶心、呕吐等胃肠道功能紊乱,乳酸性酸中毒,体质量增加、低血糖等,因此开发作用于2型糖尿病新靶点的药物成为国内外研究的热点[2]。众所周知,中药治疗糖尿病在我国有着悠久的历史,近年来国内外学者均立足于此,以期从作用温和、毒副作用小的天然植物提取物中,依据不同的靶点筛选和发现治疗2型糖尿病的活性成分,研发出专一性强、价格低廉、毒副作用小的天然药物。本文就2型糖尿病的新靶点及作用于靶点的天然产物进行综述。
1 2型糖尿病的新靶点近年来发现的2型糖尿病新靶点有蛋白酪氨酸磷酸酶1B(PTP1B)、二肽基肽酶IV(DPP-IV)、过氧化物酶体增殖活化受体(PPAR)和腺苷酸活化蛋白激酶(AMPK)等。
蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase,PTP1B)是蛋白酪氨酸磷酸酶(protein tyrosine phosphatases,PTPs)家族中的经典的非受体型酪氨酸磷酸酶,在胰岛素信号通路中起着重要的负调控作用,通过剔除PTP1B的大鼠实验表明,PTP1B通过对胰岛素受体的去磷酸化,进而在调节胰岛素敏感性和脂肪代谢过程中起着非常重要的作用,因而,其是目前公认的一个新颖的糖尿病和肥胖症治疗靶点。如图 1所示,胰岛素信号传导过程中,分泌到体液中的胰岛素先与胰岛素敏感细胞上的IRa亚基结合,胰岛素受体(IR)形成二聚体后,IRb亚基通过自磷酸化使得活性位点的酪氨酸被磷酸化,从而激活IRb亚基上蛋白酪氨酸激酶(protein tyrosine kinase,PTK)活性,然后含有SH2结构域的接头蛋白,如胰岛素受体底物(insulin receptor substrate,IRS)被招募到IR的SH2结合位点,随后磷脂酰肌醇3激酶(PI3K)被激活,接着下游糖代谢通路中的蛋白激酶B(PKB)、葡萄糖转运体4(GLUT4)进一步被激活,最后体内的糖脂代谢被启动。在信号传导过程中,蛋白酪氨酸磷酸化是一种重要的调节信号转导的翻译后修饰方式。在体内酪氨酸的磷酸化是可逆的动态过程,其中PTK负责磷酸化过程,蛋白酪氨酸磷酸酯酶(protein tyrosine phosphatase,PTP)负责去磷酸化过程。蛋白酪氨酸磷酸酯酶1B(PTP1B)是PTPs家族的一员,位于胞内的内质网上,可与受体型激酶IR相互作用,使其去磷酸化而失活,最终胰岛素信号被终止,从而糖脂代谢被终止。由此可见,在整个信号传导过程中PTP1B对IR的PTK酶活性起着重要的负调控作用。
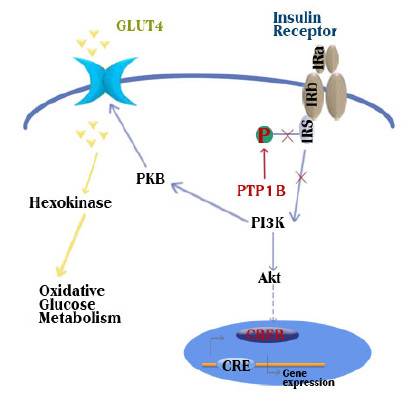 | 图 1 PTP1B对胰岛素信号通路负调控作用示意图Fig.1 Blocking effect of PTP1B on insulin signaling pathway |
二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)是一种多功能的跨膜丝氨酸蛋白酶,也称淋巴细胞表面蛋白CD26和腺苷脱氨基酶(ADA)[3],是DPPs家族成员之一。凡是N端倒数第2位具有脯氨酸或丙氨酸残基的微量蛋白或者寡肽均可被DPP-IV降解,在氨基末端水解出二肽,并在体内将其转化为无活性代谢产物[4]。目前在人体经过确证的DPP-IV底物有抑胃肽(GIP)和胰高血糖素样肽-1(GLP-1)。GLP-1作为DPP-IV的底物,半衰期很短,分泌后在1~2 min内就被DPP-IV迅速剪切、失活,甚至变为拮抗剂,不适于口服,在临床上,DPP-IV抑制剂比GLP-1类似物更有优势。DPP-IV抑制剂通过抑制DPP-IV,减少GLP-1的降解,增加GLP-1的血浆浓度,控制餐后血糖浓度。
过氧化物酶体增殖因子活化受体(peroxisome proliferator activatived receptor,PPAR)是配体激活的转录因子核受体超家族成员之一,主要通过直接加强脂肪细胞胰岛素受体后的信号传导过程,增强脂肪细胞对胰岛素的敏感性,从而达到降低血糖的目的,同时还具有减少炎症发生、降低游离脂肪酸的脂质浓度及降血压等作用。目前确认的PPARs成员有PPARα、PPARβ/δ、PPARγ。大量研究表明PPARγ能激活与脂肪细胞分化有关的基因,与2型糖尿病密切相关,因此,PPARγ激动剂是目前研究最多的激动剂。最近,人们针对PPARα/γ,PPARα/δ和PPARδ/γ双受体激动剂和PPARα/δ/γ激动剂也开展了研究。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种异源三聚体蛋白,由α、β和γ 3个亚基组成,其中α亚单位起催化作用,而β和γ亚单位起调节作用。其活性受单磷酸腺苷/三磷酸腺苷(AMP/ATP)值调控,被称为细胞的“代谢感受器”或调控细胞ATP和AMP水平的“燃料开关”[5]。黄德强等[6]研究证明AMPK对胰岛素有双向调节作用,能增强Akt(PI3K下游主要的效应物)活性和抑制mTOR(胰岛素的重要调节因子,属于PI3K相关家族成员),两方面的效果均有利于胰岛素的功能。有研究表明,治疗2型糖尿病的一线药物二甲双胍和罗格列酮对机体代谢的影响部分通过AMPK途径。因此,AMPK及其信号通路现已成为治疗肥胖和2型糖尿病的新靶点。
2 作用于2型糖尿病新靶点的天然产物 2.1 PTP1B抑制剂已发现的对PTP1B有抑制作用的天然产物有糖类、萜类、酚类、黄酮类、皂苷类等。2012年,Jiang等[7]总结了天然PTP1B抑制剂,并对其构效关系和某些化合物对其他蛋白磷酸酶的选择性进行了讨论。
2.1.1 糖类陈玲等[8]用酶标仪检测了不同浓度知母多糖溶液对PTP1B活性的抑制能力。经膜分离后发现相对分子质量在3×104~1×105的知母多糖组分对PTP1B活性的抑制率最高,达69.39%;而相对分子质量为1×104~3×104和相对分子质量>1×105的知母多糖组分对PTP1B活性的抑制率较低,分别为11.27%和6.46%。此外,采用苯酚-硫酸法测得相对分子质量介于3×104~1×105的知母多糖组分占总多糖的75%,说明知母多糖提取物中相对分子质量在3×104~1×105的多糖组分对抑制PTP1B活性起主要作用。进一步对这部分知母多糖组分进行葡聚糖凝胶G-100柱色谱,分离出2个组分(组分1、2的质量浓度分别为177和205 mg/mL),组分1对PTP1B活性的抑制率为73.81%,而组分2抑制能力相对较弱,仅为32.47%。由此可见,相对分子质量在3×104~1×105的知母多糖组分中相对分子质量相对较大的知母多糖对PTP1B活性的抑制能力较强。并且研究表明,知母多糖有可能通过抑制PTP1B的活性来提高外周组织对胰岛素的敏感性,从而达到治疗糖尿病的效果,作为天然PTP1B抑制剂具有良好的开发前景。
黄芪多糖(APS)是天然降糖活性物质。Mao等在前期研究[9, 10]的基础上研究APS的降糖作用,并探讨其体内外改善胰岛素抵抗的机制[11];并发现APS对PTP1B有抑制作用,IC50为7.50 μmol/L(阳性对照原钒酸钠IC50为10 μmol/L)[12]。Wang等[13]并进一步证明了APS通过抑制内质网应激诱导的激活转录因子6(ATF6)的活化,使PTP1B的合成减少,从而增加胰岛素敏感性,发挥降糖作用。
周平等[14]从灵芝的水提物中发现具有抑制PTP1B活性的蛋白多糖,其多糖与蛋白量比为77∶17,黏均相对分子质量2.6×105, IC50为(5.12±0.05)μg/mL,且对PTP1B具有竞争性抑制作用。体内ig给药显示,其药效与二甲双胍相当,对糖尿病的新药研发有着重要意义。
2.1.2 二萜类Cui等[15]在研究PTP1B抑制剂时发现,从南极地衣Huea sp. 中得到的新二萜呋喃型化合物hueafuranoid A对PTP1B具有抑制活性,IC50为13.9 μmol/L。动力学研究表明,其是以非竞争性的方式发挥作用。
Liang等[16]从中国南海圆盘肉芝软珊瑚Sarcophyton trocheliophorum Marenzeller中得到的6种已知的萜烯和5种新的西松烷二萜中寻找PTP1B抑制剂,发现sarcophytonolide N和sarcrassin E有很好的抑制活性(IC50分别为5.59和6.33 μmol/L);4Z,12Z,14E-sarcophytolide有较好的活性(IC50为15.4 μmol/L);松柏烯 C(cembrene C)和ketoemblide有较温和的活性(IC50分别为26.6和27.2 μmol/L)。
2.1.3 三萜类及皂苷类Choi等[17]从杜鹃花Rhododendron brachycarpum G. Don的叶中得到7种PTP1B抑制剂,分别为杜鹃花酸A(rhododendric acid A)、熊果酸(ursolic acid)、科罗索酸(corosolic acid)、救必应酸(rotundic acid)、2α,3α,23-三羟基熊果-12,20(30)-二烯-28-羧酸、23-羟基熊果酸(23- hydroxyursoli acid)和猕猴桃酸(actinidic acid),IC50分别为(6.3±0.6)、(3.1±0.3)、(7.0±0.6)、(20.1±1.4)、(17.4±1.0)、(7.4±0.6)、(18.0±0.9)μmol/L。Na等[18]通过构效关系研究,也得到相似结论,齐墩果烷型化合物的PTP1B抑制作用与C-3位上具有的羟基和C-27或28位上有羧基有关。
Xue等[19]从海南海绵Stelletta sp. 中分离得到的三萜类化合物stellettin G,显示有很强的PTP1B抑制活性,IC50为(4.1±0.9)μmol/L。
石雪萍等[20]从苦瓜中分离出5个皂苷类化合物,其中1个是甾体皂苷,其余4个为四环三萜葫芦烷皂苷。对这5个化合物进行PTP1B抑制活性筛选,其中α-菠甾醇-3-O-β-D-吡喃葡萄糖苷、19(R)-羰基-25-二甲氧基-5β-葫芦烷-6,23-二烯-3β,25-羟基- 5,19-环氧酯-3-O-β-D-吡喃葡萄糖苷、葫芦烷-5-烯- 3β,22,23,24,25-五羟基-3-O-3-β-D-吡喃葡萄糖基- (1→6)-D-吡喃葡萄糖苷(苦瓜素A,momordicoside A)对PTP1B有不同程度的抑制活性,其抑制率分别为24.0%、1.3%、16.4%。
Li等[21]从三七叶中获得一系列达玛烷型皂苷类化合物,其中化合物 (20S,23R)-3β-羟基-12β,23-环氧-达玛烷-24-烯-20-O-α-L-呋喃阿拉伯糖基-(1→ 6)-β-D-吡喃葡萄糖苷(notoginsenoside-LY)、20(R)-原人参二醇 [20(R)-protopanaxadiol]、20(R)-人参皂苷Rh2 [20(R)-ginsenoside-Rh2] 和20(S)-人参皂苷Mc [20(S)-ginsenoside-Mc] 对PTP1B有较好的抑制活性,并且呈剂量依赖性,IC50分别为29.08、21.27、28.12和26.59 μmol/L,说明三七叶可作为治疗糖尿病的潜在药物。
2.1.4 多酚类孙婧[22]以PTP1B为治疗2型糖尿病的靶点,通过体外筛选在厚朴制剂中找到对PTP1B有抑制作用的有效成分——和厚朴酚,IC50为(63.43±1.07)μmol/L。此外,较其他几种PTP抑制剂,和厚朴酚对PTP1B抑制效果具有很好的专一性。动力学分析表明,和厚朴酚对PTP1B的抑制类型为可逆的竞争性抑制。
Ma等[23]研究发现,烘干后的茶叶水提物对PTP1B表现出明显的抑制作用,IC50值为0.4~4 g/L。研究发现茶叶中的主要有效成分为氧化的多酚类化合物,即茶叶中的儿茶素经过酪氨酸酶氧化后成为PTP1B抑制剂。
2.1.5 黄酮类孙玉秀等[24]采用RT-PCR检测2型糖尿病大鼠肝脏PTP1B的表达时发现,模型组大鼠肝脏中PTP1B的表达明显升高,豹皮樟总黄酮(TFLC)治疗组PTP1B表达显著降低,阳性对照药二甲双胍(MET)组PTP1B的表达无明显改变。以上实验结果表明,TFLC可明显降低血糖和调节血脂,减轻肝脏组织的氧化应激,其改善胰岛素抵抗可能与其降低T2DM大鼠肝脏中PTP1B的表达、增强胰岛素信号通路有关。汪凌云[25]在TFLC治疗2型糖尿病的机制研究中不仅比较了肝脏组织的变化还观测了胰腺组织的胰岛面积变化和骨骼肌中PTP1B的表达,结果表明TFLC的降糖作用可能与其促进胰岛增生,减少胰腺的细胞凋亡,降低肝脏和骨骼肌中PTP1B mRNA和蛋白的表达,进而提高胰岛素的敏感性有关。
单杨[26]从柑橘皮中得到5种黄酮类化合物,发现5,6,7,8,3′,4′-六甲氧基黄酮(川陈皮素,nobiletin)对PTP1B有一定的抑制作用。
李建辉等[27]观察葛根素对大鼠肝脏中PTP1B表达的影响,发现葛根素能明显降低PTP1B的表达,与胰岛素抵抗组相比减少了32.8%(P<0.01),说明葛根素的干预能够改善机体的胰岛素抵抗,可能是与降低PTP1B蛋白表达有关。
2.1.6 生物碱类Ma等[28]从芸香科九里香属调料九里香Murraya koenigii (L.) Spreng中提取分离出具有PTP1B抑制作用的化合物mahanine、马汉九里香碱(mahanimbine)和8,8′-biskoenigine,IC50值分别为1.773、1.875和2.286 μmol/L。
2.1.7 脂肪酸类胡尔西丹·伊麻木等[29]研究了罗勒籽脂肪酸对PTP1B的抑制作用,结果表明罗勒籽脂肪酸对PTP1B有较强的抑制作用,其IC50为11.12 μg/mL。该研究为寻找治疗糖尿病的新药提供了参考。
2.1.8 其他类Liang等[30]从扁窦形短指软珊瑚Sinularia depressa Tixier-Durivault. 中分离出的类固醇化合物 (3β,4α,5α,8β)-4-甲基麦角甾-24(28)-烯- 8-醇-3-乙酸酯、(3β,4α,5α)-4-甲基麦角甾-24(28)-烯- 3-醇和麦角甾-4,24 (28)-二烯-3-酮,并发现这些化合物表现出PTP1B抑制活性,IC50分别为22.7、19.5和15.3 μmol/L。
2.2 AMPK激动剂 2.2.1 多酚类Hwang等[31]研究发现,绿茶多酚中的表没食子儿茶素没食子酸酯(EGCG)、辣椒多酚和染料木黄酮可以通过激活AMPK或AMPK-LKB1通路,降低体内脂类的合成、增强脂肪酸氧化、抑制脂肪细胞分化并促进其凋亡,从而发挥抗肥胖以及抗糖尿病的作用。
2.2.2 皂苷和三萜类顾剑[32]发现20-O-β-D-吡喃葡萄糖基-20(S)-原人参二醇(人参皂苷M1)通过AMPK-JNK-线粒体凋亡途径可以减少2型糖尿病小鼠胰岛细胞凋亡。陈旭冰[33]研究发现罗汉果中的三萜类葫芦素苷元能够激活AMPK信号传导通路,降低血糖。Tan等[34]从苦瓜中分离出的4个新葫芦烷苷momordicoside Q、R、S、T,在L6和3T3-L1脂肪细胞中可刺激GLUT4转运到细胞膜,通过增加AMPK活性来调解葡萄糖摄取和脂肪酸氧化。
此外,Nguyen等[35]发现绞股蓝中的2α,3β,12β-三羟基达玛烷-20(22)E,24-二烯-3-O-[β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖](damulin A)和2α,3β,12β-三羟基-达玛烷-20,24-二烯-3-O-[β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖](damulin B),在L6肌管细胞中能够通过刺激GLUT4致使L6肌管细胞质膜的转运,增加β-氧化和葡萄糖摄取,同时有显著的激活AMPK的作用。Cheng等[36]从苦瓜茎中获得3种三萜类化合物分别命名为CH10、CH63和CH93,并发现其能够通过激活AMPK来发挥降糖作用,其中CH10和CH93的激活效果更明显。Chang等[37]从野生变种苦瓜(WB24)中分离纯化得到3种三萜类化合物 (23E)-5β,19-环氧-葫芦烷-6,23-二烯-3β,25-二醇、5β,19-epoxy-25-methoxy- cucurbita-6,23-diene-3β,19-diol(EMCD)和5β,19-环氧-25-甲氧基-葫芦烷-6,23-二烯-3β,19-二醇,发现三者均可通过激活AMPK表现出明显的降糖活性,其中化合物EMCD的效果最显著。Cheng等[38]对EMCD进一步研究发现,EMCD不仅能激活AMPK,还能抑制肿瘤坏死因子-α(TNF-α)的表达,从而发挥降糖作用。
2.3 DPP-IV抑制剂目前,天然产物中DPP-IV抑制剂的研究鲜有报道。Bharti等[39]在栗豆树Castanospermum australe Cunn. 种子(CAS)的乙醇提取物中,发现了有抑制DPP-IV作用的组分,IC50值为13.96 μg/mL。通过分子模拟计算发现其中7-deoxy-6-epi- castanospermine的活性最好。Gallego等[40]在干腌火腿的水溶物中发现,肽KA和AAATP显示出较强的DPP-IV抑制活性,IC50值分别为6.27和6.47 mmol/L,二肽AA、GP、PL和肌肽以及肽AAAAG、ALGGA和LVSGM也显示较低程度的DPP-IV抑制活性。研究结果表明,西班牙干腌火腿有作为开发DPP-IV抑制剂的前体化合物的潜力,这些生物肽也可以用于针对2型糖尿病的功能性食品或医药品。
2.4 PPAR激动剂Gao等[41]研究发现人参皂苷Re在3T3-L1脂肪细胞中,通过直接增加PPARγ2及其应答基因、脂联素、胰岛素受体底物-1(IRS-1)和脂肪细胞型脂肪酸结合蛋白(Ap2蛋白)的表达,抑制TNF-α的产生及增加GLUT4转运来促进葡萄糖摄取和分配。
3 结语本文利用Science Direct和Pubmed数据库对近10年来治疗2型糖尿病的化合物进行了检索,共检索到111篇对2型糖尿病有治疗作用的新化合物,其中101篇文献中提到的化合物治疗糖尿病机制主要与抑制PTP1B活性有关;7篇报道的活性物质与激活AMPK有关;2篇文献中报道的治疗2型糖尿病活性物质的机制与抑制DPP-IV有关;1篇报道的活性物质与激活PPAR有关(图 2)。
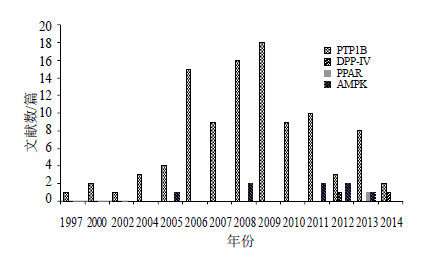 | 图 2 作用于2型糖尿病新靶点天然产物的文献比较Fig.2 Comparison on literature of natural products on new targets of type 2 diabetes |
目前已发现的PTP1B抑制剂中,黄酮类化合物有122个,溴酚类有17个,香豆素和木脂素类有17个,酚酸类18个,含有呋喃或吡喃环的酚类物质有30个,倍半萜类13个,二萜类25个,二倍半萜类4个,三萜类59个,甾体类9个,含N、S杂环的物质16个以及其他类有16个。同类的化合物之间IC50值差异较大,但溴酚类化合物的IC50值普遍较小。目前,已上市的2型糖尿病临床用药有各种局限性,而天然产物分子是经过选择性进化的,能够与生物大分子结合,表现出良好的活性。因此有必要在天然药物中发现新的、低毒的、更高效的具有靶点活性的化合物进行药效学研究,以阐明降糖机制,为研制出安全稳定、效果显著、毒副作用小、质量可控、服用方便的2型糖尿病新药奠定基础。
| [1] | Xu Y, Wang L M, He J, et al. Prevalence and control of diabetes in Chinese adults [J]. JAMA, 2013, 310(9): 948-958. |
| [2] | 刘永贵, 解学星, 吴 疆, 等. 治疗2型糖尿病的新靶点药物研究进展 [J]. 现代药物与临床, 2015, 30(2): 222-227. |
| [3] | Engel M, Hoffmann T, Wagner L, et al. The crystal structure of dipeptidyl peptidase IV (CD26) reveals its functional regulation and enzymatic mechanism [J]. Proc Nat Acad Sci USA, 2003, 100(9): 5063-5068. |
| [4] | Baetta R, Corsini A. Pharmacology of dipeptidyl peptidase-4 inhibitors [J]. Drugs, 2011, 71(11): 1441-1467. |
| [5] | Schimmack G, Defronzo R A, Musi N. AMP-activated protein kinase: Role in metabolism and therapeutic implications [J]. Diabetes Obes Metab, 2006, 8(6): 591-602. |
| [6] | 黄德强, 罗凌玉, 王丽丽, 等. AMPK在胰岛素信号转导通路中的作用 [J]. 中国细胞生物学学报, 2011, 33(11): 1220-1229. |
| [7] | Jiang C S, Liang L F, GuoY W. Natural products possessing protein tyrosine phosphatase 1B (PTP1B) inhibitory activity found in the last decades [J]. Acta Pharm Sin, 2012, 33(10): 1217-1245. |
| [8] | 陈 玲, 曹诗林, 李炳辉, 等. 知母多糖提取物生物活性的研究 [J]. 辽宁中医杂志, 2013, 40(2): 309-312. |
| [9] | Grover J K, Yadav S, Vats V. Medicinal plants of India with anti-diabetic potential [J]. J Ethnopharmacol, 2002, 81(1): 81-100. |
| [10] | Wu Y, Ouyang J P, Wu K, et al. Hypoglycemic effect of Astragalus polysaccharide and its effect on PTP1B [J]. Acta Pharmacol Sin, 2005, 26(3): 345-352. |
| [11] | Mao X Q, Wu Y, Wu K, et al. Astragalus polysaccharide reduces hepatic endoplasmic reticulum stress and restores glucose homeostasis in a diabetic KKAy mouse model [J]. Acta Pharmacol Sin, 2007, 28(12): 1947-1956. |
| [12] | Mao X Q, Yu F, Wang N, et al. Hypoglycemic effect of polysaccharide enriched extract of Astragalus membranaceus in diet induced insulin resistant C57BL/6J mice and its potential mechanism [J]. Phytomedicine, 2009, 16(5): 416-425. |
| [13] | Wang N, Zhang D L, Mao X Q, et al. Astragalus polysaccharides decreased the expression of PTP1B through relieving ER stress induced activation of ATF6 in a rat model of type 2 diabetes [J]. Mol Cell Endocrinol, 2009, 307(1/2): 89-98. |
| [14] | 周 平, 王晨栋, 潘 登. 灵芝有效降糖提取物及其体内药效研究 [A] // 全国高分子学术论文报告会论文摘要集 [C]. 北京: 中国化学会, 2011. |
| [15] | Cui Y, Yim J H, Lee D S, et al. New diterpene furanoids from the Antarctic lichen Huea sp [J]. Bioorg Med Chem Lett, 2012, 22(24): 7393-7396. |
| [16] | Liang L F, Gao L X, Li J, et al. Cembrane diterpenoids from the soft coral Sarcophyton trocheliophorum Marenzeller as a new class of PTP1B inhibitors [J]. Bioor Med Chem, 2013, 21(17): 5076-5080. |
| [17] | Choi Y H, Zhou W, Oh J, et al. Rhododendric acid A, a new ursane-type PTP1B inhibitor from the endangered plant Rhododendron brachycarpum G. Don [J]. Bioorg Med Chem Lett, 2012, 22(19): 6116-6119. |
| [18] | Na M, Cui L, Min B S, et al. Protein tyrosine phosphatase 1B inhibitory activity of triterpenes isolated from Astilbe koreana [J]. Bioorg Med Chem Lett, 2006, 16(12): 3273-3276. |
| [19] | Xue D Q, Mao S C, Yu X Q, et al. Isomalabaricane triterpenes with potent protein-tyrosine phosphatase 1B (PTP1B) inhibition from the Hainan sponge Stelletta sp. [J]. Biochem Syst Ecol, 2013, 49: 101-106. |
| [20] | 石雪萍, 姚惠源, 张卫明. 苦瓜皂甙的分离以及PTP1B抑制活性 [J]. 陕西师范大学学报, 2008, 36(4): 63-71. |
| [21] | Li D W, Cao J Q, Bi X L, et al. New dammarane-type triterpenoids from the leaves of Panax notoginseng and their protein tyrosine phosphatase 1B inhibitory activity [J]. J Ginseng Res, 2014, 38(1): 28-33. |
| [22] | 孙 婧. 和厚朴酚对STZ诱导的2型糖尿病小鼠的降糖作用及机理研究 [D]. 长春: 吉林大学, 2013. |
| [23] | Ma J, Li Z, Xing S, et al. Tea contains potent inhibitors of tyrosine phosphatase PTP1B [J]. Biochem Biophy Res Commun, 2011, 407(1): 98-102. |
| [24] | 孙玉秀, 鲁云霞, 汪凌云, 等. 豹皮樟总黄酮降低2型糖尿病大鼠血糖的可能机制研究 [J]. 中国中西医结合杂志2010, 30(6): 617-621. |
| [25] | 汪凌云. 豹皮樟总黄酮治疗2型糖尿病大鼠模型的机制研究 [D]. 合肥: 安徽医科大学, 2011. |
| [26] | 单 杨. 柑橘类黄酮的分离、结构鉴定、化学修饰及生物活性研究 [D]. 长沙: 中南林业科技大学, 2007. |
| [27] | 李建辉, 张 群. 葛根素对胰岛素抵抗大鼠肝脏组织中蛋白酪氨酸磷酸酶1B表达的影响 [J]. 现代实用医学, 2011, 23(12): 1378-1380. |
| [28] | Ma Q, Tian J, Yang J, et al. Bioactive carbazole alkaloids from Murraya koenigii (L.) Spreng [J]. Fitoterapia, 2013, 87: 1-6. |
| [29] | 胡尔西丹·伊麻木, 马庆苓, 阿布力米提·伊力, 等. 罗勒籽脂肪酸及其对蛋白酪氨酸磷酸酯酶1B (PTP1B) 抑制作用的研究 [J]. 天然产物研究与开发, 2012, 24: 1261-1263. |
| [30] | Liang L F, Wang X J, Zhang H Y, et al. Bioactive polyhydroxylated steroids from the Hainan soft coral Sinularia depressa Tixier-Durivault [J]. Bioorg Med Chem Lett, 2013, 23(5): 1334-1337. |
| [31] | Hwang J T, Park I J, Shin J I, et al. Genistein, EGCG, and capsaicin inhibit adipocyte differentiation process via activating AMP-activated protein kinase [J]. Biochem Biophy Res Commun, 2005, 338(2): 694-699. |
| [32] | 顾 剑. 人参皂苷Compound K对2型糖尿病小鼠胰岛β细胞凋亡的保护作用及其机制研究 [D]. 长春: 吉林大学, 2013. |
| [33] | 陈旭冰. 两种葫芦科植物的三萜类化学成分研究 [D]. 上海: 华东理工大学, 2012. |
| [34] | Tan M J, Ye J M, Turner N, et al. Antidiabetic activities of triterpenoids isolated from Bitter Melon associated with activation of the AMPK pathway [J]. Chem Biol, 2008, 15(3): 263-273. |
| [35] | Nguyen P H, Gauhar R, Hwang S L, et al. New dammarane-type glucosides as potential activators of AMP-activated protein kinase (AMPK) from Gynostemma pentaphyllum [J]. Bioorg Med Chem, 2011, 19(21): 6254-6260. |
| [36] | Cheng H L, Huang H K, Chang C I, et al. A cell-based screening identifies compounds from the stem of Momordica charantia that overcome insulin resistance and activate AMP-activated protein kinase [J]. J Agric Food Chem, 2008, 56(16): 6835-6843. |
| [37] | Chang C I, Tseng H I, Liao Y W, et al. In vivo and in vitro studies to identify the hypoglycaemic constituents of Momordica charantia wild variant WB24 [J]. Food Chem, 2011, 125(2): 521-528. |
| [38] | Cheng H L, Kuo CY, Liao Y W, et al. EMCD, a hypoglycemic triterpene isolated from Momordica charantia wild variant, attenuates TNF-a-induced inflammation in FL83B cells in an AMP-activated protein kinase-independent manner [J]. Eur J Pharmacol, 2012, 689(1/3): 241-248. |
| [39] | Bharti S K, Krishnan S, Kumar A, et al. Antihyperglycemic activity with DPP-IV inhibition of alkaloids from seed extract of Castanospermum australe: Investigation by experimental validation and molecular docking [J]. Phytomedicine, 2012, 20(1): 24-31. |
| [40] | Gallego M, Aristoy M C, Toldrá F. Dipeptidyl peptidase IV inhibitory peptides generated in Spanish dry-cured ham [J]. Meat Sci, 2014, 96(2 Pt A): 757-761. |
| [41] | Gao Y, Yang M F, Su Y, et al. Ginsenoside Re reduces insulin resistance through activation of PPAR-γ pathway and inhibition of TNF-α production [J]. J Ethnopharmacol, 2013, 147(2): 509-516. |
 2015, Vol. 46
2015, Vol. 46


