2. 中药固体制剂制造技术国家工程研究中心, 江西 南昌 330006;
3. 南昌大学第二附属医院, 江西 南昌 330006
2. National Pharmaceutical Engineering Center for Solid Preparation in Chinese Herbal Medicine, Nanchang 330006, China;
3. The Second Affiliated Hospital to Nanchang University, Nanchang 330006, China
白头翁皂苷D(Pulsatilla saponin D,PSD)即3-O-α-L-吡喃鼠李糖-(1→2) [β-D-吡喃葡萄糖-(1→ 4)]-α-L-吡喃阿拉伯糖常春藤皂苷,其来源于白头翁[1]、毛酸浆浆果[2]、太白银莲花[3]、冻地银莲花[4]等植物中,具有较强的抗肿瘤活性[5, 6, 7, 8]。前期研究中发现PSD按生物药剂学分类系统(biopharmaceutical classification system,BCS)分类属于II即低溶解、高透过性的药物[9, 10],由于其溶解度低、体内吸收慢,影响生物利用度。因此,为了增加其成药性,可以通过制剂手段提高其溶解度,进而提高生物利用度。固体分散体(solid dispersion,SD)技术通过使药物高度分散于水溶性载体材料中,达到改善难溶性药物的溶解度和溶出行为,从而提高难溶性药物的生物利用度[11]。本实验以溶解度为指标考察了不同载体材料,采用红外光谱法(IR)、差示扫描量热法(DSC)以及X射线衍射法(XRD)表征了PSD-SD的形成,并对PSD-SD进行了体内外评价,通过上述研究为PSD制剂的研究开发提供参考和支撑。
1 仪器与材料高效液相色谱仪,Agilent 1260色谱泵,二级管阵列检测器(DAD),美国安捷伦科技公司;QTRAP 4500复合三重四极杆线性离子阱质谱,配备ESI离子源及Analyst 1.6数据处理软件,美国AB SCIEX;KQ-4000B型超声清洗机,巩义市予华仪器有限责任公司;ML3002E/02电子天平,梅特勒-托利多仪器(上海)有限公司;TDL-40B飞鸽牌台式离心机,上海安亭科学仪器厂制造;HH-4数显恒温水浴锅,常州国华电器有限公司;涡旋混合器,上海医科大学仪器厂;Millipore Synergy超纯水系统,美国密理博公司;GZL-0.2型冻干机,北京奥特佳美科技有限公司;DSC 8000,美国PerkinElmer股份有限公司;VERTEX 70型傅里叶红外光谱分析仪,德国布鲁克公司;Dmax2400X射线衍射仪,日本理学公司。
三七皂苷R1(NGR1),批号110745-20131,中国食品药品检定研究院;PSD,中药固体制剂制造技术国家工程研究中心中药化学室提供,经光谱鉴定为白头翁皂苷D,经DAD检测器面积归一法计算其质量分数为99.6%;甲醇,上海振兴化工一厂,色谱纯;泊洛沙姆188(F68),上海昌为医药辅料技术有限公司;聚乙烯吡咯烷酮(PVPk30),上海恒信化学试剂公司;聚乙二醇6000(PEG 6000),南京威尔化工有限公司;其他试剂均为分析纯。
健康SD大鼠,雌性,体质量(220±20)g,购自湖南斯莱克景达实验动物有限公司,合格证号SCXK(湘)2011-0003。
2 方法与结果 2.1 样品的制备 2.1.1 PSD-SD的制备取PSD和载体材料PEG 6000按1∶6质量比分别放入烧杯中,加入适量无水乙醇,超声至PSD和载体完全溶解。将溶解后的液体转移至蒸发皿中冻干,粉碎,过筛,备用。
2.1.2 物理混合物的制备取适量PSD和载体材料PEG 6000按1∶6的质量比置于研钵中,研碎,备用。
2.2 分析方法的建立 2.2.1 色谱条件采用依利特Hypersil ODS2 C18色谱柱(250 mm×4.6 mm,5 μm),以甲醇-水-甲酸(68∶32∶0.1)为流动相,体积流量为1.0 mL/min,检测波长为203 nm,柱温为30 ℃,进样量为10 μL。
2.2.2 线性关系考察精密称取PSD对照品,配制成质量浓度分别为0.08、0.16、0.32、0.48、0.64、0.80 mg/mL的系列对照品溶液,进样,记录峰面积。以峰面积(Y)对药物质量浓度(X)进行线性回归,得标准曲线方程Y=2 635.5 X+5.452 1,r=0.999 9,结果表明样品在0.08~0.80 mg/mL呈良好线性关系。
2.2.3 精密度试验取质量浓度分别为0.08、0.32、0.80 mg/mL的PSD对照品溶液,连续测定5次,计算精密度。结果显示高、中、低3个质量浓度的PSD对照品溶液峰面积RSD分别为0.15%、0.56%、1.14%。
2.2.4 重复性试验精密称取PSD-SD 6份(含主药约3 mg),置10 mL量瓶中,加甲醇溶解,记录峰面积,计算PSD质量分数。结果显示RSD为0.88%。
2.2.5 稳定性试验精密称取PSD-SD(含主药约3 mg),加甲醇溶解,分别于0、1、2、4、8、12、24 h进样测定,记录峰面积。结果RSD为0.33%,表明供试品溶液在24 h内稳定。
2.2.6 加样回收率试验精密称取PSD-SD适量(含主药约3 mg),共9份,置于25 mL量瓶中,分为3组,每组按主药量的80%、100%、120%的量分别加入PSD对照品,加甲醇至刻度,制成高、中、低3个质量浓度的供试品溶液。进样检测,记录峰面积,并计算回收率。结果平均加样回收率为(97.51±0.44)%,RSD为0.66%。
2.3 不同载体的考察取过量的PSD、PSD-PEG 6000物理混合物和PSD-SD置于具塞试管中,加水超声使其呈过饱和状态,然后在(37.0±0.5)℃水浴中平衡24 h后取出,离心,取上清液,稀释,滤过。分别精密吸取10 μL进样检测,计算溶解度,结果见表 1。可知,制成SD后PSD溶解度明显有所增加,不同比例载体材料对PSD溶解度增加有所不同。以F68为载体制备的SD中,当PSD和F68比例为1∶4时,溶解度达到最大值为6.75 mg/mL;以PVPk30为载体制备的SD中,当PSD和PVPk30比例为1∶8时,溶解度达到最大值为6.03 mg/mL;以PEG 6000为载体制备的SD中,当PSD和PEG 6000比例为1∶6时,溶解度达到最大值为7.06 mg/mL。根据溶解度大小关系,最终确定载体材料为PEG 6000,且比例为1∶6。
| 表 1 不同载药材料对PSD溶解度的影响 Table 1 Effects of different carriers on solubility of PSD |
采用KBr压片法制备样品,扫描范围为400~4 000 cm−1,分辨率为4 cm−1,分别对PSD、PEG 6000、物理混合物及PSD-SD进行IR分析,结果见图 1。可见,PSD在波长1 690.19 cm−1和3 418.34 cm−1处有2个吸收峰,分别是药物的νC=O键和νOH键;在物理混合物中,PSD和载体PEG 6000的吸收峰均有显现,而PSD-PEG 6000(1∶6)SD中PSD于1 690.19 cm−1的吸收峰消失,3 418.34 cm−1处吸收峰变宽钝,提示SD已形成,且PSD与PEG 6000之间可能以氢键的形式结合。
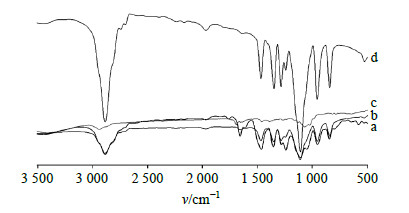 | 图 1 物理混合物 (a, 1∶6)、PSD-SD (b, 1∶6)、PSD (c) 及PEG 6000 (d) 的IR图 Fig.1 IR spectra of physical mixture (a, 1∶6), PSD-SD (b, 1∶6), PSD (c), and PEG 6000 (d) |
以空铝坩埚为参考池,另一空铝坩埚中放入约10 mg的样品,按程序升温加热(升温速率10 ℃/min,扫描范围0~250 ℃),氮气体积流量为40 mL/min,分别对PSD、载体、PSD-SD及物理混合物样品进行分析。结果见图 2。由图 2可以看出,PEG 6000在66.49 ℃有1个熔融峰;PSD在228.59 ℃有1个熔融峰;物理混合物的DSC图中可以明显地看到PEG 6000的熔融峰和PSD的熔融峰,但位于227.63 ℃的特征吸热峰前移,这可能是由于在升温过程中药物与载体之间部分形成氢键从而导致PSD在载体中晶形发生改变。而在PSD-PEG 6000(1∶6)SD的DSC图中,PSD的熔融峰消失,说明共沉淀物中不存在药物结晶,PSD以无定形状态分散于载体中。
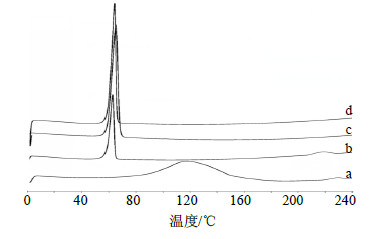 | 图 2 PSD (a)、物理混合物 (b, 1∶6)、PEG 6000 (c) 及PSD-SD (d, 1∶6) 的DSC图 Fig.2 DSC scanning of PSD (a), physical mixture (b, 1∶6), PEG 6000 (c), and PSD-SD (d, 1∶6) |
将PSD原料药、PEG 6000、PSD-SD及物理混合物填塞于样品皿中,采用Cu-Kα靶,40 kV电压,300 mA电流,在5°~70°以1.2°/min速率进行扫描,并绘制XRD图。结果见图 3。由图 3可见,PEG 6000在19.065°和23.798°处有强吸收,物理混合物的谱线中PSD和PEG 6000的各特征峰均明显存在。而在PSD-PEG 6000(1∶6)SD的谱线中,PSD结晶衍射峰消失,说明PEG 6000能有效地抑制PSD形成结晶,在PEG 6000载体中PSD以无定形状态存在。
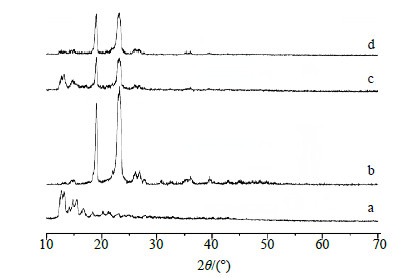 | 图 3 PSD (a)、PEG 6000 (b)、物理混合物 (c, 1∶6) 及PSD-SD (d, 1∶6) 的XRD图 Fig.3 XRD of PSD (a), PEG 6000 (b), physical mixture (c, 1∶6), and PSD-SD (d, 1∶6) |
参照《中国药典》2010年版二部附录XC溶出度测定法中的转篮法进行测定,分别称取PSD原料药、PSD-PEG 6000(1∶6)SD及PSD与PEG 6000的物理混合物(1∶6)适量(符合漏槽条件),置6个溶出杯中,溶出介质为蒸馏水,体积为500 mL,转速100 r/min,水浴温度为(37.0±0.5)℃。以绸布包裹转篮,进行实验,待转篮接触介质时开始计时,分别于5、10、15、30、45、60、90、120、180、240、300、360、420 min取样2 mL,同时补充同体积同温度的新鲜溶出介质,样品经0.45 μm微孔滤膜滤过。按照“2.2.1”项下色谱条件进行测定,计算PSD的质量浓度,并求出累积释放率,绘制溶出曲线,结果见图 4。由图 4可知,PSD-PEG 6000-SD 5 min药物累积释放率达到了32%,而PSD原料与物理混合物5 min药物累积释放率仅为25%,说明制成SD有利于药物快速释放。60 min时PSD-PEG 6000-SD的药物累积释放率达到了90%,PSD与物理混合物药物累积释放率达到90%需要300 min。
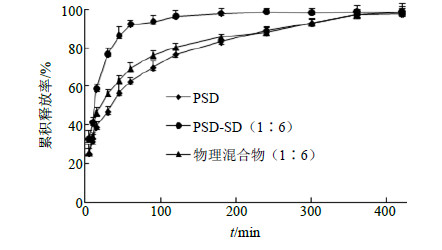 | 图 4 PSD、PSD-SD (1∶6) 与物理混合物 (1∶6) 释放曲线图Fig.4 Dissolution curves of PSD, PSD-SD (1∶6), and physical mixture (1∶6) |
取SD大鼠12只,随机分为2组,每组6只,正常饲养1周,实验前禁食12 h,自由饮水。第1组按100 mg/kg的剂量ig PSD混悬液(取PSD加至0.5% CMC-Na水溶液中,置研钵中研磨30 min,即得),第2组按含100 mg/kg PSD的剂量ig PSD-SD混悬液(同PSD制备法)。分别于给药后5、10、20、30 min及1、2、4、6、8、12、24、36、48、60 h从大鼠眼眶后静脉丛取血约300 μL,置肝素化离心管中,6 500 r/min离心5 min,并立即离心分离血浆,置−20 ℃冰箱中冷冻保存,备测。
2.6.2 血浆样品的处理取血浆样品100 μL置1.5 mL EP管中,加入100 μL内标溶液(NGR1,质量浓度80 ng/mL),涡旋3 min,混合均匀,加甲醇600 μL,涡旋5 min,离心(15 000 r/min)5 min,取上清液置1.5 mL EP管中,40 ℃氮吹仪吹干,残渣加甲醇100 μL,超声复溶,涡旋3 min,离心(15 000 r/min)5 min,取70 μL加入内衬管中用于进样分析。
2.6.3 质谱条件离子源为ESI源(气动辅助电喷雾离子化);离子化条件:离子喷射电压为−4 500 V,离子源温度为600 ℃,辅助气体1(GS1,N2)为344.75 kPa,辅助气体2(GS2,N2)为344.75 kPa;离子检测方式为多反应监测(MRM);离子极性为负离子;检测离子:PSD为m/z 911.3→603.2,去簇电压(DP)为−180 V,碰撞能量(CE)为−77 V;内标NGR1为m/z 931.6→637.2,DP为−190 V,CE为−50 V。
2.6.4 液相条件色谱柱为Phenomenex C18柱(50 mm×2.00 mm,4 μm);体积流量为0.6 mL/min;进样量2 μL;流动相为0.1%甲酸水溶液-甲醇。采用梯度洗脱:0~1.0 min,10%甲醇;1.0~2.7 min,10%~80%甲醇;2.7~4.0 min,80%~90%甲醇;4.0~5.0 min,90%~10%甲醇。
2.6.5 专属性实验取大鼠空白血浆100 μL,按“2.6.2”项下方法处理,进行LC-MS分析,结果表明在选定的色谱条件下,内标和PSD可实现完全分离。血浆样品中的内源性物质和代谢产物不会干扰PSD的定量测定。色谱图见图 5。
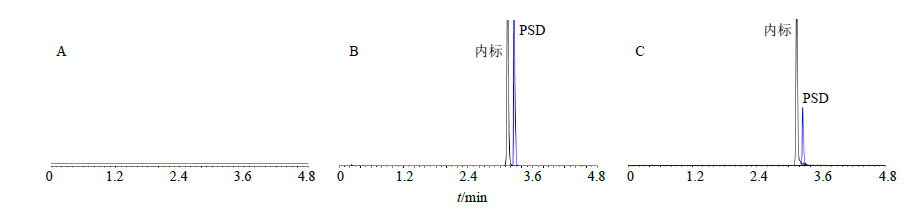 | 图 5 空白血浆 (A)、空白血浆+PSD+内标 (B) 和给药后血浆+内标 (C) 的色谱图 Fig.5 Chromatograms of blank plasma (A), blank plasma spiked with PSD + NGR1 (B), and plasma sample (C) |
取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入25 μL质量浓度为4、20、40、200、400、2 000、4 000 ng/mL的PSD系列对照品溶液,分别加入100 μL内标(NGR1,质量浓度为80 ng/mL),按“2.6.2”项下处理,使其最终质量浓度分别为1、5、10、50、100、500、1 000 ng/mL,按确定色谱条件进样分析。以样品中PSD的质量浓度为横坐标(X),以PSD与内标的峰面积的比值为纵坐标(Y)进行线性回归,得线性回归方程为Y=0.015 9 X+0.071 4,r=0.996 6。结果表明血浆样品中PSD在1~1 000 ng/mL呈良好的线性关系,且方法的定量下限为1 ng/mL。
2.6.7 基质效应取不同大鼠空白血浆共6份,按“2.6.2”项下方法吹干,残渣加入100 μL质量浓度为50 ng/mL PSD和80 ng/mL内标溶液的混标溶液,制成样品A。另取质量浓度400 ng/mL PSD对照品溶液100 μL,共6份,分别置1.5 mL EP管中,各加入100 μL质量浓度为800 ng/mL内标溶液,再加入600 μL甲醇,涡旋5 min,制成样品B。分别取样品A、B进样,记录各自的色谱峰面积,并计算基质效应(基质效应=A色谱峰面积/B色谱峰面积)。结果表明未发现基质对PSD和内标有明显的离子抑制或者离子增强效应。
2.6.8 精密度和准确度的测定取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,按“2.6.2”项下分别制成1、50、500 ng/mL低、中、高3个质量浓度的质控样品。以当日的标准曲线计算样品中PSD的量,连续进样5次测定日内精密度。同时连续3 d重复操作,计算日间精密度。根据公式计算样品的准确度(准确度=平均测量值/真实值)。结果显示,低、中、高3个质量浓度质控样品日内精密度的RSD分别为13.52%、2.56%、2.62%,准确度分别为100.8%、99.4%、101%;日间精密度的RSD分别为12.97%、3.00%、2.46%,准确度分别为104.3%、99.8%、100.8%。
2.6.9 稳定性考察取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,按“2.6.2”项下分别制成1、50、500 ng/mL低、中、高3个质量浓度的样品。样品在室温放置24 h后进行LC-MS测定,计算3个质量浓度的血浆样品中PSD的量,并求出其相对误差,考察样品在室温放置期间的稳定性。
取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,加入内标溶液后室温放置6 h,按“2.6.2”项下分别制成1、50、500 ng/mL低、中、高3个质量浓度的样品。按色谱条件进行检测,并计算3个质量浓度的血浆样品中PSD的量,求出其相对误差,考察样品与内标溶液在室温条件的稳定性。
取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,按“2.6.2”项下分别制成1、50、500 ng/mL低、中、高3个质量浓度的样品。经反复3次−20 ℃冷冻,室温融化后测定样品中PSD的质量浓度,考察样品在冷冻和冻融条件下的稳定性。
取大鼠空白血浆100 μL置1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,按“2.6.2”项下分别制成1、50、500 ng/mL低、中、高3个质量浓度的样品。−20 ℃冰箱贮藏1个月后测定样品质量浓度,以考察样品在冷冻贮藏期间的稳定性。
结果显示样品在室温放置期间的稳定性、样品与内标溶液在室温条件的稳定性、样品在冷冻和冻融条件下的稳定性和样品在冷冻贮藏期间的稳定性均良好。
2.6.10 回收率试验取大鼠空白血浆100 μL置于1.5 mL EP管中,分别加入4、200、2 000 ng/mL系列PSD对照品溶液,按“2.6.2”项下方法分别制成含PSD质量浓度为1、50、500 ng/mL低、中、高3个质量浓度的样品A。另取大鼠空白血浆,按“2.6.2”项下方法吹干样品,残渣分别加入100 μL质量浓度为1、50、500 ng/mL的PSD对照品溶液制成样品B。分别取样品A、B进样,记录各自的色谱峰面积,并计算回收率(回收率=A色谱峰面积/B色谱峰面积)。结果高、中、低3个质量浓度样品的提取回收率分别为(84.9±2.08)%、(91.8± 1.56)%、(87.6±1.26)%。
2.6.11 数据处理药动学参数由软件WinNonlin 5.2计算得到,结果见图 6和表 2。从表 2可知,大鼠ig给予PSD后,t1/2为1 137.89 min,达峰时间(tmax)为30 min;大鼠ig给予PSD-SD后,t1/2为1 169.09 min,tmax为22 min,AUC0~∞达到了60 008 ng∙min/mL,是原料药PSD AUC0~∞的2.24倍。
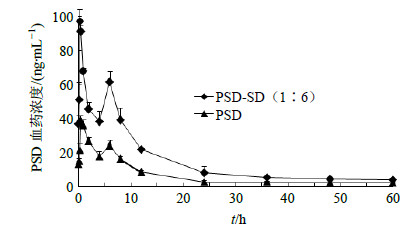 | 图 6 PSD-SD (1∶6) 与PSD大鼠ig给药 (100 mg/kg) 药时曲线Fig.6 Drugs-time curve about PSD (1∶6) and PSD in rats after ig administration (100 mg/kg) |
| 表 2 PSD-SD和PSD大鼠ig给药 (100 mg/kg) 主要药动学参数 Table 2Pharmacokinetic parameters of PSD and PSD-SD (100 mg/kg) in rats after ig administration |
分别建立了HPLC法和LC/MS方法测定PSD的量,所建立的方法专属性强、稳定、重现性好,为PSD体外溶出度的测定和体内血浆样品定量测定奠定了坚实基础。
为了能够保持样品制备方法一致性,确定了SD采用溶剂法。为保证反应达到完全,或避免溶剂蒸发时由于溶解度小的问题使PSD单独析出从而影响产物的形成,因此选择了无水乙醇作为PSD-SD反应溶剂。采用冻干法干燥制备的SD可以有效防止固体分散形成“胶状”物,有利于SD的干燥和粉碎[12]。采用了IR、DSC及XRD 3种方法表征了PSD-SD的形成,结果表明PSD以非结晶态无定形存在于PEG 6000中,从而大大增加了PSD溶解时的表面积,有利于药物的溶出。
体外溶出行为表明PSD制成SD后累积溶出率明显高于PSD和物理混合物,说明制成SD后有利于加速PSD的溶出。大鼠ig给药同剂量的PSD及形成的SD药动学结果表明,与PSD原料药口服同剂量给药相比较,SD的tmax、Cmax、AUC0~∞均有显著差异(P<0.05、0.01)。tmax提前且Cmax增加,与体外溶出行为相吻合,说明体内外相关性较好。PSD-SD的AUC0~∞是原料PSD的2倍多,说明PSD研制成SD后相对生物利用度提高了2倍多,进而表明增加了药物吸收。PSD与其SD体外溶出结果与体内药动学结果呈现了体内外一致性。
| [1] | Kang S S. Saponins from the roots of PμLsatilla koreana[J]. Arch Pharm Res, 1989, 12(1): 42-47. |
| [2] | 贾远敏. 毛酸浆浆果的化学成分研究 [D]. 苏州: 苏州大学, 2013. |
| [3] | 王啸洋. 太白银莲花活性成分研究 [D]. 西安: 第四军医大学, 2011. |
| [4] | 廖 循, 陈耀祖, 丁立生, 等. 冻地银莲花的化学成分[J]. 天然产物研究与开发, 1999, 11(4): 1-6. |
| [5] | Mi K S, Kyung H J, Sang W H, et al. SB365, Pulsatilla saponin D suppresses the proliferation of human colon cancer cells and induces apoptosis by modulating the AKT/mTOR signaling pathway[J]. Food Chem, 2013, 136(1): 26-33. |
| [6] | Sang W H, Kyung H J, Hee S L, et al. SB365 inhibits angiogenesis and induces apoptosis of hepatocellular carcinoma through modulation of PI3K/Akt/mTOR signaling pathway[J]. Cancer Sci, 2012, 103(11): 1929-1937. |
| [7] | Yong K, Seong C B, Ji H L, et al. Pulsatilla saponin D: the antitumor principle from Pulsatilla koreana[J]. Arch Pharm Res, 2004, 27(9): 915-918. |
| [8] | Bang S C, Lee J H, Song G Y, et al. Antitumor activity of Pulsatilla koreana saponins and their structure-activity relationship[J]. Chem Pharm Bull, 2005, 53(11): 1451-1454. |
| [9] | 饶小勇, 尹 姗, 张国松, 等. HPLC测定PSD的油水分配系数及平衡溶解度[J]. 中国中药杂志, 2014, 39(9): 1593-1596. |
| [10] | 饶小勇, 龚 明, 尹 姗, 等. PSD在大鼠肠道的吸收行为研究[J]. 中草药, 2013, 44(24): 3515-3520. |
| [11] | 陈 超, 周福军, 刘时乔, 等. 固体分散技术在中药制剂中的应用[J]. 药物评价研究, 2011, 34(4): 279-282. |
| [12] | 刘 颖, 常 江, 韩美华, 等. 异烟肼缓释固体分散体的制备及其体外评价[J]. 中国现代应用药学, 2011, 28(2): 142-145. |
 2015, Vol. 46
2015, Vol. 46


